樱桃缓慢生长保存及遗传稳定性检测
(1.贵阳学院生物与环境工程学院,贵州 贵阳 550003;2.贵阳市农业试验中心,贵州 贵阳 550003)
赫章樱桃(Prunuspseudocerasus‘Hezhang’)是贵州重要的樱桃种质资源,具有可溶性固形物含量高、产量高及口感好等优点,是遗传育种的重要资源。但目前,田间植株疑似有病毒感染,且资源破坏变得越来越严重,因此,需要建立有效的方法进行资源保存。资源保存的传统方法是田间保存,需要大量的土地、劳力及财力投入,且容易遭受病虫害、动物及自然灾害的破坏[1]。离体保存的确是资源保存的安全方法,能避免传统方法的不足之处,亦是良种、转基因材料及突变植株保存的有效方法[2]。
离体保存分为短期保存(离体快繁)、中期保存(缓慢生长保存)和长期保存(超低温保存)。短期保持需要频繁的继代,增加了劳动力成本和体细胞无性系变异的几率,而中期保存和长期保存后能克服这些问题,但超低温保存不仅技术要求高,且需要持续消耗液氮,这限制了其应用[1,3]。然而,中期保存操作相对简单易行,只需要常规组培室或培养箱即可进行[4],且能通过再生培养快速获得大量植株,避免田间植株供应不足的情况[5]。中期保存常通过降低培养温度[6-7]、增加渗透调节剂[8]、增加生长抑制剂或减少植物生长调节剂[4,9],以及多种方法综合应用达到培养的目的。如今,许多植物已实现中期保存(缓慢生长保存),包括半夏[10]、百合[11]、苹果[12-13]、马铃薯[14]、鬼臼[15]、葡萄[16-17]等。尽管许多学者探讨了樱桃的离体快繁方法[18-26],但有关缓慢生长保存的报道却很少,目前能查阅的仅知Janeiro等[27]将野樱桃在2 ℃下保存了1年,却未见有关中国樱桃的报道。
鉴于樱桃种质资源的重要性,本文采用赫章樱桃组培苗的茎尖繁殖单芽姊妹系进行缓慢生长保存,同时采用ISSR标记检测组培苗的遗传稳定性,以期为樱桃资源保存提供更多参考方法。
1 材料及方法
1.1 缓慢生长保存
2009年6月至2010年12月以贵州省赫章县的樱桃种质组培苗为材料,在MS + 2.0 mg·L-1BA + 0.5 mg·L-1IBA + 30 g·L-1蔗糖 + 0.7%琼脂培养基上培养60 d后继代,以此建立单芽姊妹系,2010年12月底选取1.0~1.5 cm高的植株用于缓慢生长保存,保存至2011年8月,培养温度25 ℃。缓慢生长保存设置以下培养基:1)矿质元素影响。以MS、1/2 MS和1/4 MS为基础培养基,均添加2%蔗糖(表1),培养温度为6 ℃。2)PVP(聚乙烯吡咯烷酮)和温度的影响。以1/2 MS + 0.5 mg·L-1BA + 0.1 mg·L-1IBA+20 g·L-1蔗糖 + 40 g·L-1甘露醇 + 0.7%琼脂为基础培养基,分别添加0、400 mg·L-1PVP后置于6 ℃和25 ℃培养(表1)。3)蔗糖和ABA(脱落酸)的影响。以1/2 MS + 0.5 mg·L-1BA + 0.1 mg·L-1IBA + 400 mg·L-1PVP + 0.7%琼脂为基础培养基,分别添加0%、2%、4%及6%蔗糖或0,1,2 mg·L-1和3 mg·L-1ABA后置于25 ℃培养(表1)。4)甘露醇的影响。以1/2 MS + 0.5 mg·L-1BA + 0.1 mg·L-1IBA + 20 g·L-1蔗糖 + 400 mg·L-1PVP + 0.7%琼脂为基础培养基,分别添加0%、2%、4%及6%甘露醇后置于25 ℃培养(表1)。每个处理接种5株试管苗,重复8次。

表1 各种物质对赫章樱桃缓慢生长保存的影响
注:同列相同字母表示经邓肯氏多重极差检验在0.05水平上差异不显著。
每个接种瓶(约250 mL)中放置50 mL培养基,然后用1层牛皮纸和1层聚乙烯膜进行封口,所有培养基pH值均为5.8,经121 ℃高温灭菌20 min后用于接种,光照时间为14 h[33μmol·(m2·s)-1]。分别于培养4、6个月和8个月后统计成活率,8个月后统计增殖率及植株生长势,随后组培苗将在MS+2.0 mg·L-1BA+0.5 mg·L-1IBA+30 g·L-1蔗糖+0.7%琼脂培养基上进行恢复培养,30 d后统计再生率。植株生长势分为0~5级:0级为死亡;1级为褐色,部分黄化;2级为植株矮小,有淡绿色至绿色叶片;3级为植株矮小,有深绿色叶片和茎,无根;4级为植株高大,有绿色叶片和茎,无根;5级为植株高大,有深绿色叶片和茎,有根。
数据统计采用SPSS 17.0软件,成活率、增殖率用单因素方差分析差异显著性,并进行Tukey’s HSD检测,再生率采用t检测差异显著性,数据处理前进行方差齐性检测。
1.2 遗传稳定性的ISSR检测
2011年9月取各处理保存前后的组培苗数株,取其叶片分别建立各处理混合样本,采用北京天根公司生产的Plant Genomic DNA Kit(DP 305-03)试剂盒提取混合样本基因组DNA,0.8%琼脂糖凝胶电泳和紫外分光光度计测定DNA质量及浓度,稀释至20 ng·μL-1,-20 ℃保存备用。ISSR引物参照加拿大哥伦比亚大学(UBC)公布的序列(http://zhidao.baidu.com/question/141178305.html),由上海生物工程技术服务有限公司合成。本实验从90条ISSR引物中筛选获得13条扩增条带清晰、多态性及稳定性好的引物用于遗传稳定性检测(表1)。PCR扩增体系为(总体积20μL):引物1.0 mmol·L-1,DNA模板2.5 mg·μL-1,Tagmix(天根生化科技北京有限公司)10.0μL-1,甲酰胺0.5μL-1。PCR反应程序为94 ℃预变性4 min;94 ℃变性30 s,49.1~56 ℃(温度因引物不同而异)退火45 s,72 ℃延伸90 s,30个循环;最后72 ℃延伸7 min,4 ℃保存。PCR产物在含EB的1.5%琼脂糖凝胶中以90 V恒定电压电泳1 h左右,DL 2000 Marker(天根生化科技北京有限公司)为标准分子量对照,紫外凝胶成像系统照相。
2 结果与分析
2.1 矿质元素、温度和PVP对试管苗保存的影响
矿质元素与植物保存有很大关系,但对樱桃成活率无显著影响,对再生率有显著影响(表2)。保存至4个月时,MS培养基上樱桃的成活率最高(80%),6个月时急剧降至50%,8个月仅40%,而1/2 MS、1/4 MS培养基上樱桃的成活率在4个月时分别为55%、60%,但随后几乎无变化。8个月后,MS培养基上樱桃的再生率为0,而1/2 MS、1/4 MS的的再生率分别为37.5%、54.17%。在生长势上,4个月时各处理樱桃苗均矮小,叶浓绿色,无增殖;6个月后,以1/4 MS的苗最优,相对高大,叶绿至浓绿色,无根,1/2 MS的苗几乎无变化,仅有1株生根,而MS的苗为淡绿色;8个月时MS的苗为淡绿色和黄色,近死亡(图1-16)。因此,低温下,矿质元素含量较低时更利于樱桃缓慢生长保存。
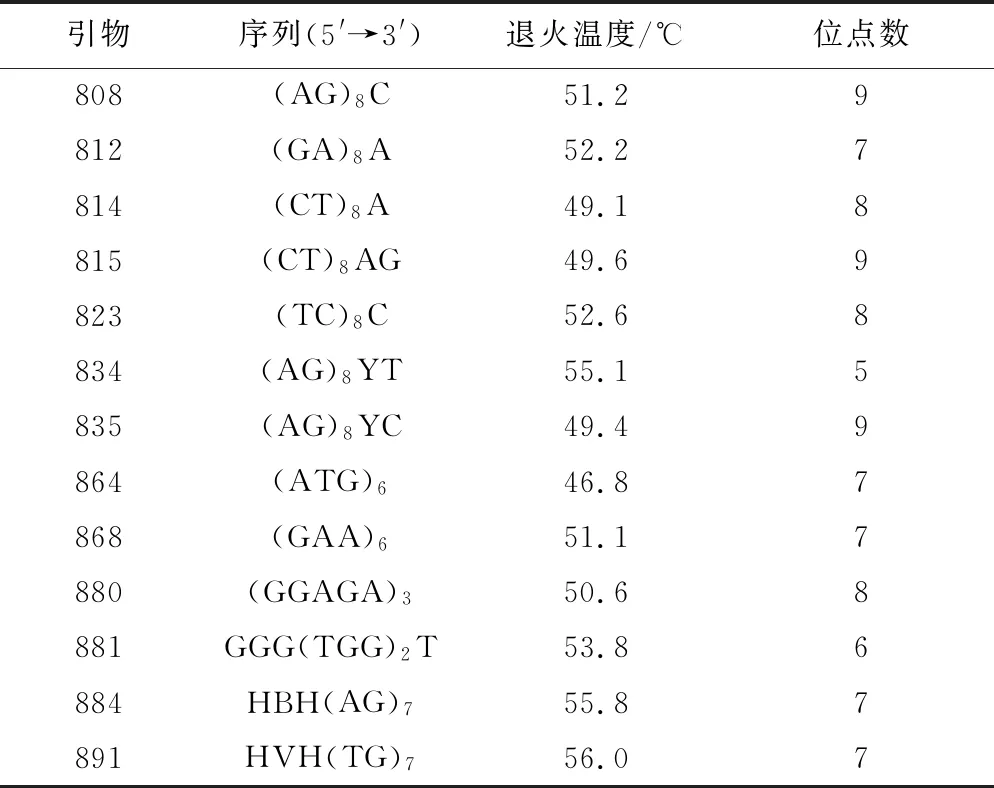
表2 ISSR检测13条引物的退火温度及其扩增结果
低温是植物缓慢生长保存的重要方式,PVP是一种有效的抗氧化剂。本实验将二者进行交互处理,结果显示,培养温度对樱桃保存有显著影响(表1)。保存前6个月,6 ℃下樱桃的成活率高于25 ℃下的成活率。在4个月时,6 ℃下樱桃的成活率为100%,25 ℃下的成活率为65%;在6个月时,6、25 ℃下的成活率分别为95%、65%;在8个月时,6 ℃下的成活率急剧降至65%,但25 ℃下的成活率几乎无变化(60%);8个月后,25 ℃下樱桃的再生率显著高于6 ℃下的再生率,分别为66.67%和12.5%。二者生长势以25 ℃下为好(图1-13、图1-14)。因此,在培养基添加物质较多的情况下,25 ℃比低温更适合樱桃缓慢生长保存。
PVP对樱桃中长期保存后的再生率有积极作用(表1)。高温下(25 ℃),在培养初期(4个月时),PVP对樱桃成活率有抑制作用,无PVP时为95%,而有PVP时仅为65%,但随保存时间的延长,无PVP时成活率急剧下降,6个月和8个月时分别为75%和55%,而有PVP的几乎没有变化。从生长势上看,6个月前,有PVP上的苗叶色浓于无PVP者,无增殖;8个月时,无PVP的反而为浓绿色,苗矮小,有茎较粗,增殖约4倍。但从再生率考虑,8个月后无PVP的仅为12.5%,显著低于添加PVP的(67%)。低温下(6 ℃),PVP在培养初期(4个月时)可显著提高成活率,有PVP时樱桃成活率为100%,无PVP时仅为55%,且有PVP的一直优于无PVP的,再生率和苗生长势亦如此(图1-12、图1-14)。因此,樱桃中长期保存时添加PVP可提高再生率。
2.2 蔗糖和甘露醇对樱桃缓慢生长保存的影响
蔗糖是离体保存的重要渗透调节剂和碳源,有无蔗糖对樱桃缓慢生长有显著影响,但浓度的高低对其成活率无显著影响(表1)。保存4个月时,无蔗糖培养基上樱桃成活率仅有30%,而2%~6%蔗糖培养基上成活率为70%以上,随后均略有下降;保存到8个月时,无蔗糖培养基上樱桃已全部死亡,其余为65%及以上。再生率以2%蔗糖稍高(85.42%),其次是4%蔗糖(80%),最后是6%蔗糖(76.77%)。对生长势而言,无蔗糖时樱桃苗叶色淡绿或黄色,植株矮小,略有增殖;2%和4%蔗糖时苗相对高大,健壮,叶绿至浓绿色,增殖较多。在4个月时,2%蔗糖培养基上有多株生根;在8个月时,二者都有生根;6%蔗糖培养基上苗相对矮小,叶浓绿色,增殖较少,无根(图1-1、图1-2、图1-3)。因此,选择2%~4%的蔗糖为好。
甘露醇也是离体保存常选择的碳源,对樱桃中期保存有显著的影响(表1)。4个月时,6%甘露醇培养基上樱桃的成活率显著高于其余浓度,但6个月时降至60%,8个月时急剧降至35%,其余几乎保持不变。无甘露醇时再生率为85.42%,2%甘露醇时为83.33%,显著高于4%甘露醇(67%)和6%甘露醇(0)时。由图1-4、图1-5、图1-6可见,在生长势上,无甘露醇时苗相对高大健壮,叶绿至浓绿色,增殖多,有生根;2%和4%甘露醇时相对较矮,叶浓绿色,增殖少,无根,而6%甘露醇时更矮,叶淡绿至绿色,增殖少,且有玻璃化现象;4%蔗糖培养基与2%蔗糖+2%甘露醇培养基上的苗相比,生长势更好。因此,甘露醇以不超过2%为宜。
2.3 ABA对樱桃缓慢生长保存的影响
适当添加ABA对樱桃中期保存有积极作用(表1)。

注:1~3是添加2%、4%和6%蔗糖植株;4~6是添加2%、4%和6%甘露醇植株;7~10是添加1、2 mg·L-1 和3 mg·L-1ABA植株(9和10是添加3 mg·L-1 ABA植株);11是添加3%甘油植株(数据未列出);12是添加400 mg·L-1 PVP于6 ℃保存的植株;13是添加0 mg·L-1 PVP于25 ℃保存的植株;14是添加0 mg·L-1 PVP于6 ℃保存的植株;15~17是在1/2 MS、MS和1/4 MS上保存的植株。图1 赫章樱桃缓慢生长保存8个月后的植株

注:泳道M为分子量标记,1~16泳道分别代表以下处理的单芽姊妹系植株:1是保存前;2~4是添加2%、4%和6%蔗糖植株;5~7是添加2%、4%和6%甘露醇植株;8~10是添加1、2 mg·L-1和或3 mg·L-1 ABA植株;11是添加400 mg·L-1 PVP于6 ℃保存的植株;12是添加0 mg·L-1 PVP于25 ℃保存的植株;13是添加0 mg·L-1 PVP于6 ℃保存的植株;14~16是在1/2 MS、MS和1/4 MS上保存的植株。图2 缓慢生长保存的遗传稳定性
在4个月时,无ABA培养基上樱桃的苗成活率仅30%,而添加ABA后,苗成活率除3 mg·L-1ABA为40%外,其余为80%以上;在6个月时,1 mg·L-1及4 mg·L-1ABA上苗成活率急剧降至60%,而2 mg·L-1ABA上为80%;8个月时,1 mg·L-1及4 mg·L-1ABA培养基上樱桃的苗成活率进一步降至35%和45%,而2 mg·L-1ABA培养基上苗成活率为70%。尽管2 mg·L-1ABA培养基上的苗成活率显著高于1 mg·L-1ABA上的,但其再生率却显著低于1、4 mg·L-1培养基上的。从生长势上看(图1-7、图1-8、图1-9、图1-10),无ABA的苗矮小,叶淡绿色,部分黄色,而有ABA的苗均高大,叶淡绿至绿色,叶片宽大,冠幅大,增殖极少,无根。因此,适量的ABA可以延长樱桃保存。
2.4 遗传稳定性检测
图2为赫章樱桃缓慢生长保存中的ISSR检测电泳图(引物815),由图2可见,保存前后的15个处理中,13条ISSR引物共获得97个位点,未发现特异条带,平均每条引物获得7.5个位点。使用目前的中期保存办法,经过240 d的培养并未检测到体细胞无性系变异。
3 讨 论
本试验结果发现,低温下矿质元素含量较低时更利于樱桃缓慢生长保存。原因可能是低温下植物新陈代谢变慢,因为低温下细胞膜积累了不饱和脂肪酸,后者使细胞膜变薄并阻止细胞分裂和伸长[28-29]。Kotuby等[30]认为樱桃对盐敏感。低温下,如果培养基中有较多的矿质元素,也许起初植物能吸收并利用,但随着时间延长,新陈代谢的减弱,植物体内会积累过多的矿质元素,从而形成毒害。因此,我们认为1/4 MS和1/2 MS比MS更适合樱桃在低温下进行保存。雪松茎尖保存时,也以1/2 MS和1/4 MS为好[31]。苹果在低温下以1/4 MS为好[13]。低温培养是一种植物缓慢生长保存的主要方式,且有效应用于多种果树[12,32-35],本研究发现,无论培养基中有无PVP,樱桃在25 ℃下比6 ℃下表现更好,特别是苗生长势和再生率。可能此时培养基有很多营养物质,低温不利于樱桃保存,原因与上述一致。Janeiro等发现,野樱桃低温冷藏时间越长,增殖能力越低[27]。El-Ashry等发现,低温不利于2种枣椰树的中期保存[6]。同时,Watt等认为,低营养水平的培养基并不适合甘蔗的中长期保存[36]。也许其他方式更适合樱桃缓慢生长保存,比如PVP便能增加组培苗再生率,渗透调节剂的浓度和种类对植物保存尤为重要。
合适渗透调节剂种类和浓度将大大提高保存效果,蔗糖为首选物质,其次是甘露醇[37]。本实验发现,2%~4%的蔗糖对樱桃缓慢生长保存更好,而非6%蔗糖。高浓度的蔗糖并不利于小豆中期保存[38]。Neveen等将葡萄缓慢生长保存1年,2%和6%的蔗糖分别获得66.66%和33.33%成活率[16]。Pan等也发现,6%蔗糖培养基上的葡萄培养8个月便全部死亡[17]。但本实验保存8个月时,4%和6%蔗糖上的植株仍有约70%的成活率,也许樱桃比葡萄更能适应高浓度蔗糖,原因可能是不同的植物对水分需求不一样所致,樱桃更耐旱。几乎已有报道均认为植物更适合低浓度的蔗糖,Shibli等认为,原因可能是蔗糖主要是作为碳源,而非渗透调节剂[37],笔者认为也许高浓度的蔗糖使培养基渗透式升高,使得植株不能吸收足够水分以供生长。甘露醇虽然是一种可用的渗透调节剂,但本实验发现,超过2%的甘露醇便不利于樱桃缓慢生长保存,且完全使用蔗糖比蔗糖和甘露醇混合使用效果更好。鬼臼缓慢生长保存加入蔗糖和甘露醇后植株黄化,二者单独或混合使用浓度到4%时,成活率及再生率均下降,并认为甘露醇对植株有毒害性[15]。虽然甘露醇能抑制植株生长,但多种苹果保存显示甘露醇单独使用不利于缓慢生长保存,保存时间仅约3个月[13,39]。狭叶香[9]和番红花[40]缓慢生长保存时也不适应高浓度甘露醇,植株高度随着浓度升高而降低。Neto和Otoni认为,甘露醇含量的增加引起植株碳水化合物毒害或渗透压过高[41]。
ABA是一种生长抑制剂,本实验发现,添加少量的ABA有利于樱桃缓慢生长保存,尤其是使组培苗增高,但其他效果并不理想。Kovalchuk等也认为,部分苹果种质缓慢生长保存时无ABA更好[13]。培养基添加0.5 mg·L-1ABA培养基上保存1年的白草蒿可再生,但2.0 mg·L-1ABA时不能再生[8]。狭叶香再生率随ABA浓度升高而急剧下降[9]。树胡椒组培苗的各项指标都随ABA浓度的升高而下降[42]。徐志微等也认为ABA 不适于离体保存巨玫瑰、黑玫瑰葡萄组培苗[43]。同时,Renau等认为ABA会引起雪松缓慢生长保存中的甲基化[31]。王爱华等也发现,在2.0 mg·L-1ABA上保存半夏出现了1条新增标记和1条缺失标记,个体变异率为30%[10]。因此,不建议在樱桃缓慢生长保存时添加ABA,但若需要创造新资源,使用ABA进行保存也许是一个方法。同时,本试验过程中发现,所有添加甘油的培养基上的植株均死亡,说明甘油不能用于樱桃中期保存。

