红花瘤果茶种子萌发的温光调控及生理特性变化研究
郭米香1,吕晓梅2,洪 江,刘海燕4,邹天才
(1.贵州大学林学院,贵阳 550025;2.黔西南布依族苗族自治州南盘江国有林场,贵州 兴义 562400;3.贵州科学院,贵阳 550001;4.贵州省植物园,贵阳 550004)
红花瘤果茶(CamelliarubituberculataChang ex Lin et Lu)是贵州特有珍稀植物[1-2],分布于常绿阔叶落叶混交林亚乔木层或灌木层,高可达4~6 m,颇具经济价值,花红色或粉红色、花期长,树形优美,木质坚硬,是优良的园林植物和经济用材[3]。主要分布在贵州省黔西南州兴仁县和晴隆县的喀斯特山区,分布区极为狭窄、数量稀少,以岩生为主[4]。种子的萌发需要特定的温度,这主要是因为种子内部各种参与生理作用的酶需要适宜温度的激活,大多数植物种子萌发对光的反应不敏感,但也有部分种子需要在光照或黑暗条件下才能萌发[5]。红花瘤果茶种子属于硬实种子,具备顽拗性种子粒大而重的特点[6],本试验研究了红花瘤果茶的种子萌发的最佳萌发温度及萌发过程中生理特征的变化,探讨了其种子萌发对光的需求及促进种子萌发的最佳处理方法,为解决提高特有植物红花瘤果茶扩繁的科学问题以及开展红花瘤果茶的引种栽培应用提供科学依据。

表1 采种区生境概况

表2 红花瘤果茶种子基本情况
1 材料与方法
1.1 采种概况
采种区位于贵州省晴隆县紫马乡龙头村上捧碧林区(表1),地处喀斯特沙页岩镶嵌的高原峡谷,海拔高度1 100~1 150 m,岩石裸露达60%~80%,为典型的高原亚热带湿润季风气候,降水丰富,雨热同期,主要土壤为黑色石灰土,土质疏松,土层厚度差异大、土被不连续,有机质含量高[4-5]。采集种子皆为当年结实的鲜种子(表2),采回后除去瘪粒和虫害种子,置于通风干燥处保存备用。
1.2 方 法
试验于2018年12月在贵州大学林学院植物生理实验室进行,观测时间为3个月。因该种子属于大粒种子,因此以25粒为1次重复,设置3个重复。试验采用洁净无毒的纱布作为发芽床,发芽容器为带盖并具有孔隔板的透明发芽盒,使用前均用福尔马林溶液消毒处理。参照国际种子检验章程,以胚长出种皮的长度超过种子的直径为萌发标志[6]。种子萌发期间,统计种子发芽天数和发芽数,了解种子的发芽动态,一直持续到种子萌发结束为止。3次重复求平均值计算其发芽率:
发芽率(%)=(发芽种子数/供试种子总数)×100%;
发芽势(%)=(达到高峰期时发芽种子数/供试种子总数)×100%[7]。
1.2.1温度处理
将种子用1%高锰酸钾溶液浸泡20 min后用清水冲洗数次,种子平铺在发芽盒中,25粒为1次重复,并设置3个重复。分别设置15,20,25,30,35 ℃ 5个温度梯度进行发芽试验,每天保持10 h光照,种子发芽后开始记录发芽情况。
1.2.2光照处理
种子经1%高锰酸钾溶液消毒20 min并清洗后,在25 ℃的培养箱中分别设置0 h、10 h、24 h 3个光照时间,种子发芽后开始记录发芽情况。
1.2.3外源物质处理
配置不同浓度的赤霉素溶液、高锰酸钾溶液、聚乙二醇6000溶液处理种子(表3),将各组种子置于温度25 ℃,每天10 h光照下培育,调查并统计种子发芽情况,适时加水。

表3 红花瘤果茶种子的不同外源物质不同浓度处理情况
1.2.4生理指标测定
每间隔10 d,在15 ℃、25 ℃、35 ℃ 3个温度梯度,光照0 h、10 h、24 h处理下取种子或幼苗,检测其可溶性糖、可溶性蛋白及丙二醛的含量。分析温度和光照对红花瘤果茶种子萌发过程中内含物含量的影响。蛋白质含量采用考马斯亮蓝G-250染色法,可溶性糖含量采用蒽酮比色法,丙二醛含量采用硫代巴比妥酸法[7-8]。
实验数据采用SPSS 21.0软件分析,图标采用Excel软件处理。
2 结果与分析
2.1 不同温度处理对红花瘤果茶种子萌发的影响
对红花瘤果茶种子设置了5个温度梯度进行发芽试验,结果(表4)表明,红花瘤果茶种子在温度15~35 ℃均能萌发,5个温度梯度的发芽率均呈现显著差异,种子发芽率依次为20 ℃>25 ℃>15 ℃>30 ℃>35 ℃,种子在20 ℃发芽率最高,在35 ℃发芽率最低。种子发芽势依次为20 ℃>25 ℃>30 ℃>15 ℃>35 ℃,种子在15 ℃、25 ℃、30 ℃的发芽势没有显著差异,在20 ℃发芽势最高,在35 ℃发芽势最低,表明种子最适萌发温度为20 ℃。种子在30 ℃萌发最早,35 ℃萌发最晚。
2.2 不同光照处理对红花瘤果茶种子萌发的影响
对红花瘤果茶设置了3个光照梯度,分别为0 h、10 h、24 h光照,萌发实验结果,结果(表5)表明,种子在3个光照梯度中的发芽率和发芽势差异不显著,发芽率和发芽势为正相关关系,种子在0 h光照下发芽最早,发芽率和发芽势最高,在全光照下种子发芽率和发芽势最低,发芽时间最晚。

表4 不同温度梯度对种子萌发的影响
注:表中同列不同小写字母表示差异显著(p<0.05)。下同。

表5 不同光照时间对种子萌发的影响
2.3 不同外源物质对红花瘤果茶种子萌发的影响
如表6所示,不同赤霉素浓度处理后的种子发芽率依次为200 mg·L-1>400 mg·L-1>500 mg·L-1>100 mg·L-1>300 mg·L-1,浓度200 mg·L-1和浓度400 mg·L-1、500 mg·L-1的赤霉素溶液能显著增强红花瘤果茶种子的发芽率和发芽势,其中以200 mg·L-1的处理最好,能促进红花瘤果茶种子的提前萌发,赤霉素处理对红花瘤果茶种子的萌发具有促进作用。

表6 不同赤霉素浓度处理对红花瘤果茶种子萌发的影响
由表7可知,采用不同浓度的高锰酸钾溶液处理红花瘤果茶种子,并不能提高其发芽率,甚至在某种程度上抑制了红花瘤果茶的萌发。不同浓度处理红花瘤果茶种子的发芽率依次为,ck≥1 g·L-1>2 g·L-1>3 g·L-1>4 g·L-1>5 g·L-1,结果表明,随着高锰酸钾溶液浓度的增加,红花瘤果茶种子的发芽率和发芽势依次降低,其中用5 g·L-1浓度处理后的种子基本丧失发芽能力,发芽率趋于0。对照组和处理浓度为1 g·L-1和2 g·L-1的种子发芽率、发芽势无显著差异,与3 g·L-1、4 g·L-1、5 g·L-1处理存在显著差异。

注:不同字母表示在相应萌发时间内不同发芽环境间可溶性蛋白质含量的差异。图1 温度和光照对红花瘤果茶种子萌发过程中可溶性蛋白质含量的影响
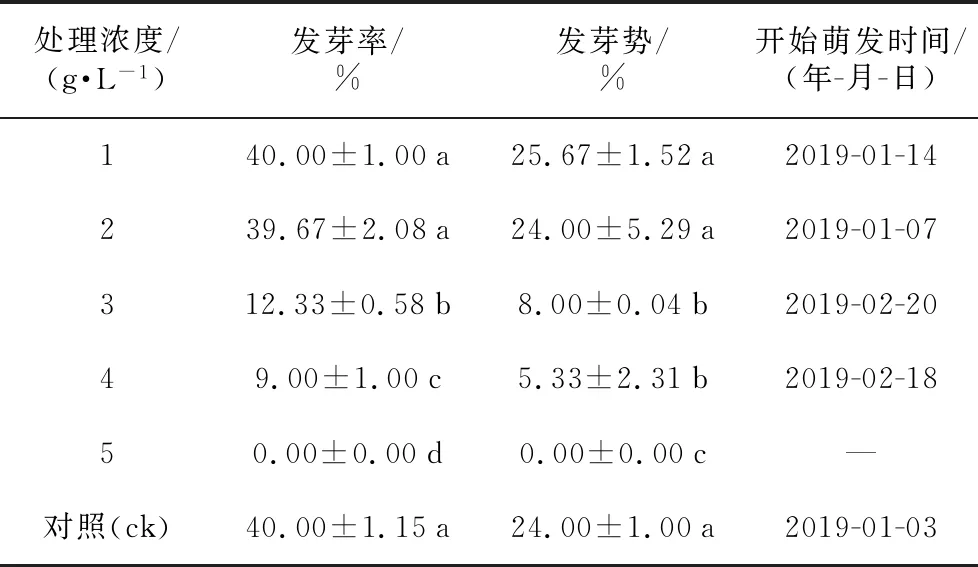
表7 不同高锰酸钾浓度处理对红花瘤果茶种子萌发的影响

表8 不同聚乙二醇浓度处理对红花瘤果茶种子萌发的影响
由表8可知,不同浓度的聚乙二醇并不能提高红花瘤果茶种子的发芽率和发芽势,300 mg·L-1浓度处理后的种子基本丧失发芽能力,200 mg·L-1、350 g·L-1、400 mg·L-1浓度处理均在不同程度上降低了种子的发芽率和发芽势。
2.4 温度和光照对种子萌发过程中可溶性蛋白质含量的影响
在不同温度和光照条件下,测定红花瘤果茶种子萌发过程中可溶性蛋白质含量的变化,结果如图1所示,在不同的温度和光照下,种子内可溶性蛋白质含量在种子萌发初期(0~10 d)均呈现为上升趋势,在随后的萌发过程中又呈现下降趋势,不同温度处理对红花瘤果茶种子萌发过程中可溶性蛋白质含量影响显著。
种子萌发10 d时,可溶性蛋白质含量达到最高,表明在萌发前期种子需要积累大量的可溶性蛋白质,为种子的萌发做准备。可溶性蛋白质多为游离态的酶[9],温度为15 ℃、35 ℃时,种子的可溶性蛋白质在萌发10~20 d急剧下降,种子在这个时候受低温或高温外界环境影响,可溶性蛋白参与代谢速度快,迅速开始分解为种子的萌发做准备。温度为25 ℃时,种子可溶性蛋白质含量在0~10 d内上升慢,随后开始缓慢下降,在萌发20~50 d时,蛋白质含量才开始急剧下降,这个阶段为25 ℃下种子萌发的高峰期,种子要消耗大量的可溶性蛋白质为胚根的生长发育提供能量。种子萌发20~50 d内,15 ℃、35 ℃时种子中的可溶性蛋白质含量下降速率低于25 ℃,说明在15 ℃、35 ℃时,种子内部生理代谢速率低,参与种子萌发的酶活性不如25 ℃,过高或过低的温度都会影响蛋白质的分解速率。

注:不同字母表示在相应萌发时间内不同发芽环境间可溶性糖含量的差异。图2 温度和光照对红花瘤果茶种子萌发过程中可溶性糖含量的影响
在不同光照时间下,光照0 h、10 h、24 h可溶性蛋白质含量在种子萌发0~10 d略有升高,随后在发芽10~50 d含量又急剧下降,下降趋势基本一致。尽管在萌发10~30 d内,0 h光照下可溶性蛋白质含量与10 h、24 h存在一定差异,但10 h光照与24 h光照处理可溶性蛋白质含量没有差异性。因此,在温度一致的情况下,不同的光照时间对种子萌发过程中可溶性蛋白质含量变化不明显。
2.5 温度和光照对种子萌发过程中可溶性糖含量的影响
在不同温度和光照条件下,测定红花瘤果茶种子萌发过程中可溶性糖含量的变化,结果如图2所示,在15 ℃、25 ℃、35 ℃种子萌发过程中可溶性糖的含量均呈先下降后升高的趋势,在萌发过程中,不同温度处理下的红花瘤果茶可溶性糖含量差异显著。
可溶性糖含量在种子发芽0~30 d时含量逐渐下降,其中15 ℃在发芽0~30 d可溶性糖含量下降速率最快,这个时期主要为种子吸胀萌动并开始萌发的阶段,种子消耗大量的可溶性糖为种子的萌发提供能量。种子萌发30 d后,可溶性糖含量又逐渐升高,主要是因为在这个时期,种子内储存的淀粉或脂肪开始分解转化成糖类并参与种子的萌发,产生可溶性糖的积累,从而导致了可溶性糖上升[10]。25 ℃和35 ℃温度下的红花瘤果茶种子可溶性糖含量的下降和上升速率差异不显著,下降速率和上升速率均低于15 ℃,说明温度能显著影响红花瘤果茶种子萌发过程中的可溶性糖含量。
光照时间为0 h、10 h、24 h时,红花瘤果茶种子萌发过程中可溶性糖含量均呈现先下降后升高的趋势,在发芽10 d、40 d、50 d不同光照处理下种子内可溶性糖含量具有差异性,但整体来说,不同的光照时间并没有改变可溶性糖含量变化趋势。说明不同的光照时间对红花瘤果茶种子萌发过程中可溶性糖含量的变化存在一定影响,但其影响程度远不如温度对其可溶性糖含量的影响。

注:不同字母表示在相应萌发时间内不同发芽环境间丙二醛(MDA)含量的差异。图3 温度和光照对红花瘤果茶种子萌发过程中丙二醛含量的影响
2.6 温度和光照对种子萌发过程中丙二醛含量的影响
丙二醛是植物细胞脂质过氧化的产物,种子内丙二醛含量越高,说明过氧化作用越强,对种子造成的伤害越高[8]。丙二醛含量的高低在一定程度上指示种子脂质化程度的高低[11]。在不同温度和光照条件下测定了红花瘤果茶种子萌发过程中的丙二醛含量的变化,结果如图3所示,在不同温度和光照条件下,随着红花瘤果茶种子萌发时间的增加,种子内丙二醛含量逐渐上升,不同温度处理下,种子在不同发育阶段的丙二醛含量差异显著,表明温度能影响红花瘤果茶种子萌发过程中的丙二醛含量。
15 ℃、25 ℃、35 ℃温度条件下,种子在0~10 d萌发初期丙二醛含量略有上升,上升速率均较小。种子在25 ℃萌发时丙二醛含量变化不大,对种子的毒害作用不明显,种子能保证正常的萌发。35 ℃条件下,种子萌发处于高温状态,超出了种子内部生理活动的最佳温度,丙二醛含量急剧上升,在一定程度上损伤了细胞的生物膜,导致种子难以萌发,因此在35 ℃条件下,种子萌发率最低。种子在15 ℃萌发的30~50 d后,其含量的上升幅度加大,但远低于同时期的35 ℃萌发的种子。
不同时间光照使得红花瘤果茶种子在萌发过程中的丙二醛含量有轻微的上升,但光照0 h、10 h、24 h对丙二醛含量的影响无显著差异。因此,在温度一致的情况下,光照时间的长短并不影响红花瘤果茶种子萌发过程中的丙二醛含量。
3 结论与讨论
3.1种子的萌发是一个复杂的生理过程,其萌发特性不仅受到种子内在生理特性的调控,还受到外界环境因素的影响。温度和光照均是影响种子萌发的关键因子,温度主要是通过调控种子内参与种子萌发所需要的酶活性来影响种子萌发过程,适宜的温度能提高种子的萌发能力,温度过低或过高都会降低种子的酶活性,从而影响种子的萌发生长[11-12]。种子的发芽率和发芽势能反映出种子的发芽整齐度和发芽速度[13],是考量种子发芽质量的关键指标。红花瘤果茶种子在15~35 ℃均能萌发,在20 ℃时的发芽率和发芽势最高,分别达到72.00%和40.33%,在35 ℃的发芽率和发芽势最低,仅有12.92%和6.83%。在30 ℃的种子能最早萌发,但其发芽势与15 ℃、25 ℃无显著差异,说明温度能显著影响红花瘤果茶种子的发芽率和发芽势。整体来说,随着温度的升高,种子的发芽率和发芽势均呈现先升高后降低的趋势。红花瘤果茶种子在0 h、10 h、24 h 3个光照梯度中的发芽率差异不显著,表明光照时间的长短并不影响红花瘤果茶种子的萌发。
3.2就同种植物种子而言,不同浓度的赤霉素、高锰酸钾、聚乙二醇溶液对种子发芽的促进作用不同,低于或高于适宜浓度的处理,都会导致植物种子萌发受到限制[14-17]。采用了5种不同浓度的赤霉素溶液、高锰酸钾溶液及聚乙二醇溶液处理红花瘤果茶种子,结果表明,浓度为200 mg·L-1的赤霉素溶液不仅能促进红花瘤果茶种子的提前萌发,还能显著提高红花瘤果茶种子的发芽率和发芽势。但是,采用不同浓度的高锰酸钾溶液和聚乙二醇溶液处理后,并不能提高红花瘤果茶种子的发芽率,甚至在某种程度上抑制了红花瘤果茶的萌发。因此,要提高红花瘤果茶种子的发芽率,浓度为200 mg·L-1的赤霉素溶液处理效果最好。
3.3种子在萌发过程中,营养物质主要来源于其储藏物质的转化与利用,主要包括可溶性蛋白质、可溶性糖、淀粉及脂肪[17-19]。在不同温度条件下,1)红花瘤果茶种子可溶性蛋白质在种子萌发初期呈上升趋势,随后逐渐下降,种子萌发前期需要进行可溶性蛋白质的积累,为后续种子胚芽和胚根的生长提供能量,在25 ℃时,红花瘤果茶种子可溶性蛋白质下降速率最快,种子内部生理代谢快,种子发芽率和发芽率较15 ℃和35 ℃高;2)红花瘤果茶种子可溶性糖含量呈先下降后升高的趋势,发芽初期主要由可溶性糖为种子的萌动提供能量,发芽后期种子内部的淀粉和脂肪开始分解利用,产生了可溶性糖的积累[9],种子内可溶性糖含量上升。其中15 ℃下,红花瘤果茶种子内可溶性糖含量的消耗速度和积累速度均高于25 ℃和35 ℃,表明在低温条件下,红花瘤果茶种子可溶性糖在种子萌发的初期比后期消耗快;3)红花瘤果茶种子丙二醛含量均呈现不同程度的上升,其中35 ℃下,丙二醛含量上升最多最快,其次是15 ℃和25 ℃条件下,种子丙二醛含量上升最少,上升速率较慢,丙二醛对种子的毒害作用最小,因此发芽率也最高。但是,在温度一定时,不同的光照时间对红花瘤果茶种子内可溶性蛋白、可溶性糖及丙二醛含量无显著影响,在种子萌发过程中相应的变化趋势与25 ℃条件下基本一致,实验表明光照对红花瘤果茶种子的萌发过程无显著影响,因此红花瘤果茶种子可归属于光中性种子[20]。

