水稻花色苷含量及合成结构基因的差异表达研究
袁昭弟1,焦后意1,刘 凯1,周丽洁,余显权
(1.贵州大学农学院,贵阳 550025;2.贵州大学水稻研究所,贵阳 550025)
水稻在我国粮食生产中占有重要的地位[1]。有色稻不仅含有丰富的营养元素,还含有丰富的生物活性物质[2-4]。因此,有色稻常被用来改善体质和预防各种疾病。
花色苷是一种分布范围广、安全、无毒、无副作用的天然色素。在自然界中通过糖苷键与一个或多个葡萄糖、鼠李糖、半乳糖等合成花色苷。该色素的糖苷基与羟基还可以经过酯键和一个或少许分子的对位香豆酸、阿魏酸、咖啡酸等合成牢固的花色苷[5-6]。
OsPAL是参与该色素生化反应的第一个酶,能在水稻的所有部位表达,其中根和茎中的表达比其他部位高[7-8]。OsCHS在水稻的所有部位均有表达,其中茎和种子中的表达量比较高,且开花后13 d的种子表达量显著高于开花后2、7 d的表达量[9]。OsF3H它的表达量在开花后13 d的黑米种子中最高[7-8]。Kim等克隆了水稻的3个OsF3H序列,F3H-2在所有组织中的表达量最高但在种子中不表达[10]。Ryu等[11]分析了10个色稻品种,认为色稻籽粒中相对于OsF3′5′H来说,OsF3′H的表达占优势,使得下游途径由二氢槲皮素(dihydroquercetin,DHQ)经过OsDFR、OsANS以及OsUFGT基因的催化而合成花色苷。Phoka等[11]对水稻花色苷含量运用RT-PCR方法,得出OsDFR表达量的多少受温度变化的影响,高温使它的表达量降低,并且该基因表达量高低直接影响花色苷积累量。OsANS在黑米花13 d后的表达量最高,在白米中也有少量表达[7-8]。
因此,研究水稻花色苷的合成可以通过分子辅助育种的手段,培育出富含花色苷的稻米。本文研究了结构基因(OsPAL、OsCHS、OsCHI、OsF3′H、OsF3′H、OsDFR、OsANS、OsF3′5′H、OsUFGT)在白米和红米水稻的茎、叶以及开花后不同时期种子中的差异表达,为进一步了解花色苷在水稻中的积累情况提供依据。
1 材料与方法
1.1 材 料
本研究选用红米品种贵红1号×白米恢复系蜀恢498 F5群体中表现优良、籽粒具有优质性状的1份白米株系、1份红米株系及白米恢复系蜀恢498(父本)、营养价值高、口感好的红米品种贵红1号(母本)。
1.2 方 法
1.2.1试验设计
本试验在贵州大学水稻试验场进行(盆栽),2018年4月18日播种,2018年5月28日移栽,每个材料移栽15株,管理方法和壤与大田一样。待生长适宜后,取各个材料的茎和叶,各材料开花后,使用不同颜色的记号笔标记当天开花的穗子,每隔7 d取穗子(取样时间见表1),保存于-80 ℃冰箱中用于花色苷含量测定和提取RNA。

表1 不同材料种子的取样时间 (单位:月-日)

表2 荧光定量PCR所用引物及各引物的退火温度
1.2.2测定项目与方法
1)花色苷含量测定方法参照黄莹莹[13]的方法,利用分光光度计法进行测定。
2)样品总RNA提取与cDNA合成参照EASYspin Plus多糖多酚复杂植物RNA快速提取试剂盒(艾德莱生物),提取总RNA,cDNA合成参照EasyScript®One-Step gDNA Removal and cDNA Synthesis SuperMix(雷欣公司)试剂盒的说明书进行。
3)Real-time PCR所用的内参基因Actin引物参考赵海军等[14]的方法;OsPAL、OsCHS、OsCHI参考劭雅芳等[15]的方法;OsF3′H、OsDFR、OsANS参考Sun-Hyung Lim等[16]的方法;OsF3′H参考Tian Shao等[17]的方法;根据GenBank (http://www.ncbi.nlm.nih.gov/genbank/)中注释的栽培稻花色苷合成途径关键酶的基因OsF3′5′H(AP 004704.3)下同、OsUFGT(GQ 280269.1)的mRNA作为参考序列,用Primer Premier 6软件设计。荧光定量PCR所用引物、片段大小及退火温度见表2,实时定量PCR操作根据TransStart®Tip Green qPCR SuperMix(雷欣公司)试剂盒使用说明书进行,反应体系20μL,其中2×TransStart®Tip Green qPCR SuperMix 10μL,上下游引物0.4μL,Nuclease-free Water 8.7μL,cDNA 0.5μL。重复3次,反应程序为:94 ℃预变性30 s,94 ℃变性5 s,60 ℃(58.3 ℃、50.7 ℃)退火15 s,72 ℃延伸10 s,40个循环。根据Actin基因的表达量,以2-ΔΔCt法计算各基因相对表达量。
4)本研究采用比较阈值法(2-ΔΔCt)对不同材料的结构基因的Real-time PCR测定结果进行相对定量分析,采用SPSS 20.0软件、Excel 2010软件和DPS 7.05统计软件对花色苷含量显著性分析、不同时期花色苷含量变化、花色苷结构基因在种子发育不同时间的动态变化和基因表达量之间与花色苷含量的相关分析。
2 结 果
2.1 参试材料花色苷含量差异分析
由参试材料的花色苷含量测定结果(表3)看出,红米材料和白米材料从开花后,随着取样期的推迟,红米材料花色苷含量逐渐增加,而白米材料反之。白米材料从开花后7 d花色苷含量较高,差异不明显,但极显著高于红米材料,其余取样时间红米材料花色苷含量较高,差异较明显,并极显著高于白米材料。开花后7~14 d,2个亲本花色苷的含量显著高于2个株系,而开花后14~21 d反之,但其他2个时期亲本和株系花色苷含量差异不明显,说明花色苷是形成色稻的主要色素之一。

表3 2个亲本和2个株系籽粒花色苷含量
注:表中分别对亲本、白米株系和红米株系进行差异分析,小写和大写字母不同分别表示在5%和1%水平差异显著性。
2.2 参试材料花色苷含量的动态变化
由参试材料不同天数的花色苷含量测定结果(图1)看出,红米品种贵红1号和红米株系的花色苷含量随着种子的发育而不断增加,而白米恢复系蜀恢498和白米株系反之。开花后7~14 d,白米恢复系蜀恢498的花色苷含量明显高于白米株系,而14~21 d反之;开花后7 d,白米材料的花色苷含量明显高于红米材料的花色苷含量,其他时间反之。开花后7~14 d和21~28 d红米品种贵红1号的花色苷含量比红米株系较高,其他时间反之。说明色稻材料花色苷的含量明显高于白米材料,而亲本和株系的花色苷含量有差异。
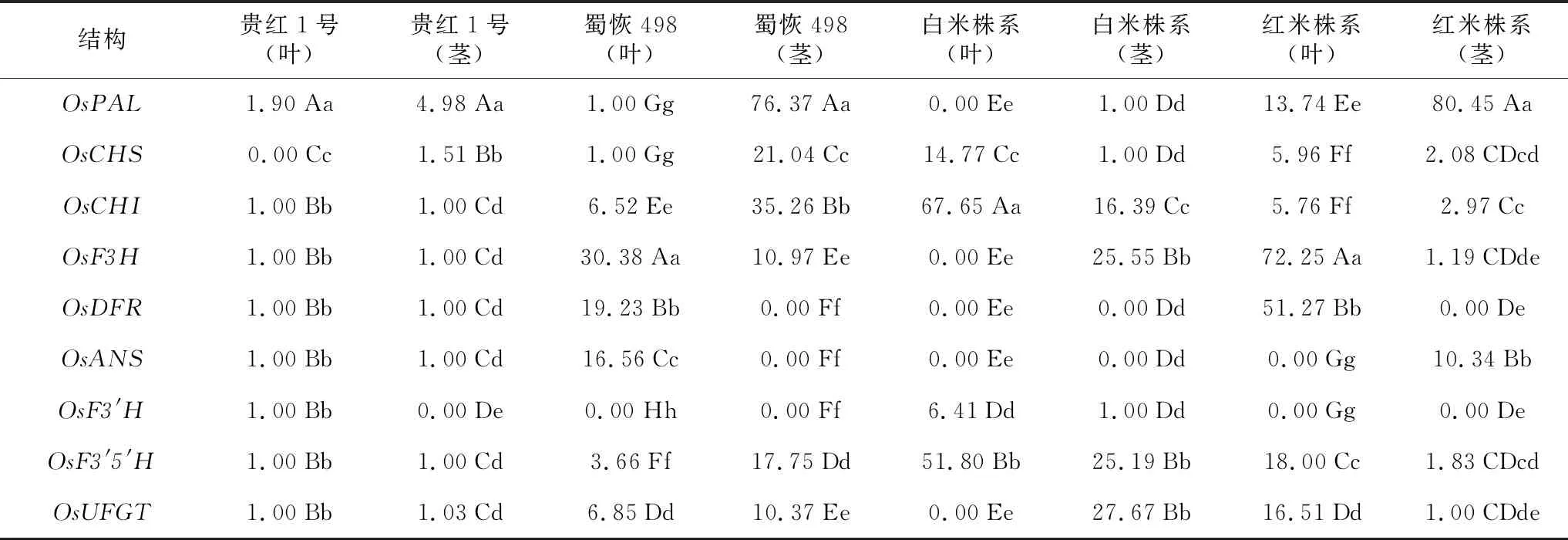
表4 2个亲本和2个株系花色苷合成结构基因在茎、叶的相对表达量贵红1号是红米品种贵红1号,蜀恢498是白米恢复系蜀恢498。
注:表中对合成花色苷结构基因在亲本和株系中相对表达量差异分析,小写和大写字母不同分别表示在5%和1%水平差异显著性;

表5 花色苷含量与色苷合成结构基因表达的相关分析
注:“*”和“**”分别表示在5%和1%水平上显著相关。

图1 不同材料花色苷含量的动态变化
2.3 花色苷合成结构基因的表达特性
2.3.1花色苷合成结构基因在不同组织的表达特性
由花色苷合成结构基因相对表达量测定结果(表4)看出,在红米品种贵红1号中,OsPAL、OsCHS在叶和茎相对表达量最高;在白米恢复系蜀恢498中,OsCHI、OsF3H、OsDFR、OsANS、OsUFGT等5个基因在叶中相对表达量最高,OsPAL、OsCHS、OsCHI、OsF3′5′H、OsUFGT等5个基因在茎中相对表达量最高;在白米株系中,OsCHS、OsCHI、OsF3′H、OsF3′5′H等4个基因在叶中的相对表达量最高,OsCHI、OsF3H、OsF3′5′H、OsUFGT等4个基因在茎中相对表达量最高;在红米株系中,OsPAL、OsCHS、OsCHI、OsF3H、OsDFR、OsF3′5′H、OsUFGT等7个基因在叶中相对表达量最高,OsPAL、OsCHS、OsCHI、OsF3H、OsANS、OsF3′5′H等6个基因在茎中相对表达量最高。与其它材料的不同组织花色苷合成结构基因相对表达量达极显著水平,说明花色苷合成结构基因相对表达量具有组织特异性。
2.3.2花色苷合成结构基因在籽粒发育过程中的相对表达量动态变化
由花色苷合成结构基因相对表达量测定结果(表5)看出,在红米品种贵红1号中,OsPAL、OsDFR2个基因开始相对表达量较高,之后逐渐降低,在花后28 d的表达量最高;OsCHI、OsANS、OsF3′H等3个基因从开花后7~14 d的相对表达量较低,在21 d出现表达高峰,之后急剧下降;OsF3H从开花后14 d和28 d出现2个表达高峰;OsF3′5′H、OsUFGT等2个基因从开花后7~21 d的相对表达量较高,之后出现大幅度降低的水平;OsCHS从开花后7~28 d的相对表达量逐渐增加。在白米恢复系蜀恢498中,OsPAL、OsCHS、OsF3H、OsDFR、OsANS、OsF3′H、OsF3′5′H等7个基因开始的相对表达量较高,从开花后21 d的相对表达量最高,之后出现大幅度降低;OsCHI、OsUFGT2个基因从开花后7~14 d出现表达高峰,之后逐渐降低。在白米株系中,OsPAL开始的相对表达量较低,之后逐渐升高,从开花后21 d出现表达高峰,之后逐渐下降;OsCHI、OsF3H、OsANS、OsF3′5′H、OsUFGT等5个基因从开花后7~14 d出现表达高峰,之后出现较大幅度的降低;其它3个基因的相对表达量接近0。在红米株系中,OsPAL、OsCHS、OsCHI、OsF3′5′H、OsUFGT等5个基因从开花后7~28 d的相对表达量逐渐升高;OsF3H、OsDFR、OsANS等3个基因从开花后7 d的相对表达量最高,之后出现较大幅度的下降,在28 d出现表达高峰;OsF3′H开始的相对表达量较低,在21 d出现表达高峰,之后急剧降低。

注:1~9从左到右是合成花色苷结构基因在水稻开花后不同取样时间的相对表达量。图2 花色苷合成结构基因在不同材料籽粒发育过程的相对表达量动态变化
结果表明,参与花色苷合成的结构基因在4个参试材料中具有不同的表达模式。红米品种贵红1号中的花色苷合成结构基因在中后期的相对表达量明显高于白米恢复系蜀恢498,而前中期的相对表达量反之;白米株系中OsPAL、OsCHI、OsF3H、OsANS、OsF3′5′H、OsUFGT等5个基因在前中期的相对表达量明显高于红米株系,而中后期花色苷合成结构基因在红米株系的相对表达量较高。不同的基因表达模式可能是4个参试材料颜色差异的原因。
2.3.3花色苷含量与花色苷合成结构基因表达的相关性
对4个水稻材料籽粒发育期内花色苷含量与花色苷合成结构基因的相对表达量进行了相关性分析,OsCHS相对表达量与花色苷含量相关系数分别为0.880、0.929,呈显著正相关;在白米株系籽粒发育过程中,OsF3H表达量与花色苷含量相关系数为0.919,呈显著正相关;在红米株系籽粒发育过程中,OsPAL表达量与花色苷含量相对系数为0.907,呈显著正相关,OsCHI、OsF3′5′H和OsUFGT表达量与花色苷含量相对系数分别为0.979、0.969、0.975,呈极显著正相关。说明OsPAL、OsCHS与红米品种贵红1号籽粒花色苷的合成密切相关,OsF3H与白米株系籽粒花色苷合成密切相关,OsPAL、OsCHI、OsF3′5′H、OsUFGT与红米株系籽粒花色苷的合成密切相关。
3 讨论与结论
花色苷是红米颖果形成红色的主要色素之一,花色苷含量差异是红米材料与白米材料籽粒色泽形成差异的物质,合成花色苷结构基因差异表达与花色苷的积累有一定关系。在红米品种贵红1号中,OsPAL和OsCHS在根、茎和种子均有表达,而表达量与Kim等[18]的研究结构相反,是花类黄酮途径的组成型基因;而OsPAL、OsCHS、OsCHI、OsF3H、OsANS、OsF3′5′H、OsUFGT、OsDFR、OsF3′H从开花后7~28 d都出现早期和晚期2个表达高峰。研究表明,这些花色苷结构基因的表达模式与总花色苷含量的积累的动态变化不一样。水稻果皮和种皮中含有大量的酚类物质、花色苷、黄酮类、花青素、原花色素等由类黄酮途径合成,有一些酶在催化过程中起共同的作用。可能在水稻果皮和种皮发育的早期,这些基因出现表达高峰且表达量很高,可能主要参与催化合成黄酮类、酚类物质、花青素和原花色素等物质,而后期的转录表达高峰则主要是进行花色苷的大量合成。
在白米恢复系蜀恢498中,OsCHI、OsUFGT在茎、叶和种子均有表达,而其它基因在不同组织器官的表达量不同,说明基因的表达具有组织特异性;合成花色苷结构基因在开花后7~28 d的前中期的表达量较低,后期急剧下降,可能这种表达模式与果皮和种皮总花色苷含量的变化模式有一定的相似性,这些基因可能参与白米恢复系蜀恢498的果皮和种皮中花色苷和其它色素的合成。
在白米株系中,OsCHI、OsF3′5′H在茎、叶和种子中均有表达而表达量较高,其它的基因在茎、叶和开花后7~28 d种子中不表达或表达量不同,说明这些基因的表达具有组织特异性;而OsPAL、OsCHI、OsF3H、OsANS、OsF3′5′H、OsUFGT在前中期的相对表达量较低,后期急剧降低,可能这些基因表达模式与果皮和种皮总花色苷含量的变化模式有一定的相似性,这些基因可能参与白米株系的果皮和种皮中花色苷和其它色素的合成。
在红米株系中,OsPAL、OsCHS、OsCHI、OsF3H、OsF3′5′H在茎、叶和种子中均有表达,而其它基因在不同组织的表达量不同,说明基因的表达具有组织特异性;合成花色苷的结构基因从开花后7~28 d种子中均有表达,而OsPAL、OsCHI、OsF3H、OsANS、OsF3′5′H、OsUFGT在中后期的表达量较高,其它基因在前中期表达量较高,可能这些基因的表达模式与果皮和种皮总花色苷含量的变化模式有一定的相似性,这些基因可能参与红米株系的果皮和种皮中花色苷的大量积累。
通过比较分析发现,OsPAL、OsCHS在红米品种贵红1号和红米株系的茎、叶和种子均有表达,OsCHI在白米恢复系蜀恢498和白米株系的组织中均有表达,说明这些基因是水稻类黄酮合成途径的组成型基因;合成花色苷的结构基因在红米品种贵红1号和红米株系开花后7~28 d的前中后期均有表达,说明这些基因的参与可能与合成大量的花色苷有关;这些基因在白米恢复系蜀恢498和白米株系开花后7~28 d的前中期表达量较低,后期急剧降低,说明这些基因可能参与少量花色苷的合成。
总之,这些基因在红米材料红米品种贵红1号、红米株系和白米材料白米恢复系蜀恢498、白米株系的茎、叶和种子开花后7~28 d的前中后期的表达量具有显著差异,可能是造成4个参试材料着色差异的主要原因。OsPAL、OsCHS是红米品种贵红1号籽粒花色苷合成的关键基因,OsF3H在白米株系籽粒发育过程中扮演重要的角色,OsPAL、OsCHI、OsF3′5′H、OsUFGT是红米株系籽粒花色苷的关键基因。
选育优质花色苷含量高的水稻品种是重要的育种目标,本研究以颜色差异较大的亲本和它的株系为研究材料,探讨了花色苷结构基因在4个材料的差异表达。由于亲本和株系间的遗传背景有差异,而OsPAL、OsCHS、OsF3H、OsCHI、OsF3′5′H、OsUFGT是否是4个水稻材料花色苷合成的关键基因,以及与花色苷合成调节转录因子的互作关系,还需要进一步的研究。

