老年肌肉减少症防治中的营养干预
杨则宜焦 颖魏 冰乔 莉王 橹
(1国家体育总局反兴奋剂中心 北京 100029
2北京康比特运动健康营养研究院 北京 102200
3北京康比特运动营养研究所 北京 100029
4首都职工体质促进中心 北京 100020)
自2009年国际肌肉减少症工作组(IWGS)将肌肉减少症(简称“肌少症”)定义为“年龄相关的骨骼肌质量和功能丧失”以来,肌少症得到国际医学界的高度重视[1]。据现有的研究初略推断,欧洲肌少症患病率为1%~29%[1];亚洲老年人肌少症的患病率男性为6.7%~56.7%,女性为0.1%~33.6%[2];我国的总体患病率为9.8%(男、女分别为12.0%和6.7%[3])和10.6%[4]。为此,2013年,老年肌少症欧洲工作组(EWGSOP)、国际肌少症工作组(IWGS)的代表同来自亚洲和美国的国际专家一起形成了“国际肌肉减少症倡议(ISI)”,其目的在于形成肌少症某些方面的系统观点,包括EWGSOP和IWGS主张的肌肉保持,同时又关注用以提高肌肉质量和肌肉功能的营养和运动干预[1,5]。
肌少症的预防和治疗主要是针对其形成的原因。与肌少症有关的可能病因十分复杂,如老年人久坐不动的生活方式以及长时间卧床不起,是导致骨骼肌质量的丧失和萎缩的主要原因,而食物摄入不足和营养不良则导致骨骼肌维持受损。此外,线粒体功能障碍、胰岛素抵抗、过氧化和炎症被认为是与动脉粥样硬化相关的常见关联因素。合成代谢激素[包括睾酮、脱氢表雄酮(DHEA)、胰岛素样生长因子(1IGF-1)等]水平降低,合成代谢刺激受阻,肌肉蛋白质合成减少和肌肉蛋白质降解增加,是导致老年人肌少症形成的最重要的病因之一[6]。
随着年龄的增长和能量需求的减少,从40岁到70岁,食物和能量摄入量平均下降25%。低的食物摄入量和单调的饮食使老年人面临危险,因为随着食物总摄入量的下降,大多数营养素的摄入量也相应下降。在对来自12个国家的数据的汇总分析中,大约三分之二的参与研究的老年人被确定存在营养问题或营养不良[7]。与肌少症和脆弱有关的营养物质包括蛋白质、维生素D、抗氧化营养素(包括类胡萝卜素、硒和维生素E和维生素C)和长链多不饱和脂肪酸等[7]。
2018年,欧洲骨质疏松症、骨关节炎和肌肉骨骼疾病临床和经济问题协会(ESCEO)工作组多位专家在临床营养学杂志上发表了一篇重要的题为“营养在肌少症的预防和治疗中发挥作用吗?”的综述文章。该文指出“更健康”的饮食模式的重要性,这种老年人饮食模式是需要摄入足够的蛋白质、维生素D、抗氧化营养素和长链多不饱和脂肪酸,已有大量证据支持膳食蛋白和体力活动作为肌肉蛋白质合成的关键合成刺激物[7]。
1 蛋白质营养与肌少症
1.1 老年人的蛋白质营养状况
与肌少症相关的营养不良,首先是蛋白质摄入的不足。在欧洲,多达10%居住在社区的老年人和35%接受机构护理的老年人蛋白质摄入达不到维持各年龄段成年人肌肉完整性的最低摄入量(0.7 g/kg 体重/d)[8]。美国的 1 项调查显示[9],在50岁及以上年龄组中,32%~41%的女性和22%~38%的男性摄入的蛋白质低于建议的0.8 g/kg体重/d的蛋白质摄入量。
总的来说,蛋白质补充有可能减缓肌肉萎缩,特别是习惯性低摄入量的老年人。为此,欧洲临床营养和代谢学会(ESPEN)于2013年举办了一次“老年人蛋白质需求”研讨会。会议提出最佳蛋白质摄入量和与年龄和身体条件相适应的运动建议(表1)[7]。

表1 65岁以上老年人最佳膳食蛋白质摄入量和运动实用指南(ESPEN推荐)[7]Table 1 Practical guidance for optimal dietary protein intake and exercise for older adults above 65 years[7]
美国、英国和澳大利亚的老年人的蛋白质摄入推荐量为:65岁以上,1.1~1.2 g/kg/d(每餐 25~30 g);65岁以上并参加耐力和阻力运动,1.2 g/kg/d;65岁以上并患有急性或慢性疾病,1.2~1.5 g/kg/d[9]。
Paddon-Jones等[10]认为,为了最大限度地增加肌肉蛋白质的合成,同时考虑总能量的摄入,每餐应该保证25~30 g高质量蛋白质的摄入。
1.2 肌少症的蛋白质和氨基酸补充
为了解决老年人膳食蛋白质供给的不足,蛋白质、氨基酸及蛋白合成促进剂的补充是克服老年人摄食减少和消化吸收能力下降,防治肌少症的更为有效的方法。它们包括乳清蛋白、支链氨基酸、谷胱甘肽、瓜氨酸、肌酸、L肉碱、HMB等的补充。
1.2.1 乳清蛋白 对于肌少症患者而言,乳清蛋白是最佳的蛋白源。乳清蛋白的作用特点是:1)快速消化,在循环中传递氨基酸,可用于蛋白质合成;2)高含量的亮氨酸;3)丰富的谷胱甘肽生成前体。这些在抗肌肉丢失上都有很好的作用。
1.2.1.1 乳清蛋白的增肌作用 30~40 g乳清蛋白具有明显的增肌作用。Pennings等[11]给33名健康的老年男性【(73±2)岁】随机分组摄入 10,20 g或35 g L-[1-13C]苯基丙氨酸标记乳清蛋白。结果显示:摄入35g后,L-[1-13C]苯基丙氨酸标记乳清蛋白在肌肉蛋白质中的摄取量高于10g(P<0.01)或20 g(P<0.05)者。健康的老年男性摄入10 g或20 g乳清蛋白,相比于摄入35 g乳清蛋白会导致更大的氨基酸吸收,进而刺激新肌肉蛋白的合成。
Macnaughton等[12]关于13C6-苯丙氨酸示踪剂的研究也表明,无论是低瘦体重还是高瘦体重的老年人,在全身阻力运动后补充40 g乳清蛋白与20g乳清蛋白比较,肌原纤维分数合成率在补充后不同时间都高于摄入20 g乳清蛋白的(表2)。前者可以得到更大程度的肌肉蛋白合成(MPS)刺激。

表2 补充不同量乳清蛋白后不同时间的肌原纤维分数合成率[12]Table 2 Myofibrillar fractional synthesis rate(FSR)for 20g and 40g trials at different time after protein ingestion[12]
Oikawa等[13]最新的研究提示,对于膳食摄入低下的老年人,蛋白质补充并不能保护腿部瘦肌肉,然而补充乳清蛋白可以增加腿部瘦肌肉和肌肉蛋白质合成,使其肌肉从无活动和低能量摄入状态恢复。
Farshidfar等[6]引用Similarly等对 13名健康的老年男性研究大豆和乳清蛋白的作用,以及研究阻力运动对p70S6K磷酸化水平的影响[p70S6激酶(P70S6K)是mTOR通路的主要下游成分,负责启动蛋白翻译,常被用作MPS的代用指标]。在运动后2 h,添加乳清和大豆组的磷酸化p70S6K水平均高于对照组(P<0.001),而p70S6K磷酸化水平仅在添加30g乳清蛋白组运动后4 h仍保持不变(P<0.001)。这些结果表明:乳清蛋白对骨骼肌蛋白质合成信号通路的影响明显长于大豆蛋白,这可能是由于乳清蛋白的BCAA含量较高。
1.2.1.2 亮氨酸的增肌作用 高含量的亮氨酸是刺激肌肉蛋白质合成的最有力的氨基酸,在增肌方面起关键作用。Verreijen等[14]在双盲随机对照试验中给年龄大于55岁的肥胖老人(BMI>30)进行13周控制饮食加运动减肥,每天早餐前和每周3次的阻力运动后各补充含乳清蛋白20g、亮氨酸2.8 g和维生素D320 μg补充剂1份,结果显示,与等热量的对照组相比,高乳清蛋白、亮氨酸和维生素D补充剂在低热量饮食和阻力运动时可保持肥胖老年人的四肢肌肉(包括骨骼肌质量指数SMI、肌肉力量和功能),因此可能降低患肌少症的风险(图1)。
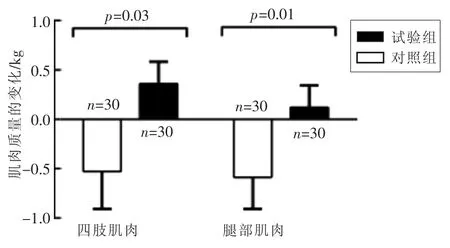
图1 肥胖老年人减肥期乳清蛋白、亮氨酸和维生素D补充对肌肉的作用[14]Fig.1 Effects of whey protein,Leucine and Vitamin D supplementation on muscle in obese elderly during weight loss[14]
1.2.1.3 谷胱甘肽的保护肌肉作用 谷胱甘肽(GSH)是一种内源性三肽抗氧剂。人体谷胱甘肽是前体半胱氨酸(Cys)、谷氨酸(Glu)和甘氨酸(Gly)通过两种酶催化合成。乳清蛋白富含这些谷胱甘肽的前体物质。
谷胱甘肽具有多种生理功能,包括保护细胞免受氧化应激,解毒,抗癌,蛋白功能的翻译后调控,维持免疫系统功能等。维持组织内谷胱甘肽水平对于保持健康,预防疾病和抗衰老至关重要。
老年人低蛋白饮食造成谷胱甘肽合成的下降,扩大氧化应激对许多与年龄相关的疾病的危害。乳清蛋白的补充将有助于组织谷胱甘肽恢复到更年轻水平,对血管健康、骨密度、肌肉力量、全身炎症、认知功能的保存和免疫能力产生有利影响[15]。
综上研究显示,对于肌少症患者来说,补充乳清蛋白是最好的选择。补充量为每天30 g,如果补充35 g,则会取得更好的效果。
1.2.2 支链氨基酸(BCCAs)支链氨基酸(BCAAs)、缬氨酸、亮氨酸和异亮氨酸是人体不能合成的9种必需氨基酸中的3种,必须从饮食中获得。哺乳动物肌肉蛋白质中大约35%是不可缺少的BCAAs,氨基酸总量中,BCAAs占40%[16]。对于老年人来说,BCAAs是非常重要的,因为肌肉萎缩是随着年龄的增长而发生的,而且在体内维持一个合成的、保持肌肉的环境变得越来越困难。BCAAs的不足与较低的活动水平和总体蛋白质摄入量减少的趋势相结合,可以造成肌肉质量总体急剧地减少。Ottestad等[17]对挪威417名(≥70岁)居家老年人的研究显示,有90名(22%)患有肌少症,女性(32%)多于男性(11%)。同时发现,肌少症与BCAAs、亮氨酸和异亮氨酸的非空腹血浆浓度降低以及蛋白质的绝对摄入量降低有关。
虽然大部分氨基酸在肝脏中被降解,但是BCAAs主要由肝外组织(肌肉、脂肪、肾脏和大脑)分解。这些氨基酸的分解代谢是由与α-酮戊二酸发生转氨反应形成谷氨酸和支链酮酸(BCkAs),然后,通过谷氨酰胺合成酶的作用将谷氨酸转化为谷氨酰胺。谷氨酰胺有多种功能,包括肌肉蛋白质合成,维持肾脏酸碱平衡,生成谷胱甘肽(GSH),热休克蛋白(HSPs)的表达,以及从组织中除去有毒的氨等[16]。
Lustgarten等[18]用质谱代谢组学分析方法研究了功能受限的老年人中维持肌肉和去脂体重相关的生物学机制。受试对象为73名功能受限的老年人(年龄 70~85 岁,SPPB≤10)。结果发现,血清代谢物与大腿肌肉横截面面积(CSA)和去脂体重(FFMI)之间存在显著关联。7种支链氨基酸及其相关代谢产物(亮氨酸、异亮氨酸、缬氨酸、3-羟基异丁酸酯、4-甲基-2-氧代戊酸酯、3-甲基-2-氧异丁酸酯和4-羟基异己酸酯)、1种色氨酸相关代谢物(吲哚丙酸)和1种肉碱(异戊酰肉碱)分别被鉴定为与肌肉CSA和FFMI均有相关性。多变量分析结果表明,主要与胰岛素抵抗(胰岛素抵抗的稳态模型评估)或炎症(肿瘤坏死因子-α和白细胞介素-6)有关。具体表现为,BCAA代谢产物,2-羟基-3-甲基戊酸和丙酰肉碱作为稳态模型的胰岛素抵抗指数(HOMA-IR)是FFMI的相关标记物。此外,一种BCAA代谢物,两种色氨酸相关代谢物和β-丙氨酸为炎症标志物与肌肉CSA或FFMI关联。
支链氨基酸有抗中枢疲劳的作用,也可以增加耐力和减少疲劳。脑内5-羟色胺水平升高与中枢疲劳有关。5-羟色胺不能跨越血脑屏障,因此神经元应自行合成5-羟色胺。色氨酸是5-羟色胺的前体,由于它们使用相同的载体系统,所以可以跨越血脑屏障与BCAAs竞争。如果血浆BCAAs增加,大脑摄取的BCAAs就会比色氨酸多,从而改善疲劳状态。Greer等[16]的研究发现,补充BCAAs能够减少主观用力率(RPE),这可能意味有氧能力没有下降。
目前还没有足够的关于BCAAs使用剂量的数据。然而,Waldron等[19]研究发现,一次大运动量训练后,以2∶1∶1的比例(亮氨酸∶异亮氨酸∶缬氨酸)急性补充 BCAAs(0.087 g/kg),与安慰剂相比,可以增加等长力量、纵跳高度和加速肌肉酸痛的恢复率。有限的证据表明,摄入1 250 mg/kg体重的亮氨酸,除了短期升高的血浆氨浓度外,似乎没有任何健康影响[20]。
1.3 蛋白合成促进剂的配合使用
蛋白合成促进剂的补充是提高老年人摄入蛋白质参与肌肉合成,防治肌少症的另一个有效方法。它们包括羟甲基丁酸(β-methylbutyate,HMB)、肌酸、L-肉碱、ω-3 脂肪酸、谷胱甘肽、瓜氨酸等的补充。
1.3.1 HMB HMB是一种亮氨酸代谢物,在人体内自然存在于骨骼肌中,亮氨酸和HMB都被认为是有效的蛋白质合成促进剂。目前的研究发现,HMB对老年肌少症有治疗作用。HMB似乎不仅可以预防,而且可以逆转减少症。HMB对骨骼肌的影响主要有5个方面,即:①抑制蛋白质分解,降低肌肉降解;②内质网钙释放增加;③骨骼肌脂肪含量降低;④氧代谢增加;⑤刺激卫星细胞,促肌肉再生等。HMB成为治疗和预防肌少症的潜在补剂(图2)[21]。

图2 HMB补充对骨骼肌的5个主要作用[21]Fig.2 Five main effects of HMB supplementation on skeletal muscle[21]
目前已有不少控制严格的人体实验证明HMB补充的实际效果。Kinoshita等[22]以34位体能低下的老年人(≥65岁)为研究对象,HMB试验组(17人)每日补充 2.4g羟甲基丁酸(3.0 g β-羟基-β-甲基丁酸钙),连续60 d,不从事规律运动。治疗后HMB组与对照组(17人)比较,握力明显增强。
Berton L等[23]给32位健康老年妇女(≥65岁)口服1.5g HMB钙8周,结果显示,与对照组(33人)比较,两组SPPB(简易体能状况测试)和握力没有差异,而口服HMB组的膝关节等长屈曲最大扭力、等长伸展最大扭力、等速最大扭力、6 min步行试验和握力耐力均优于对照组(图3)。这说明口服HMB钙8周,即可在一定程度上改善老年人的肌肉力量和体能。

图3 健康老年妇女口服HMB 8周后体能的变化[23]Fig.3 Changes of physical fitness of healthy elderly women after HMB administration for 8 weeks[23]
1.3.2 肌酸 老年人肌肉纤维数量会减少,特别是II型(快肌)纤维。这些纤维被肌内脂肪所取代。正常的Ⅱ型纤维中肌酸和CP(磷酸肌酸)含量特别高。正常衰老和肌肉损失降低了储存的肌酸水平,使运动时的能量供应减少。老年人补充肌酸能提高肌肉中的肌酸和CP水平,使人们能够更长时间和更高强度地运动,从而刺激肌肉质量和力量的增长[24]。
Eijnde等[24]的综述中查阅12篇研究报告,均为随机双盲对照研究。受试者均为年龄在65岁以上的20~40名老年人,使用类似的肌酸补充方案,给受试者5 g/d,持续几个月。最长的研究报告历时1年,其各组之间没有显著差异。这12项研究中有7项发现对去脂肌肉质量和/或力量有显著的有益影响,5项研究发现对肌肉质量或力量没有任何有益影响。
Chilibeck等[25]对22项研究进行Meta分析。共有男、女受试者721名(平均年龄57~70岁),随机分为肌酸补充组和安慰剂组,每周阻力训练2~3 d,为期7~52周。补充肌酸后瘦体重、胸部推举力量和压腿力量增加(差异均有显著性,P值为0.01~0.00001)。
补充肌酸后肌肉内肌酸的增加,理论上应能增加阻力运动时的肌肉合成,并对衰老的肌肉增生有有利的作用。为了支持这一假设,Forbes等[26]进行一项Meta分析,结果发现与单纯的阻力训练相比,补充肌酸加阻力训练可以提高老年人的肌肉质量和力量。从原理上看,肌酸可能通过增加细胞水合状态、肌原转录因子(即MRF-4和肌原蛋白)、卫星细胞活性和数目、合成激素分泌(即IGF-1),或通过降低全身蛋白质分解代谢和氧化应激而使肌肉肥大。
研究一致认为,肌酸摄入的最佳时间是运动前或运动后即刻,提示这可能比肌酸的实际剂量更重要[25]。Forbes等[26]引用Antonio等的研究发现,健康的老年男性(59~77岁)在阻力运动前和运动后立即服用肌酸各0.05 g/kg,每周3 d,共10周,与安慰剂组相比,超声波测量全身肌肉更粗大。有趣的是,在阻力运动前、后摄入肌酸与训练日早晨和晚上摄入肌酸比较会增加瘦组织质量。其作用机制难以解释。可能的原因包括运动诱导的骨骼肌血流量将肌酸向运动肌肉传递,上调肌酸转递运动力学,以及肌肉收缩时NA+-K+泵功能的增加。
1.3.3 左旋肉碱(L-肉碱)L-肉碱是一种条件必需的氨基酸,主要存在于骨骼肌,在人的肝、肾内合成。L-肉碱是脂肪、碳水化合物和蛋白质等底物能量代谢所必需的。其主要作用是将长链脂肪酸转运到线粒体基质进行β氧化。此外,L-肉碱通过节省氨基酸被用于能源生产来增加蛋白质生物合成。与此同时,L-肉碱抑制了骨骼肌中蛋白质降解的基因,减少了肌肉环指蛋白-1(MuRF1)和泛素-蛋白结合物,参与了蛋白质的钙代谢,并增加了蛋白质合成的主要驱动因子(mTOR)中的两个上游元素IGF-1和Akt 1的水平[27]。
Badrasawi等[28]从600名受试者中筛选出同意参与研究的58名老年前期体弱的成年人(平均年龄58~59岁)。分成试验组(L-肉碱1.5 g/d,共10周)和安慰剂组,进行随机双盲对照临床实验。结果显示,与安慰剂组相比,补充L-肉碱者的脆弱指数评分、握力和最大呼气流速(PEFR)有明显改善。IL-6水平下降的百分比少,IGF-1水平虽然也有明显升高,但是差别不具有显著性[28]。
2 维生素D和钙营养及肌肉骨骼的相互作用
维生素D与肌肉质量和性能有密切的关系。血清25-羟基维生素D[25(OH)D]水平与进行8英尺步行和5次椅子站立试验的时间有显著关系。当血清 25(OH)D 达到 50 nmol/L(20 ng/mL)的时候,即使在调整了其它潜在干扰物因素后,体力能力平均仍可增加2分。Mithal等[9]引用Bernardo的研究发现,血清25(OH)D水平降低与定时起跳试验和计时椅子站起试验成绩下降有关。
以往很少有人关注的维生素D营养不良,目前已经成为一种全球性流行病,这种缺乏症与多种慢性病风险增加有关,其中也包括肌少症。维生素D缺乏症被定义为血清25-羟维生素D水平低于20 ng/mL,而维生素D不足被定义为20~29.9 ng/mL之间的水平。目前,对于1~70岁的人,维生素D的RDA为600 IU/d,而70岁以上的人则需要800 IU/d。这就意味着血清25-羟基维生素D(25(OH)D)水平≥50 nmol/L(20 ng/mL),才能保证骨骼健康。1杯牛奶(225 mL)大约含有100IU维生素D[29]。
2005—2006年,美国维生素D缺乏的总患病率为41.6%,其中黑人患病率最高(82.1%),其次为西班牙裔(69.2%)[30]。
中国成年人维生素D营养状况也不容乐观。王翠侠等[31]对5个地区,以中老年人群为主的调查显示,维生素D缺乏率最低也接近20%,严重的可以高达90%以上(表3)。对于肌少症而言,维生素D营养状况是一个很值得关注的问题[31-35]。

表3 中国成年人维生素D营养状况调查[31-35]Table 3 Investigation on vitamin D nutritional status of Chinese adults[31-35]
不少的试验研究证实了维生素D补充对肌少症的防治效果。
Pfeifer等[9]在为期8周的双盲对照试验中,对血清25(OH)D值低于15 nmol/L的老年妇女进行钙1 200 mg/d和维生素D 800 IU/d治疗。维生素D治疗组身体晃动减少9%。
2011年,Muir等[36]检索到714篇相关的文章,其中有13篇符合维生素D的标准补充。其每天的补充量都是常规的800~1 000 IU,统计显示所有研究的维生素D补充都对肌肉力量和平衡有有益作用。
骨骼肌和骨质不断地参与到彼此的调节途径中,导致相互依赖。这些相互调节因子之一似乎是维生素D。研究结果表明,骨骼组织产生的维生素D反应性激素在维生素D存在时被激活,反过来,对肌肉蛋白合成(MPS)有积极的影响。与此相似的是,肌肉细胞产生的维生素D反应因子也会对骨组织产生积极的影响。必须考虑肌肉和骨胳的强度,以便为患有肌少症的老年人提供最佳的治疗和预防措施(图4)[6]。
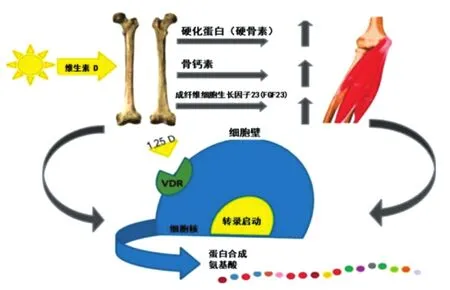
图4 肌肉骨胳的相互作用与维生素D受体[6]Fig.4 Muscle-bone cross-talk and vitamin D receptor[6]
如图4所示,硬化蛋白(硬骨素)是由成熟的骨细胞分泌的,是对维生素D激活的反应,它能增加骨量,对某些肌肉有积极的作用,然而其作用机制尚不清楚。骨钙素由成骨细胞产生,由维生素D调节。骨钙素通过改变线粒体功能和胰岛素敏感性,在肌肉中具有潜在作用。成纤维细胞生长因子23(FGF23)是一种由骨骼产生的维生素D反应激素,对心脏和平滑肌有积极作用。维生素D受体(VDR)存在于骨骼和肌肉细胞中,并被1,25维生素D(1,25D)激活,通过骨胳肌肉相互作用促进蛋白质合成[6]。
随着维生素D受体在人体肌肉细胞中的发现,维生素D可能通过直接启动转录和间接的肌肉骨胳相互作用机制来诱导MPS[6]。
除了对肌肉的合成作用外,维生素D还可能对骨骼肌的炎症起到调节作用。Farshidfar等[6]引用Choi等的研究结果,发现运动大鼠补充维生素D,可降低炎症细胞因子、白细胞介素-6(IL-6)和肿瘤坏死因子α(TNF-α)基因的表达,增加骨骼肌中维生素D受体蛋白的表达。
7项研究得出结论:补充维生素D可以改善肌肉功能和骨强度,从而防止肌少症、脆弱和降低老年人跌倒的风险。例如Farshidfar等[6]引用Mastaglia等的研究表明,血清25-羟基维生素D 20 ng/mL可较好地保存下肢的力量和功能。事实上,血液中较低的维生素D水平被发现与老年人的脆弱有关。Farshidfar等[6]引用Bischoff-Ferrari等的meta分析表明,老年人每天补充维生素D 700至1 000 mg,可以降低19%的跌倒风险。
根据 “第4届韩国国家卫生与营养检查调查(KNHANES IV)”数据表明,每天钙摄入量与骨骼肌质量呈正相关(rho=0.281,P<0.001),与体脂总量呈负相关(rho=-0.140,P<0.001)。与没有肌少症的受试者相比,肌少症的老年人每天摄入钙只有278 mg。此外,钙的状态受血液中维生素D水平的影响,这是因为1,25-二羟基维生素D是体内的一种有效形式,它与肠道中的维生素D受体结合,并刺激参与肠内钙的腔内转运蛋白的产生[6]。
3 抗氧化和抗炎与肌少症防治
有证据表明氧化应激和分子炎症在与年龄相关的肌肉萎缩中起着重要作用。在老年骨骼肌的氧化应激和慢性炎症过程中,一些主要的信号通路被激活或失活。这些通路与蛋白质合成和分解的不平衡、线粒体功能障碍和细胞凋亡有关,导致纤维萎缩和纤维丢失,最终导致骨骼肌萎缩(图5)[37]。
与年龄有关的细胞内氧化-还原平衡的破坏,似乎是导致慢性低度炎症的主要原因。慢性分子炎症可能是正常衰老和与年龄相关的病理过程之间的桥梁。衰老相关的氧化-还原敏感转录因子NF-kB已被证明能诱导炎症与年龄相关的关键分子如IL-6、TNF-α的上调。此外,活性氧簇(ROS)似乎也是骨骼肌中TNF-α的第2信使,直接或间接地激活 NF-kB(图5)[37]。

图5 氧化应激和慢性炎症可能导致肌少症的机制的原理性总结[37]Fig.5 A schematic summary of proposed mechanisms by which oxidative stress and chronic inflammation could contribute to sarcopenia[37]
Sullivan[38]通过研究证明,氧化氮(NOX)酶可能在老年肌肉中通过参与调节而生成过氧化活性氧簇(ROS)。该研究还表明,H2O2在肌少症发生中是ROS的关键物质,与此同时,过氧化氢酶和谷胱甘肽过氧化物酶(GPX)抗氧化保护能力的下降预示抗氧化功能紊乱,因此可能是导致肌肉减少症的发展或发病的主要因素。
3.1 虾青素与肌少症的防治
虾青素是一种很强的抗氧化剂。Liu等[39]设计了一个以58名70岁左右的老年人为试验对象的功效研究。设计包括对照组和虾青素处方组(虾青素12 mg、妥曲诺mg、锌6mg)。试验的某一个阶段还参入了跑台运动因素,结果表明,两组由于加入了3个月的跑台训练,耐力能力都增加了。在虾青素处方组中见到的最大自主收缩力(MVC)增加14.4%,胫骨前肌(TA)肌肉横截面积CSA增加2.7%,单位力量(specific force,MVC/CSA)上升11.6%,而在对照组都未见到。由此得出结论:虾青素处方结合功能训练方案,可独特地提高老年人的肌肉力量、耐力和活动能力。
3.2 ω-3脂肪酸在肌少症中的使用
ω-3脂肪酸是多不饱和脂肪酸(PUFA),是具有抗炎作用的必需营养素。omega-3在肌少症中的确切作用机制仍在研究中,现有抗炎作用,通过激活mTOR通路而产生转录调控的合成效应和胰岛素抵抗的降低等3种假说机制,并有一定的支持数据[40]。
Farshidfar等[6]引用Smith等对16名年龄65岁或以上的健康老年人进行1项随机对照试验,受试者被分为omega-3脂肪酸组或玉米油组(对照组),结果显示,两组高氨基酸血症高胰岛素钳夹在给药后均升高,而只有omega-3脂肪酸组反映肌肉合成信号通路的mTORC1和p70S6K活性也有类似的正效应(P=0.07和P<0.05)。这项试验数据表明,omega-3脂肪酸可能在克服骨骼肌的代谢障碍和减轻老年人肌肉质量损失方面起着重要作用。
omega-3脂肪酸对肌肉的影响已经超出增加MPS和肌肉质量的范围。事实上,omega-3脂肪酸的补充已被证明可以通过增强肌肉的力量和性能来改善肌肉功能。Smith等的另一项研究证明,补充 1.86g 二十碳五烯酸(EPA,C20:5n-3)/d和1.5g 二十二碳六烯酸(DHA,C22:6n-3)/d,连续 6 个月,不仅可以增加大腿肌肉的体积,而且还能增强手握力和平均等速动力。同样,对近3 000名老年男性和女性的饮食评估显示,男、女中,多脂鱼的食用量与握力之间存在着明显的关联[6]。
现有研究表明老年人膳食中omega-3脂肪酸的摄入量可能不足,需要更多的研究来找出妨碍老年人食用天然来源的omega-3脂肪酸的障碍。每天食用1.27g omega-3脂肪酸或每周食用1份多脂鱼与更高的骨密度、更大的腿部力量和较低的从椅子站起的时间有关。综上,饮食和/或补充形式的omega-3脂肪酸似乎都是改善与老年人与肌少症有关的功能损害的有效方法[6]。
3.3 维生素E在肌少症预防和治疗上的作用
维生素E是一种有效的过氧自由基清除剂,可以防止自由基在细胞膜和血浆脂蛋白中的蔓延。生成的活性较低的生育酚氧自由基会与维生素C发生反应,从而将维生素E恢复到其还原状态。尽管在文献中很少提到维生素E在维持肌肉健康方面的作用,然而有一项研究表明维生素E在修复营养不良肌肉中的作用[41]。
衰老与氧化应激增加、低度炎症(炎症因子的慢性分泌,处于低度状态)、膜过氧化和线粒体功能障碍有关。其结果是导致神经肌肉神经支配、II型纤维和肌肉再生活性下降,最终导致肌肉质量和力量下降[42]。图6展示维生素E在减轻与年龄相关的骨骼肌功能障碍中的作用机制。
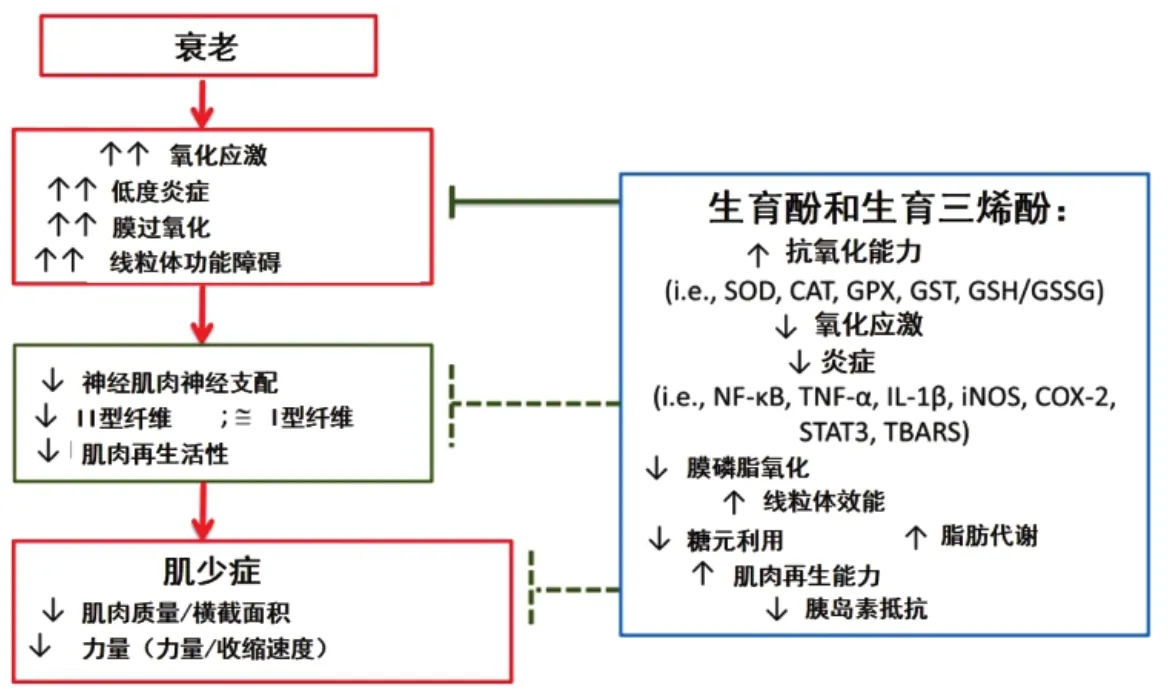
图6 维生素E在减轻与年龄相关的骨骼肌功能障碍中的作用机制[42]Fig.6 Proposed mechanisms of action of vitamin E in mitigating age-associated skeletal muscle dysfunction[42]
维生素E的主要作用是使机体免受氧化应激和炎症的影响。在肌肉收缩过程中,维生素E修复ROS引起的膜损伤(图7)[41]。最近的1项研究表明,维生素E(富含生育三烯酸的片段,TRF)可以逆转应激诱导的成肌细胞的衰老,说明维生素E对肌肉细胞有潜在的治疗作用)[41]。

图7 维生素E在细胞膜修复中的作用[41]Fig.7 Role of vitamin E on cell membrane repair[41]
1998—2000年间,意大利一项以老年人为基础的前瞻性chanti地区老龄问题研究(InCHIANTI)中[43],对 1 156名年龄在65岁至 102岁之间的受试者进行分析,其中986名参与者每天不补充维生素,并有能力进行体能和膝关节伸展力量测试。在未经调整的分析中,维生素E每日摄入水平已显示为与膝关节伸展角度和总体能评分呈正相关。根据血浆浓度和每日摄入量对数据进行调整后,γ-生育酚与肌力之间存在相关性,α-生育酚与这两种测量值之间存在显著的相关性。Ble等[44]在排除了残疾人、癌症患者和补充维生素E的受试者后,对827名参加InCHIANTI研究的人进行的维生素E与脆弱的相关性分析发现[44],与非脆弱个体相比,脆弱个体的循环维生素E水平明显偏低,这表明脆弱个体受到更高的自由基攻击。在电镜下观察到由于维生素E缺乏引起的肌肉形态变化,包括线粒体变性、肌浆网碎裂和髓磷脂的积累等肌肉营养不良的进展。
4 结语
肌少症是一种老年人的多发病,会带来多种危害。其病因与营养(特别是蛋白质)摄入不足和多种机能的衰老有关。在难以通过膳食满足其营养需要的情况下,合理的营养品补充是必不可少的干预手段。

