有氧运动调控神经生长因子表达改善心力衰竭大鼠心脏交感神经功能
李晓霞 李梅 邢军 朱中新 张行 赵赛 孔亦乐 宋玉莹 赵龙 曹业童
山东体育学院(济南 250102)
去甲肾上腺素(norepinephrine,NE)是交感神经节后纤维释放的主要神经递质,其生物学效应是通过突触前和突触后肾上腺素能受体介导的,包括提高心率和心肌收缩力、增加血管紧张度、上调肾素-血管紧张素系统活性以及促进肾脏对钠离子重吸收[1]。交感神经囊泡释放的NE在发挥作用后约80%~90%会被位于神经元突触前膜的单胺转运蛋白——去甲肾上腺素转运体(norepinephrine transporter,NET)再摄取,及时终止神经冲动信号并维持受体对神经递质的敏感性。使用非选择性NET抑制剂西布曲明(sibutramine)可引起NE过度释放以及心脏肾上腺素能反应过度,进而造成心脏结构和功能异常[2],提示NET对心血管交感神经系统起负反馈调节作用。研究显示[2],各种原因造成的心血管疾病(原发性高血压、缺血性心脏病、应激性心肌病)以及发展至终末阶段的心力衰竭(心衰)患者均存在交感神经过度兴奋、NE释放增加,其机制与NET表达下降、再摄取功能减弱有关。神经生长因子(nerve growth factor,NGF)是神经营养因子家族的一员,通过与其受体(TrkA)结合进而促进中枢和外周神经生长、分化、存活以及再生,在维持神经系统发育和整合的生理功能中起调节作用[3]。研究发现,多种心血管疾病均与NGF有直接关联[4],而交感神经节内注射NGF还能够改善心衰大鼠NET结构和功能[5],因此NGF-TrkANET信号途径有望成为心衰治疗的新靶点。
流行病学调查发现[6],有氧运动能力作为重要的临床参数,是多种心血管疾病患者全因死亡率的强预测因子,而长期有氧运动可对多个器官系统产生良性作用,包括肌肉(心肌和骨骼肌)线粒体生物合成增加、毛细血管增多、血管顺应性提高以及心输出量增加[7],最终提升患者运动能力、改善生活质量并降低死亡率。因此,有氧运动已成为多种慢性病(包括心衰、高血压、糖尿病等)一级和二级预防的干预手段以及临床治疗的重要补充[8]。研究证实[9],有氧运动能够抑制心衰患者交感神经过度兴奋状态,但具体机制尚未明确。课题组前期的研究证实[10],有氧运动通过上调心肌梗塞大鼠心脏交感神经元NET的表达,促进对NE再摄取并恢复交感神经末梢NE释放量。鉴于NGF在维持NET功能中的作用,因此推测NGF-TrkA信号途径可能参与了运动对交感神经活性的调控。本研究旨在观察有氧运动对心肌梗塞后心衰大鼠心脏重塑以及心脏交感神经功能的影响并探讨NGF-TrkA在其间的可能作用机制。
1 研究对象和方法
1.1 实验动物与分组
8周龄SPF级雄性Wistar大鼠36只,购自山东鲁抗医药股份有限公司。实验动物许可证号:SCXK[鲁]2008-0003)。分笼饲养(2只/笼),室温22℃~26℃,湿度60%~70%,12/12 h明暗交替循环,自由进食水。动物适应性饲养1周后采用SPSS 20.0随机生成数字表分为假手术组(sham group,Sham组)、心衰安静组(heart failure sedentary group,HF-sed)和心衰运动组(heart failure exercise group,HF-ex组),每组12只。
1.2 心肌梗塞后心衰模型制备
参照课题组前期建立的方法[10-16]制备心肌梗塞后心衰模型(HF-sed和HF-ex组),方法简述如下:称重后腹腔麻醉(30 g/L戊巴比妥纳,10 ml/kg体重)大鼠,仰卧位固定于手术台上,行气管插管并接动物呼吸机(潮气量10 mL/kg体重,呼吸频率65 b/min,呼吸比1.5︰1)。备皮后,于胸骨左缘3 mm处纵型切开皮肤约3~4 cm,依次分离胸壁肌肉打开胸腔,破坏心包暴露心脏并分离左冠状动脉前降支,用0号丝线结扎。结扎成功的标志:结扎后肉眼可观察到结扎远端局部心脏表面变白,同时在心电图显示ST段抬高以及心律失常表现。Sham组大鼠进行假手术,即麻醉开胸后只在左冠状动脉前降支下方穿线但不结扎,其他操作同上。术后连续7 d肌肉注射抗生素预防感染。4周后 HF-ex组开始进行跑台运动训练,Sham组和HF-sed组于鼠笼内安静饲养。
1.3 运动方案
先利用课题组前期建立的方法测定HF-ex组大鼠最大有氧速度(maximal aerobic speed,MAS)[10],方法为:以5 m/min跑速(坡度:0°)进行15 min热身后休息5 min,随后进行递增负荷力竭运动实验,即起始负荷为7 m/min,每3 min递增5 m/min,直至力竭(坡度始终为0°)。
参照课题组前期研究[10-16]制定HF-ex组运动方案,该组大鼠进行5 d/周、共10周的跑台运动训练,运动强度前2周为50%MAS,后8周为60%MAS,运动时间逐渐递增,第1天30 min,以后每天增加10 min,直到60 min/d。
1.4 心脏结构与功能测定
末次训练后48 h,先称量体重,随后用戊巴比妥钠(10 mL/kg体重)腹腔注射麻醉动物,仰卧固定,胸部备皮,用小动物超声影像诊断系统(visualsonics vevo770,加拿大)检测心脏结构与功能,指标包括:左心室舒张末期直径(leftventricularend-diastolicdiameter,LVEDD)、左心室壁厚度(left ventricular wall thickness,LVWT)和左心室射血分数(left ventricular ejection fraction,LVEF)。
1.5 动物取材
超声检测后尾静脉取血200 μL,EDTA抗凝,4℃、3000 rpm离心15 min取血浆,-20℃冻存待测血浆NE。随后取大鼠心脏,用生理盐水冲洗后滤纸沾干,称量心脏重量(heart mass,HM),计算与体重的比值作为心脏质量指数(heart mass index,HMI)。分离左心室,称量左心室重量(left ventricular mass,LVM)并计算与体重的比值作为左心室质量指数(left ventricular mass index,LVMI)。随后在左心室最大横径处横切将其分为两部分,一部分利用Masson染色进行组织病理学观察,另一部分投入液氮中并转入-80℃低温冰箱冻存待测心肌NE含量和相关基因表达水平。
1.6 心脏组织病理学观察
将心肌组织用10%甲醛溶液固定,经脱水、透明、包埋和切片(5 μm)后利用Masson染色制作组织切片,每张切片随机选取5个视野,用图像分析软件(Image Pro Plus 6.0,美国)测量胶原面积,用胶原面积与所测视野面积的比值作为胶原容积分数(collagen volume fraction,CVF),表示心肌纤维化程度。
1.7 血浆与心肌NENE测定
取100 μL血浆,加入200 μL浓度为0.05 mol/L的高氯酸溶液,常温10000 rpm离心5 min,取上清,用日本产岛津LC10ATvp型高效液相色谱仪测定血浆NE含量(单位:μg/mL)。取50 μg心肌组织,按2 μL/mg加入浓度为0.1 mol/L的高氯酸溶液,常温18000 rpm离心15 min,取上清,同样方法测定心肌NE含量(单位:μg/mg湿肌)。
1.8 心肌NGFNGF、TrkATrkA、NETNET和酪氨酸羟化酶(tyrosineosine hydroxylaseylase,THTH)mRNAmRNA表达测定
心肌组织匀浆后,Trizol法抽提总RNA,采用A260紫外吸收测定法和变性琼脂糖凝胶电泳法检测RNA质量与纯度。上下游引物采用Primer 5.0(美国)进行设计(见表1),逆转录反应获得cDNA,使用实时荧光定量PCR仪(ABI 7900型,美国)测定心肌NGF、TrkA、NET和TH mRNA表达量。扩增条件为:预变性95℃/1min;95℃/15s,55℃/15s,72℃/15s,共40个循环。以βactin为内参基因,计算各目的基因的相对表达量。

表1 引物序列设计
1.9 心肌NGFNGF、TrkATrkA、NETNET和THTH蛋白表达测定
取100 mg心肌组织经匀浆裂解后,4℃、20000 g离心15 min,考马斯亮蓝法测定总蛋白浓度。取10 μg蛋白样品在垂直电泳仪上经15%SDS-PAGE分离后,转移至PVDF膜上。一抗(兔抗鼠)4℃静置孵育过夜,二抗(辣根过氧化物酶标记的羊抗兔IgG)37℃孵育1~2 h,充分洗涤后,使用ECL发光成像,利用Image Pro Plus 6.0软件(美国)扫描各条带灰度值。β-actin为内参蛋白,计算各目的蛋白的相对表达量。
1.10 统计学分析
所有数据以“均数±标准差”表示,组间比较使用单因素方差分析(Fisher检验),若F值具有统计学意义(P<0.05),则使用S-N-K检验进行多重比较。P<0.05为差异具有统计学意义。统计软件为SPSS 20.0 for windows。
2 结果
2.1 样本量分析
实验过程中(包括造模和10周运动干预),由于手术失败、拒跑、意外死亡等原因,共剔除8只动物,最终样本量n=28,其中Sham组(n=11),HF-sed组(n=9),HF-ex组(n=8)。
2.2 体重、心指数、心脏结构与功能
与Sham组比较,HF-sed组体重和LVEF降低(P<0.05),HM、HMI、LVW、LVMI、LVEDD 和 LVWT 增加(P<0.05);与HF-sed组比较,HF-ex组LVEDD下降,LVEF升高(P<0.05)。见表2。心脏超声见图1。
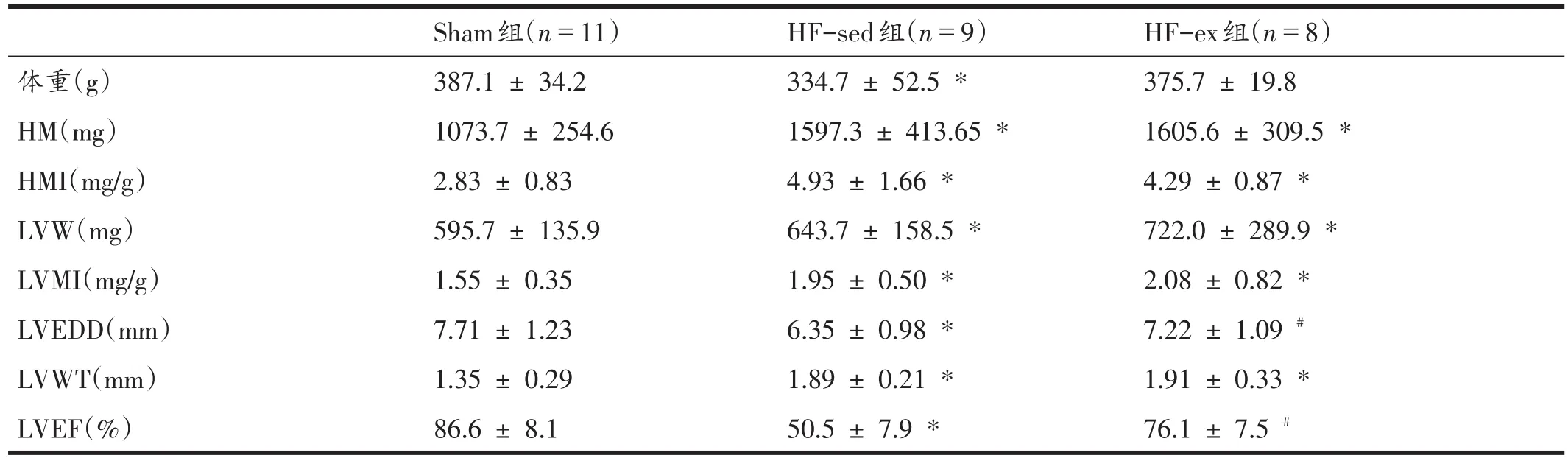
表2 体重、心指数、心脏结构与功能

图1 超声心动图
2.3 心肌Massonasson染色与CVFCVF
心脏组织病理学观察显示(见图2):心肌细胞呈暗红色,胶原纤维呈浅蓝色。Sham组心肌细胞排列整齐,仅含有少量胶原纤维;HF-sed组心肌细胞减少、排列紊乱,胶原含量明显增多(黑色箭头所示部位即为胶原成分),CVF显著高于Sham组(P<0.05);HF-ex组较HF-sed组心肌细胞增多、胶原纤维有所减少,CVF降低(P<0.05)。各组CVF的变化见图3。
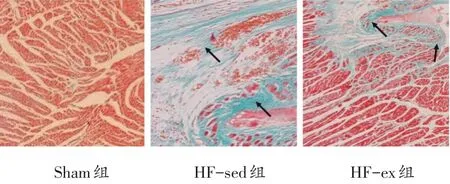
图2 心肌Masson染色(×200)
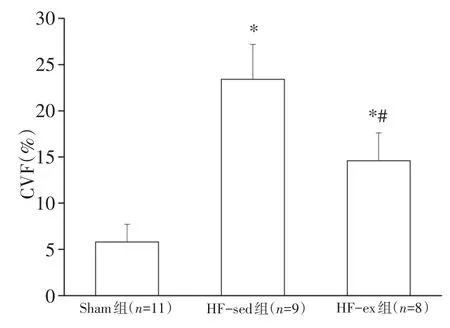
图3 心肌CVF变化
2.4 血浆与心肌NENE含量变化
与Sham组比较,HF-sed组心肌NE含量下降(P<0.05),HF-sed和HF-ex组血浆NE含量增加(P<0.05);与HF-sed组比较,HF-ex组心肌NE含量升高(P<0.05),血浆NE含量降低(P<0.05)。见图4。
2.5 心肌NGFNGF、TrkATrkA、THTH和NETNET基因表达(mRNAmRNA和蛋白)的变化
与Sham组比较,HF-sed组心肌NGF、TrkA和TH mRNA与蛋白以及NET蛋白表达量降低(P<0.05);与HF-sed组比较,HF-ex组心肌NGF、TrkA和TH mRNA与蛋白以及NET蛋白表达量升高(P<0.05)。未检测出心肌NET mRNA表达量。见图5~6。
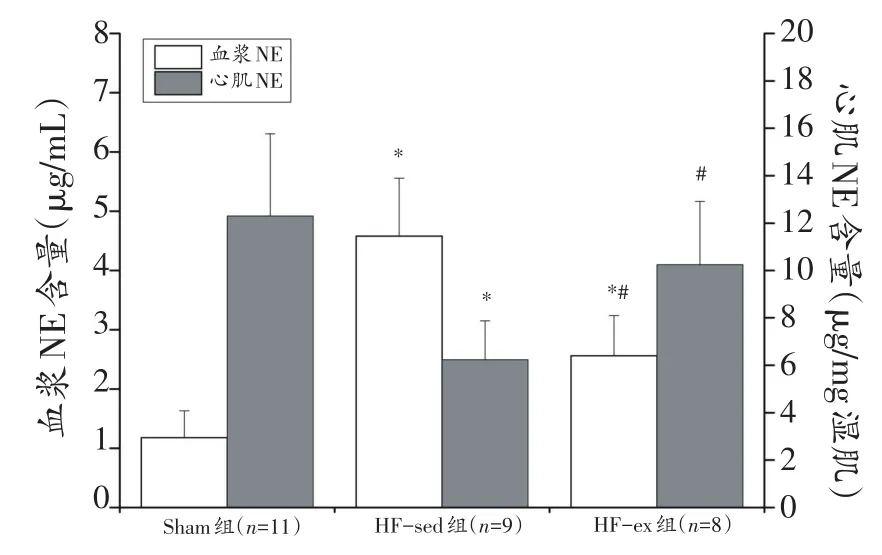
图4 血浆与心肌NE含量变化
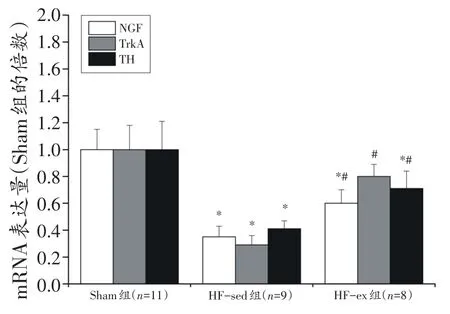
图5 心肌NGF、TrkA、TH mRNA表达的变化
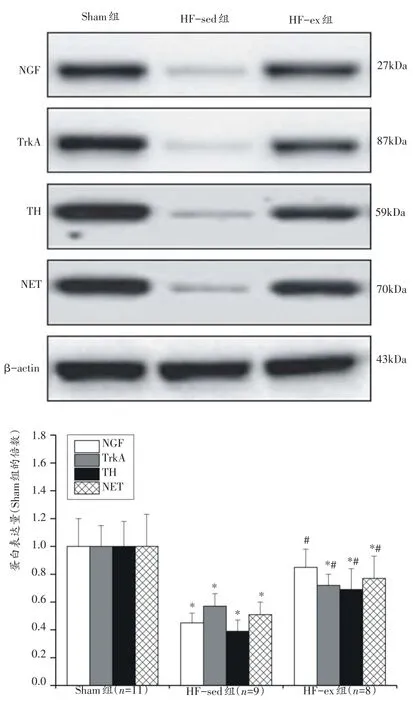
图6 心肌NGF、TrkA、NET和TH蛋白表达的变化
3 讨论
结扎左冠状动脉前降支造成心肌梗塞是心衰最常用的造模方法,其它方法还包括腹主动脉缩窄法、阿霉素或异丙肾上腺素注射法以及快速心室起搏法等。一般认为冠状动脉结扎术后2~4周即可获取慢性心衰模型并广泛应用于心衰病因、病理生理机制以及治疗等方面的研究。在本研究中,心衰造模后14周,HF-sed组心脏出现结构与功能重塑,心脏超声和心脏几何学表现为心肌肥厚、左心室扩张、心功能下降,即HM、HMI、LVW、LVMI、LVEDD和LVWT增加,LVEF降低;病理组织学显示心肌间质出现明显纤维化,CVF升高。上述结果提示,HF-sed组大鼠出现心功能不全且处于心肌梗塞所致心衰失代偿期,最终导致心脏舒缩功能障碍并加速心衰进程。
大量研究证实[10-20],有氧运动对于心衰动物/临床患者具有良好的辅助治疗(康复)作用,可有效减轻疲劳、呼吸困难等症状,提高心功能和运动耐力,改善生活质量。本研究发现,经过10周跑台有氧运动后,与HF-sed组比较,HF-ex组虽然心脏肥大并未得到改善(HM、HMI、LVW和LVMI与HF-sed组无显著性差异),但心腔内径(LVEDD)缩小,心功能提高(LVEF增加),心肌纤维化减轻(CVF减少),说明有氧运动可通过抑制心脏重塑提高心脏舒缩功能,进而延缓心衰进程。这与Garciarena等[21]针对自发性高血压大鼠的研究基本一致,即心衰所致的病理性心脏肥大经过规律运动后向生理性心脏肥大转化。然而目前关于有氧运动对心衰有益效应的机制尚未完全明确。
心脏自主神经系统调控心脏的兴奋性、节律性、传导性和收缩性,是维持心功能的重要因素。心交感神经通过释放神经递质NE激活β-肾上腺素受体(β-adrenergic receptor,β-AR),对心脏功能发挥变时、变力、变传导的调节作用。各种病因导致心衰时均出现心脏交感神经功能异常并与心衰后的不良结局密切相关,而β-AR阻滞剂则可改善心功能并降低病死率[22],说明交感神经过度激活是心衰发生发展的重要机制。本研究中,血浆NE含量显著升高,说明全身交感活性显著增加。研究证实[2],心衰时血浆NE浓度显著升高,除了与交感神经元NE外溢(NE spillover)有关外,还与位于交感神经突触前膜的NET功能异常有关。NET的主要作用是将交感神经元末梢释放的NE再摄取到突触前膜中,以便及时终止神经冲动信号,避免过量NE对心脏的毒性效应[2]。本研究发现,HF-sed组NET蛋白表达下调,提示其摄取功能下降,与课题组前期的研究结果一致[10]。需要注意的是,各组心肌未检测到NET mRNA表达量,而课题组前期证实[10],NET mRNA在心脏交感神经节(即颈中-星状神经节复合体)表达,因此推测NET蛋白在神经节中翻译后通过神经轴突转运到突触前膜上发挥再摄取功能[2]。与血浆NE变化不同,HF-sed组心肌NE含量低于Sham组,提示心肌交感活性下降,心肌TH表达下降也证实了这一点(TH是NE合成代谢通路中的关键酶,其表达量可间接反映心交感神经活性)。可能的原因是,心衰代偿期时,交感神经系统激活以及循环NE增高导致心肌间质NE浓度升高,但交感持续活化、高浓度NE对心肌产生毒性作用,可诱导心肌细胞凋亡,心肌交感神经密度下降,即所谓的交感去神经(sympathetic denervation)[1]。此外,过量产生的NE还可促使β-AR表达下调、受体对NE反应性下降以及受体后的信号转导脱耦联(脱敏反应)[23],心肌NE含量下降。
NGF对于交感神经生长、分化与再生以及维持其正常功能起重要调节作用[3]。NGF的高亲和性受体是由原癌基因trk编码的一种酪氨酸蛋白激酶受体(TrkA),NGF和TrkA结合后产生的信号转导机制与其他酪氨酸蛋白激酶受体相似[24]。研究证实,诸多心脏疾患如心肌梗塞、高血压、心律失常、心衰等均与NGF和TrkA有直接关联[4]。在本研究中,与Sham组比较,HF-sed组NGF和TrkA mRNA和蛋白水平均显著性降低,与Kaye等[25]和Xing等[4]针对心衰动物的研究结果一致。NGF与TrkA表达下调影响交感神经生长并造成其分布密度下降。
对心脏NGF信号转导通路以及交感神经活性的调节无疑是保护心功能,延缓心衰进程的治疗靶点。多项报道显示[9],规律体力活动能够改善心血管疾病患者的自主神经功能,然而运动是否通过影响NGF和TrkA基因表达而发挥心血管保护效应尚不得而知。本研究发现,经过10周跑台训练,HF-ex组NGF和TrkA mRNA和蛋白表达量较HF-sed组均显著增加,提示有氧运动可能通过维持NGF-TrkA稳态平衡而促进交感神经生长和存活,进而提高心脏交感神经密度(TH mRNA和蛋白表达上调),最终改善心功能。动物实验证实[3-5],NGF可激活病理状态下心脏交感神经再生和功能修复、改善NET结构和功能,这对于降低心血管不良事件发生率具有积极作用。在本研究中,HF-ex组NET蛋白表达量较HF-sed组上调,但仍低于Sham组,提示NET功能仅部分恢复。HF-ex组血浆NE含量下降,证实全身交感过度激活得到抑制,然而心肌NE水平显著性升高,似乎与NET表达上调相悖。可能的解释是,心衰失代偿期心肌交感神经密度下降造成心肌间质NE含量降低[1,23],有氧运动通过上调NGF和TrkA表达增加心肌交感神经密度进而提高心肌NE水平,因此心肌NE升高是对长期运动的适应性反应。此外,由于NET表达上调,其对交感神经末梢NE释放的调节作用得到恢复,从而改善心衰后自主神经功能紊乱状态[10]。总之,NGF-TrkA-NET信号转导途径参与了运动对心衰大鼠心肌的保护作用,可能是心衰康复治疗的干预靶点之一。
4 结论
心衰后出现交感神经功能紊乱、心脏重塑、心功能下降,其机制可能与NGF、TrkA和NET表达下调有关;长期有氧运动可通过改善心衰大鼠心脏交感神经功能逆转心脏重塑、提高心功能,其机制可能与NGF与TrkA表达上调进而部分恢复NET功能有关。

