胸膜肺炎放线杆菌Apx IIIA、Apx IVA蛋白表达及重组亚单位疫苗的研究
宋 丹,李 鹏,刘翠翠,陈金顶,易 琳,丁红星,赵明秋
(华南农业大学 兽医学院,广东广州510642)
猪传染性胸膜肺炎(Porcine contagious pleuropneumonia,PCP),是危害世界养猪业的三大呼吸道疾病之一,是由胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)引起的以坏死性和纤维性出血性肺炎为特征的传染性疾病[1-3]。该病自1957 年发现并报道以来,在世界范围内广泛流行,给集约化养猪业造成了严重的经济损失[4-5]。目前,我国主要通过接种灭活疫苗来预防PCP,但由于该病原血清型较多、毒力因子复杂等,常规疫苗的使用已经无法达到有效预防该疾病的目的。因此,开发新型、安全高效的疫苗已经成为该领域研究的热点。
APP 能够产生多种致病因子,包括脂多糖、荚膜多糖、外膜蛋白(OMP)、溶血外毒素和转铁结合蛋白等,其致病机理较为复杂,各组分间的相互作用尚未彻底明确[6-7]。溶血外毒素(Apx)被认为是APP 引起宿主肺部感染最主要的毒力因子[8]。目前已经发现的Apx 有ApxⅠ、ApxⅡ、Apx Ⅲ和Apx Ⅳ,其中ApxⅠ具有很强的细胞毒性和溶血活性,是APP 重要的毒力基因和保护性抗原;ApxⅡ具有较强的细胞毒性,Jansen 等证实该毒素生物活性的发挥需要完整的毒力基因;Apx Ⅲ无溶血活性但有很强的细胞毒性;Apx Ⅳ毒素是最晚发现的,但其存在于APP 的所有血清型中[9-10]。本研究室前期研究结果显示rApxⅠA、rApxⅡA 和重组OMP (rOMP)联合免疫小鼠比单因子免疫能够产生更高的抗体水平和更强的保护力[11],本研究在此基础上利用基因工程的方法表达两种重组蛋白rApx ⅢA 和rApx ⅣA,并将表达纯化后的4 种Apx 重组蛋白和外膜重组蛋白按质量等比混合制成疫苗,以期获得一种安全高效的PCP 亚单位疫苗,为该病的防治提供参考。
1 材料与方法
1.1 菌株、载体与实验动物 大肠杆菌BL21(DE3)感受态细胞、表达载体pET-32a(+)、血清Ⅰ型APP(LD50为4.56×106cfu)、APP 阳性血清、重组蛋白rApxⅠA、rApxⅡA 和rOMP 均由华南农业大学兽医学院微生物学与免疫学教研室保存[11];PCP 灭活疫苗为武汉科前动物生物制品有限公司产品。4 周龄~6 周龄BALB/c 雌性小鼠购自广州南方医科大学实验动物科技有限公司。
1.2 主要试剂 高保真酶Primestar、限制性内切酶BamHⅠ、XhoⅠ、EcoRⅠ、T4 DNA 连接酶和IPTG等购自TaKaRa 公司;细菌基因组提取试剂盒购自Sigma 公司;胶回收试剂盒、质粒抽提试剂盒购自Omega 公司;His FF 蛋白纯化柱购自GE 公司;蛋白浓度测定试剂盒购自上海Thermo 公司;羊抗鼠IgG-HRP、丙烯酰胺和考马斯亮蓝等购自广州豪凯生物科技有限公司;甘氨酸、NAD、Tris base 和KCl 等无机化学试剂购自广州康龙公司。
1.3 引物设计与合成 参照GenBank 中登录的猪传染性胸膜肺炎放线杆菌ApxⅢA基因序列(AF363363.1)和ApxⅣA基因序列(AX002405)分别设计合成了一对特异性引物。在扩增ApxⅢA基因的上下游引物P1/P2 中分别引入BamHⅠ和XhoⅠ酶切位点,在扩增ApxⅣA基因的上下游引物P3/P4中分别引入EcoRⅠ和XhoⅠ酶切位点,引物由上海生工生物工程技术服务公司合成。引物序列为P1:5'-CGCGGATCCTTGGTTACTGGTATCACAGG-3'/P2:5'-CCGCTCGAGTTAACTCAATTCGCGCGTAACA-3';P3: 5'-CCGGAATTCGGCAAAGGGAATGATGTG-3'/P4: 5'-CCGCTCGAGTTACCCATTATTTCCGTCCGG T-3' (下划线处为酶切位点)。
1.4 重组表达载体pET-ApxⅢA和pET-ApxⅣA的构建与鉴定 按照细菌基因组提取试剂盒说明书从PCP 灭活疫苗中提取APP 的DNA,以其为模板,分别用特异性引物P1/P2 和P3/P4 PCR 扩增ApxⅢA基因和ApxⅣA基因(94 ℃5 min;94 ℃30 s、55 ℃30 s、72 ℃40 s,共30 个循环;72 ℃延伸7 min)。对PCR 产物回收纯化后通过双酶切将ApxⅢA基因和ApxⅣA基因分别克隆于表达载体pET-32a(+)中,经双酶切、测序验证后将重组质粒命名为pETApxⅢA、pET-ApxⅣA。
1.5 重组蛋白的诱导表达与鉴定 分别将重组质粒pET-ApxⅢA、pET-ApxⅣA转化BL21 (DE3)感受态细胞,挑取单菌落37 ℃震荡培养至OD600nm为0.6左右,经IPTG (终浓度为1.0 mmol/L)诱导表达后取1 mL 菌液进行SDS-PAGE 电泳,检测重组蛋白的表达。取适量上述诱导后的菌体沉淀按照1 mL His FF 柱说明书纯化,纯化后的rApx ⅢA 和rApx ⅣA同本研究室前期表达纯化过的rApxⅠA、rApxⅡA和rOMP 一起采用BCA 法测定蛋白浓度后-80 ℃保存备用。
纯化后的蛋白经SDS-PAGE 电泳分析后,以APP 阳性血清(1∶100)为一抗,再以羊抗鼠IgG-HRP(1∶5 000)为二抗,通过DAB 底物显色进行western blot 分析重组蛋白的反应原性。
1.6 疫苗的制备 根据上述1.5 中测定的蛋白浓度,将表达纯化后的rApxⅠA、rApxⅡA、rApx ⅢA、rApx ⅣA 和rOMP 按质量等比例混合,并将其与弗氏佐剂按1∶1 的体积比或与白油佐剂按1∶2 的体积比乳化,制备成抗原终浓度均为500 μg/mL (各蛋白各100 μg/mL)的重组亚单位疫苗,4 ℃保存备用。
1.7 小鼠免疫及抗体效价的测定 为评估本研究制备的重组亚单位疫苗的免疫效果,将50 只BALB/c雌性小鼠随机分为5 组(Ⅰ~Ⅴ组),每组10 只。第Ⅰ组接种PCP 灭活疫苗;第Ⅱ组接种弗氏佐剂乳化的亚单位疫苗;第Ⅲ组接种白油佐剂乳化的亚单位疫苗;第Ⅳ组接种PCP 灭活疫苗+ 白油佐剂乳化的亚单位疫苗;第Ⅴ组接种PBS,免疫剂量均为200 μL/只(表1)。每次免疫间隔两周,均采用皮下接种途径,共免疫3 次。各组小鼠分别在一免后7 d、21 d和35 d 断尾采血,分离血清。采用方阵滴定法测定各抗原最佳包被浓度、血清稀释度、羊抗鼠IgG-HRP 稀释度和抗体孵育条件,根据最佳反应条件分别包被各抗原后采用间接ELISA[12-13]测定小鼠血清中的rApxⅠA、rApxⅡA、rApx ⅢA、rApx ⅣA 和rOMP 的抗体水平。
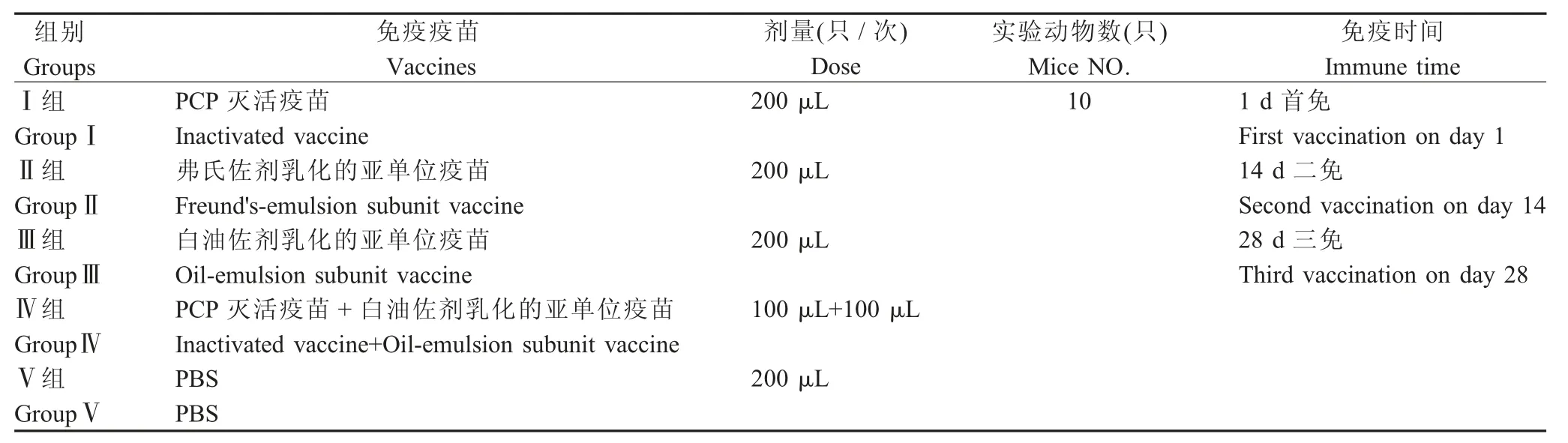
表1 动物试验设计Table 1 Design of the animal experiments
1.8 攻毒保护试验 按照表1 中的动物分组与免疫程序接种小鼠进行免疫效果测定,每次免疫间隔两周。三免一周后,用对数生长期的血清Ⅰ型APP 菌液对各组小鼠经腹腔注射攻毒,攻毒剂量为10 LD50/只(4.56×107cfu),攻毒后1 h~72 h 观察并记录小鼠发病和死亡情况,计算各组死亡率和保护率。
2 结 果
2.1 重组表达载体pET-ApxⅢA和pET-ApxⅣA的构建与鉴定 以APP 的基因组DNA 为模板,用特异性引物P1/P2,PCR 扩增出一条约850 bp(ApxⅢA基因)的目的条带;用特异性引物P3/P4,扩增出一条约700 bp (ApxⅣA基因)的目的条带,均与预期一致(图1)。分别将目的基因ApxⅢA、ApxⅣA克隆于pET-32a(+)载体,构建了重组表达载体pETApxⅢA和pET-ApxⅣA。
将构建的重组质粒pET-ApxⅢA经BamHⅠ、XhoⅠ双酶切后显示在约5 800 bp 和850 bp 各有一条特异性条带;重组质粒pET-ApxⅣA经EcoRⅠ、XhoⅠ双酶切后显示在约5 800 bp 和700 bp 各有一条特异性条带,均与预期一致(图2)。表明正确构建了重组质粒pET-ApxⅢA和pET-ApxⅣA。
2.2 重组蛋白的诱导表达与鉴定结果 将鉴定正确的pET-ApxⅢA、pET-ApxⅣA分别转化BL21(DE3)感受态细胞中,阳性重组菌经IPTG 诱导后经SDS-PAGE 检测结果显示,经诱导的pET-32a-ApxⅢA/BL21 在50 ku 有一条目的条带;经诱导的pET- 32a-ApxⅣA/BL21 在45 ku 有一条目的条带,均与预期一致(图3),表明重组蛋白(rApx ⅢA、rApx ⅣA)获得了表达。纯化后的rApx ⅢA、rApx ⅣA 同本研究室前期纯化的rApxⅠA、rApxⅡA 和rOMP 经BCA 法测定的蛋白浓度分别为459 μg/mL、1 393 μg/mL、1 229 μg/mL、856 μg/mL、699 μg/mL。western blot鉴定结果显示,在50 ku 出现rApx ⅢA 特异性条带(图4A);在45 ku 出现rApx ⅣA 特异性条带(图4B),表明两种重组蛋白均具有良好的反应原性。
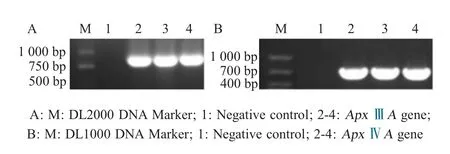
图1 Apx ⅢA 基因和Apx ⅣA 基因的PCR 扩增Fig.1 The amplification of Apx ⅢA and Apx ⅣA genes by PCR
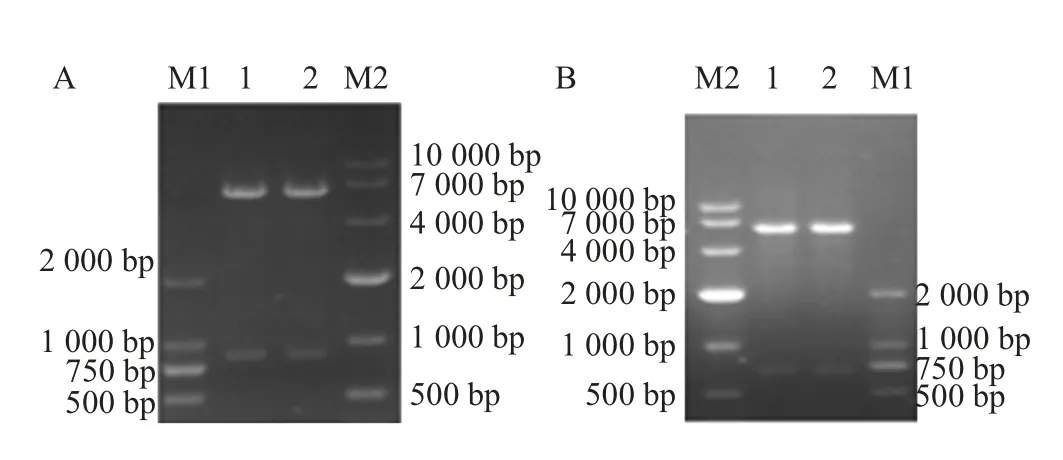
图2 重组质粒pET-Apx IIIA、pET-Apx IVA 的双酶切鉴定Fig.2 Identification of pET-Apx IIIA and pET-Apx IVA positive plasmid construts by enzyme digestions
2.3 免疫后小鼠血清特异性抗体的检测结果 根据方阵滴定法优化的各反应条件,采用间接ELISA 检测小鼠血清各特异性抗体水平。rApxⅠA、rApxⅡA、rApx ⅢA、rApx ⅣA 和rOMP 的最佳包被浓度分别为2.87 μg/mL、2.18 μg/mL、7.68 μg/mL、1.34 μg/mL和1.09 μg/mL,待检血清的最佳稀释度为1 ∶300,羊抗鼠IgG-HRP 的最佳稀释度为1∶5 000,抗体最佳反应条件为37 ℃孵育1 h。结果显示,除Ⅴ组,其它各组小鼠血清中rApxⅠA 抗体呈逐渐上升趋势;Ⅱ组、Ⅲ组和Ⅳ组小鼠血清中所有抗体水平均较高,显著高于Ⅴ组(p<0.05);首免后,Ⅳ组小鼠的rOMP 抗体显著高于其它各组(p<0.05),加强免疫后,其它各免疫组小鼠的rOMP 抗体水平也较高;Ⅱ组和Ⅲ组的所有抗体水平变化趋势基本一致,无显著差异(p>0.05)(图5)。表明本研究中的亚单位疫苗均能够有效刺激小鼠机体产生一定的免疫应答反应,白油佐剂与弗氏佐剂对亚单位疫苗呈现的免疫增强效果无明显差异。
图3 重组蛋白rApx IIIA、rApx IVA 的SDS-PAGE 检测Fig.3 Detection of rApx IIIA and rApx IVA protein by SDS-PAGE

图4 rApx ⅢA、rApx ⅣA 的western blot 鉴定Fig.4 Identification of rApx ⅢA, rApx ⅣA by western blot
2.4 攻毒保护试验 三免7 d 后,用对数生长期的血清Ⅰ型APP 菌液对各组小鼠经腹腔注射攻毒。结果显示,攻毒20 h 后各组小鼠均出现不同程度的死亡,攻毒72 h 后Ⅰ组小鼠存活率为50 % (5/10),Ⅱ组和Ⅲ组小鼠存活率均为40 % (4/10),Ⅳ组小鼠存活率为20 % (2/10);Ⅴ组小鼠攻毒24 h 后全部死亡(图6)。表明本研究的亚单位疫苗对小鼠具有一定的免疫保护效力,但保护力低于PCP 灭活疫苗,推测灭活疫苗中可能含有能够刺激小鼠机体产生免疫应答的其它菌体成分;而PCP 灭活疫苗+ 白油佐剂乳化的亚单位疫苗免疫保护效果不理想,推测可能是受到免疫剂量的影响:该组中灭活疫苗的剂量低于Ⅰ组,菌体成分不能有效刺激小鼠机体产生免疫应答,保护率也低于Ⅰ组;接种亚单位疫苗的剂量低于Ⅲ组,毒素蛋白能够刺激小鼠机体在短期内产生较高的抗体水平但不能使小鼠获得长期保护,最终保护率也低于Ⅲ组。

图5 小鼠血清各特异性抗体检测结果Fig.5 Determination of the serum antibody titers in immunized mice
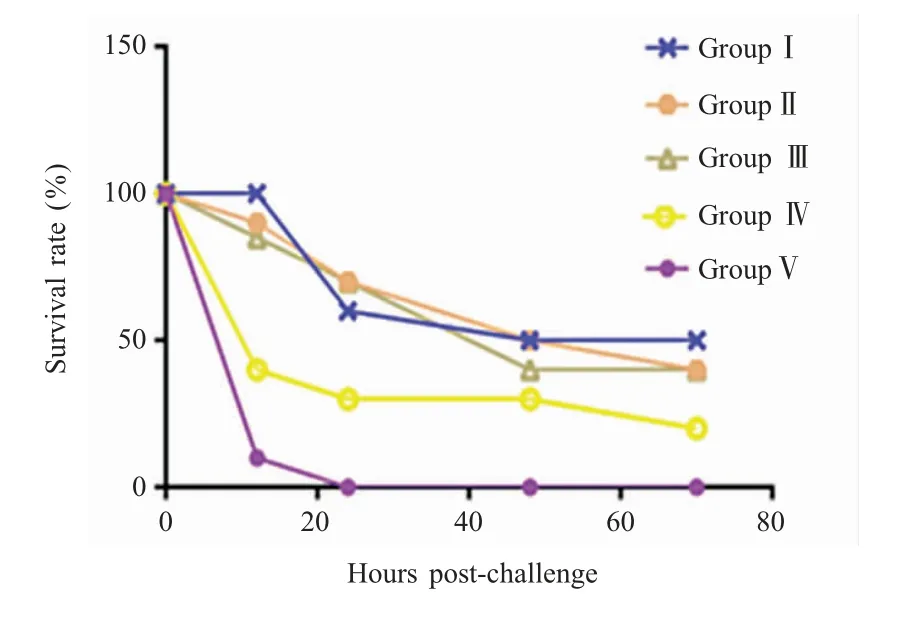
图6 小鼠攻毒后的存活率结果Fig.6 Survival rates of BABL/c mice after challenge
3 讨 论
PCP 是一种严重危害养猪业的呼吸道疾病,其病原APP 血清型较多且各血清型之间缺乏良好的交叉保护,给该疾病的防治带来难题,严重制约了养殖业的发展[14-15]。疫苗接种是预防该疾病最有效的措施,当前市售的主要是PCP 灭活疫苗,但灭活过程中有些抗原成分可能被破坏或丢失并不能达到理想的免疫保护效果。因此,高效多价、成本低廉、安全性强,应用简单的基因工程疫苗展现出良好的发展前景[16]。本研究室曾评估过rApxⅠA、rApxⅡA和rOMP 的保护力,研究表明3 种重组蛋白联合免疫效果优于单因子免疫,本研究在3 种蛋白联合的基础上加入rApx ⅢA 和rApx ⅣA,以期获得一种安全性更高,免疫效果更好的PCP 新型疫苗。
Apx 是APP 的一个非常重要的毒力因子,在APP 的感染过程和刺激机体防御系统功能方面均发挥着重要作用。参考何玉龙等[17]对Apx基因的分析,本研究选取Apx ⅢA、Apx ⅣA 中具有优势抗原表位的片段,并选用具有较多克隆位点的pET-32a(+)原核表达载体,其带有的His 标签为蛋白纯化提供了便利。佐剂也是影响疫苗免疫效果的一个重要因素[18-19],鉴于弗氏佐剂成本过高不适合在生产中应用,本研究设立白油佐剂乳化的亚单位疫苗组,结果表明两种佐剂乳化的亚单位疫苗免疫小鼠后其抗体水平基本一致,攻毒保护率也相同,实际生产中可以用白油佐剂代替弗氏佐剂以节约成本。王春来等经原核表达获得了rApxⅡA,证明其与灭活疫苗联合免疫可以增强灭活疫苗的保护效果[20],本研究设立的PCP 灭活疫苗与亚单位疫苗联合免疫组小鼠抗体水平较灭活疫苗组有一定提升,但保护率低于灭活疫苗组,推测可能是受到免疫剂量、成分配比等因素的影响。
天然菌体成分的提取不仅成本高,而且过程繁琐,以基因工程方法获得的重组亚单位疫苗安全性好,稳定性高,为大规模生产奠定了基础。本研究中灭活疫苗的保护率没有达到100 %,这与王春来等的研究结果一致[20],表明传统的灭活疫苗不能使动物获得完全保护,新型疫苗的研制刻不容缓。Wang 等将rApxⅠA、rApxⅡA、rApx ⅢA、rApx ⅣN和rOMP 联合免疫动物获得较高的抗体水平,证实rApx ⅣN 在增强机体免疫中发挥重要作用[21]。本研究在前期Apx 蛋白研究基础上加入rApx ⅢA 和rApx ⅣA,期望该种组合能够获得更好的免疫保护效果,但最终的保护率还是低于灭活疫苗,推测可能是由于rApx ⅣA 与rApx ⅣN 的作用截然相反,rApx ⅣA 的存在可能抑制了其它抗体的产生,降低了亚单位疫苗整体的免疫效果。Apx Ⅳ毒素是最晚发现的,其致病机理与免疫机制尚不完善,关于Apx Ⅳ毒素的各项研究还需要进一步开展,以便为利用其优势研制高效的PCP 基因工程亚单位疫苗奠定基础。

