泊洛沙姆407修饰吉非替尼脂质体的制备及抗肿瘤活性研究
王洪涛,刘照容,王敬磊,王方,张彦卓
(徐州医科大学,江苏省新药研究与临床药学重点实验室,江苏 徐州 221004)
吉非替尼(gefitinib,GFB)是一种选择性作用于表皮生长因子受体(epidermal growth factor receptor,EGFR)的酪氨酸激酶抑制剂[1-2],可以竞争性地结合EGFR胞内ATP位点,阻断信号传导,抑制肿瘤细胞的繁殖、转移,发挥靶向作用[3]。GFB临床上作为抗晚期非小细胞肺癌治疗的药物,市售制剂为片剂,由于首过效应、P-糖蛋白外排作用,存在生物利用度低、个体差异大、胃肠道不良反应随剂量增加而加重等问题[4-5]。
脂质体是一类将药物包封于类脂质双分子层内形成的微型囊泡体,主要成分为磷脂、胆固醇,具有无毒、无免疫原性、生物相容性好的特点。难溶性药物包埋于脂质双分子层中,有利于提高难溶药物的溶解度[6-7]。脂质体通过吸附、融合、内吞等方式被细胞摄取,实现药物的胞内递送[8-9]。但仅由磷脂、胆固醇形成的脂质体稳定性差、包封率较低,限制了体内外运用。泊洛沙姆407是由聚氧乙烯和聚氧丙烯组成的嵌段聚合物,中间为疏水聚氧丙烯嵌段,两侧为亲水性聚氧乙烯嵌段,具有良好的两亲性,可与生物膜材料良好相容[10],同时对P-糖蛋白介导的药物外排作用有抑制效果[11]。泊洛沙姆407与磷脂形成脂质体时,可增加脂质体的强度,同时作为表面活性剂可提高药物的溶解度[12]。本课题制备泊洛沙姆407修饰的吉非替尼脂质体(GFB-PML),通过泊洛沙姆407的修饰增加药物溶解性、包封率,发挥脂质体的被动靶向与吉非替尼的分子靶向的双重作用,通过细胞毒性实验与小鼠体内肿瘤生长实验考察GFB-PML的肿瘤抑制效果,为吉非替尼的新剂型研究提供参考。
1 材料和方法
1.1 仪器与材料
1.1.1 仪器 RE-2000B旋转蒸发器(上海亚荣生化仪器厂);SH2-CA循环水式多用真空泵(巩义市予华仪器有限公司);SB-5200超声波清洗机(宁波新芝生物科技公司);MS104S/01分析天平(梅特勒-托利多公司);Nicomp 380/ZLS纳米粒度及Zeta电位测定仪(美国PSS公司);FD-1C-50冷冻干燥机(北京博医实验仪器公司);CKX31显微镜(日本奥林巴斯公司);SHZ-82A数显恒温振荡器(金坛区白塔新宝仪器厂);H1850台式高速离心机(湖南湘仪实验室仪器开发有限公司);1260高效液相色谱仪(美国安捷伦公司)。
1.1.2 试药 大豆卵磷脂(上海阿拉丁试剂公司,批号:G1813018);胆固醇(上海阿拉丁试剂公司,批号:G12600);泊洛沙姆407(巴斯夫股份公司,批号:WPW1603B);吉非替尼原料药(南京亚东启天药业有限公司,批号:180420);吉非替尼对照品(南京亚东启天药业有限公司,批号:180309);透析袋(上海源叶生物科技公司,MCWO 8000-14000);超滤管(北京拜尔迪生物技术有限公司,MWCO 10K);噻唑蓝(MTT)细胞增殖及细胞毒性检测试剂盒(凯基生物技术股份有限公司,批号:20180413);香豆素-6(北京百灵威科技有限公司,批号:LPC0R06);赫斯特荧光染料33342(上海阿拉丁试剂公司,批号:11318001);罗丹明标记鬼笔环肽(翎盛科技有限公司,批号:T03598);乙腈、乙酸铵为色谱纯;其他试剂均为国产分析纯。
1.1.3 细胞及动物 人肺癌细胞A549、小鼠肝癌细胞H22购于中国科学院上海细胞库;昆明小鼠,雌性,体重(20±5)g,购于徐州医科大学动物实验中心,生产许可证号:SYXK(苏)2010-0011,常规饲养1周后进行造模。
1.2 方法
1.2.1 GFB-PML的制备 采用薄膜分散-水化法制备GFB-PML。即称取磷脂20 mg、胆固醇6 mg、泊洛沙姆407 10 mg、GFB 5 mg,置于100 mL茄形瓶中,加入30 mL无水乙醇超声溶解。50 ℃下旋转蒸发除去乙醇,待形成薄膜后,加入5 mL pH 7.4磷酸盐缓冲液,超声水化,得到脂质体混悬液。将脂质体混悬液过0.45 μm微孔滤膜,即得GFB-PML溶液。空白泊洛沙姆修饰脂质体(PML)处方中不含GFB,其他制备过程保持一致。将GFB-PML溶液转移至培养皿中,-20 ℃预冻12 h后,于冷冻干燥机内冻干24 h,得GFB-PML冻干粉。
1.2.2 GFB-PML内药物的测定
1.2.2.1 色谱条件 色谱柱为Agilent TC-C18柱(4.66 mm×250 mm,5 μm),流动相为乙腈-乙酸铵水溶液(51∶49,乙酸铵浓度为0.01 mol·L-1),流速为1 mL·min-1,柱温35 ℃,紫外检测波长247 nm,进样量20 μL。
1.2.2.2 GFB标准曲线的制备 精密称取GFB对照品10.00 mg,溶于100 mL乙腈中,配成100 μg·mL-1的GFB储备液。分别吸取上述溶液适量,乙腈稀释至终浓度为0.05、0.1、0.5、1、5、10、50 μg·mL-1的溶液。高效液相色谱仪进样,记录峰面积。
1.2.2.3 精密度试验 分别配制0.1、1、50 μg·mL-1的GFB溶液,于同一天内重复测定5次,计算日内相对标准偏差。重复测定3 d,计算日间相对标准偏差。
1.2.2.4 回收率试验 取9份1 mL制备的PML溶液,加至25 mL容量瓶内,分别加入适量“1.2.2.2”项下GFB储备液,每组3份,乙腈定容至刻度线,制成低、中、高(0.2、2.0、10.0 μg·mL-1)浓度的供试品溶液。进液相测定峰面积,与同浓度GFB标准溶液测定峰面积进行比较,计算回收率。
1.2.3 GFB-PML的质量研究
1.2.3.1 粒径和Zeta电位的测定 吸取适量制备的GFB-PML溶液,用去离子水稀释数倍并超声分散,用Nicomp380/ZLS型纳米粒度与Zeta电位测定仪测定粒径、PDI值、Zeta电位,重复测定3次。
1.2.3.2 GFB-PML载药量与包封率的测定 称取10 mg GFB-PML冻干粉,记录质量m1。加5 mL乙腈超声20 min破乳,转移至25 mL容量瓶并定容,过0.45 μm微孔滤膜后按“1.2.2.1”项下色谱条件进行液相检测,记录峰面积,对应浓度为C0。按以下公式计算载药量:载药量(%)=(25C0×10-3/m1)×100%。吸取500 μL GFB-PML溶液,加至超滤管中,9 500 rpm离心30 min,吸取滤过液,按“1.2.2.1”项下色谱条件进行液相检测,记录峰面积,对应游离浓度C1。同时吸取500 μL GFB-PML溶液加至25 mL容量瓶中,加乙腈定容,进样并计算总浓度C2。按以下计算包封率:包封率(%)=(1-C1/50C2)×100%。
1.2.3.3 形态学观察 将制备的GFB-PML混悬液用适量纯化水稀释,滴于铜网上,自然晾干,醋酸铀负染后,进行透射电镜拍摄,观察形态。
1.2.3.4 体外释放度实验 称取10 mg GFB-PML冻干粉,记录质量m2,5 mL释放介质(PBS7.4磷酸盐缓冲液,含30%甲醇,V/V)溶解,转移至透析袋中,置于含95 mL释放介质的烧杯内,于37 ℃,100 rpm恒温振荡器内振摇,平行3组。同时称取GFB原料药,甲醇溶解后转移至透析袋内,相同释放介质进行释放。平行3组。分别于第0.5、1、2、4、6、8、12、24、36、48 h从各烧杯内取样5 mL,同时补充相同体积的释放介质,样品经0.45 μm微孔滤膜滤过后,按“1.2.2.1”项下色谱条件进行浓度检测,根据下式计算累积释放率:累积释放率(%)=(100×Cn+5×∑n-1Cn-1)×10-3/m2×100%,Cn为第n次取样样品浓度。以时间为横坐标,GFB的累积释放率为纵坐标,绘制释放曲线。
1.2.4 细胞实验
1.2.4.1 细胞培养 将A549细胞接种于含完全培养基(含10%胎牛血清,1%双抗的DMEM培养基)的培养瓶内,于37 ℃、5%CO2的培养箱内培养,待瓶内细胞数量达80%~90%时可进行传代。弃去细胞瓶内培养基,生理盐水清洗后加入1.5 mL胰酶,消化3 min后加入等体积完全培养基终止消化。将细胞转移至离心管内,800 rpm离心3 min,弃去上清,加入完全培养基吹打均匀后吸取部分转移至培养瓶内,放回培养箱中培养。
1.2.4.2 细胞摄取 按“1.2.1”项下GFB-PML制备方法,将GFB替换成香豆素-6溶液0.2 mL(0.5 mg·mL-1)制备载香豆素-6的荧光脂质体(C6-PML)。取对数生长期的A549细胞,消化离心后,弃去上层液体,加入新DMEM培养基,计数,以每孔2×104个细胞接种于24孔板,培养箱内培养24 h。吸去培养基后,按C6-PML终浓度为50、200、500、1 000 μg·mL-1将C6-PML培养基溶液加入孔内,培养4 h;吸取500 μg·mL-1C6-PML培养基溶液加入孔内,培养0.5、2、4 h,摄取结束后弃去培养基;生理盐水清洗3次后,加入500 μL 4%多聚甲醛溶液固定10 min;生理盐水清洗3次,再加入200 μL赫斯特染料,孵育10 min,继续清洗3次。于倒置荧光显微镜观察摄取情况并拍照。
1.2.4.3 细胞毒性评价 取对数生长期A549细胞置于96孔板内,密度为每孔1×104个。24 h后弃掉原有培养基,更换为无血清DMEM培养基。按照培养基内PML终浓度为20、50、100、200、300、400、500、1 000 μg·mL-1加入配置好的PML溶液,每个浓度6个复孔,每孔100 μL。加样后培养箱内继续培养24 h;24 h后每孔加入50 μL MTT溶液(2 mg·mL-1),继续放回培养箱孵育4 h;4 h后吸出上清液,每孔加入150 μL二甲基亚砜,置于平板摇床100 rpm摇动10 min,酶标仪492 nm波长处检测吸光度值(OD值)。按以下公式计算:细胞存活率(%)=(OD实验-OD阴性对照)/(OD阳性对照-OD阴性对照)×100%,阳性对照组为不加药物的含细胞组,阴性对照组为仅加二甲基亚砜的无细胞组。同时,按照培养基内GFB终浓度为0.01、0.05、0.1、0.5、1、5、20 μg·mL-1加入GFB原料药和GFB-PML,培养24 h后检测吸光度值并计算细胞存活率。
1.2.5 体内抗肿瘤研究 取2只雌性昆明小鼠腹腔接种小鼠肝癌细胞(H22细胞)悬液,约7 d形成腹水模型。抽取腹水,于离心管内加等量生理盐水,1 000 rpm离心3 min,弃上清后,生理盐水分散并计数。细胞浓度调整到每毫升2×107个细胞后,于小鼠腹部右下侧皮下接种0.2 mL细胞悬液,待瘤体生长到约800 mm3时开始给药。32只雌性荷瘤小鼠随机分为4组,每组8只,分为生理盐水组,PML组,GFB组,GFB-PML组,尾静脉给药,GFB剂量为6 mg·kg-1,每两天给药1次共给药4次,给药后1 d游标卡尺测量瘤径(长径D,短径d,mm)。按以下公式计算瘤体积V(mm3)=0.5×D×d2,绘制肿瘤体积曲线。给药结束后解剖瘤块,称重,并按公式计算抑瘤率:抑瘤率=(生理盐水组平均瘤重-给药组平均瘤重)/生理盐水组平均瘤重×100%。
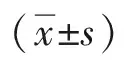
2 结果
2.1 GFB-PML的质量研究
2.1.1 GFB标准曲线、精密度、回收率结果 GFB的线性回归方程为A=72.575C+3.961 5,r=1,表明在0.05~50 μg·mL-1范围内峰面积与浓度线性良好。低、中、高3个浓度下,测得日内精密度RSD分别为0.45%、0.27%、0.19%(n=5);日间精密度RSD分别为0.81%、0.84%、1.08%(n=3),均小于3%,表明该液相方法适合本品测定。低、中、高浓度GFB回收率为101.49%、98.12%、100.88%(n=3),RSD均小于3%,表明回收率符合要求。
GFB-PML粒径分布结果及电位测定如下:平均粒径为(190.00 ± 8.77)nm,PDI值为0.31±0.04,Zeta电位为(-15.07±6.11)mV。载药量测定结果为5.09%±0.48%,包封率测定结果为99.53%±0.34%。
制备的GFB-PML透射电镜结果如图1。透射电镜观察可见GFB-PML呈球状或类球状,粒径集中在50~100 nm。

图1 GFB-PML的透射电镜图
2.2 体外模拟释放结果 以释放时间为横坐标,GFB累积释放百分率为纵坐标,绘制释放曲线,结果见图2。其中A代表GFB原料药组累积释放率,B代表GFB-PML组中GFB累积释放率。GFB原料药组2 h时GFB累计释放率为59.83%,8 h累积释放率接近100%,释放迅速。GFB-PML组2 h时GFB累计释放率为21.62%,释放相对于原料药组较为缓慢,这是由于GFB-PML有较高的包封率,药物GFB无法迅速透过双分子层进入释放介质中;GFB-PML组24 h时GFB累计释放率接近80%,至48 h仍持续释放,缓释效果明显。

图2 GFB(A)与GFB-PML(B)体外模拟释放曲线(n=3)注:与GFB-PML组比较,*P<0.05,**P<0.01
2.3 GFB-PML对A549细胞摄取与毒性影响 摄取结果见图3~4。绿色荧光为细胞摄取C6-PML后显示的荧光,蓝色荧光为细胞核染色后显示的荧光,红色荧光为细胞骨架染色后显示的荧光。绿色荧光越强,表明细胞摄取越多C6-PML。荧光在细胞质内均有分布,图3显示,在相同浓度下(500 μg·mL-1),随摄取时间增加,绿色荧光强度增强,表明细胞摄取更多C6-PML,细胞对脂质体的摄取呈时间依赖性;图4显示,在相同摄取时间下(4 h),C6-PML浓度越高,绿色荧光强度增强,摄取呈浓度依赖性。由此可以看出,细胞对GFB-PML的摄取呈现出时间和浓度双重依赖性。

图3 不同摄取时间下C6-PML在A549细胞内摄取情况(比例尺为20 μm)
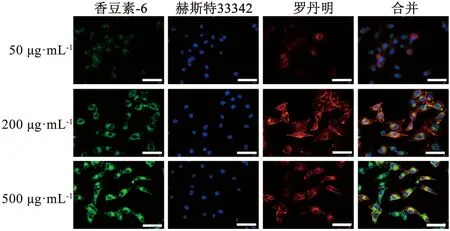
图4 不同浓度C6-PML在A549细胞内摄取情况(比例尺为20 μm)
细胞毒性结果如图5~6。图5为PML作用于A549细胞毒性结果,PML在高达1 000 μg·mL-1时对细胞几乎无毒性,表明PML安全性好,细胞顺应性高。图6为GFB和GFB-PML对A549细胞毒性结果,在低浓度下(0.01 ~ 1 μg·mL-1),GFB原料药组对细胞毒性不明显,说明游离原料药入胞能力较差,在低浓度时对细胞抑制作用较小;GFB-PML组显示出较高的细胞杀伤性,细胞存活率显著低于GFB组(P<0.05),表明GFB-PML能携带GFB入胞,增加了GFB对A549细胞的杀伤性。同时在较高浓度下GFB-PML组细胞存活率低于GFB组(P<0.05),结合GFB-PML体外释放结果,可看出GFB-PML能延长GFB在细胞内作用时间,增加细胞对GFB的摄取,进而提高GFB对A549细胞抑制效果。
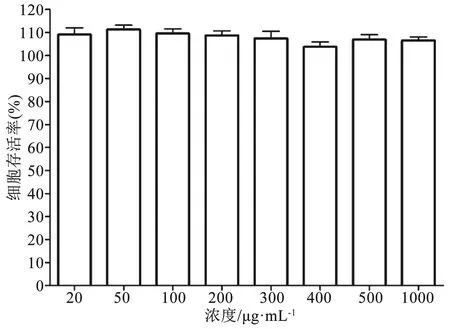
图5 PML对A549细胞毒性结果(n=6)

图6 GFB(A)与GFB-PML(B)对A549细胞毒性结果(n=6)注:两组间比较,*P<0.05
2.4 GFB-PML对小鼠肿瘤生长的影响 H22荷瘤小鼠肿瘤生长趋势如图7,各组小鼠肿瘤体积均随给药时间而增长,第0至第2天肿瘤生长较为缓慢。从第4 天开始,生理盐水组与PML组肿瘤体积增长较快,两组体积无统计学差异(P>0.05)。GFB组第4、6、8 d与生理盐水组相比,肿瘤体积大小有所降低,两组体积无统计学差异(P=0.881、0.443、0.224)。GFB-PML组与生理盐水组对比,3次测量的肿瘤体积均降低,有统计学差异(P=0.028、0.024、0.009),对肿瘤生长有较强抑制作用。小鼠处死后解剖瘤体,生理盐水组瘤重为(6.83 ± 0.87)g,PML组瘤重为(5.85±1.88)g,与生理盐水组相比,无统计学差异(P=0.973);GFB组瘤重为(4.28±1.72)g,与生理盐水组相比,有统计学差异(P=0.016);GFB-Lip组瘤重为(3.64±2.00)g,与生理盐水组相比,有统计学差异(P=0.001)。GFB组抑瘤率为37.34%,GFB-PML组抑瘤率为46.71%。可以看出,GFB-PML能增强GFB抑制肿瘤生长的效果。
图7 H22荷瘤小鼠肿瘤生长曲线(n=8)注:与生理盐水组对比,*P<0.05,**P<0.01
3 讨论
传统磷脂、胆固醇通过薄膜分散法制备的脂质体包封率较低,包封率值为50%~80%[13];本文利用泊洛沙姆407修饰脂质体,包封率明显提高。相比于泊洛沙姆188,有研究显示随泊洛沙姆188含量增加,包封率值没有显著性改变[14],显示出泊洛沙姆407应用于脂质体载药时具有提高包封率的优势。制备的脂质体于4 ℃冰箱放置12 h,没有出现沉降现象,稳定性较好。
制备的GFB-PML在粒径测定时由于浓度较大,脂质体之间出现了重叠,而纳米粒度测定仪难以分辨,造成测定粒径结果较透射电镜观察结果偏大。体外释放实验中,我们选择磷酸盐缓冲液作为释放介质,但由于GFB在中性pH值的磷酸盐缓冲液中几乎不溶,所以加入30%(V/V)的甲醇溶液,增加GFB在介质中的溶解度[15]。由于本实验制备的GFB-PML包封率高,能有效降低突释现象,发挥缓释效果。体外细胞摄取实验从时间和浓度两方面说明细胞对脂质体的摄取有时间和剂量依赖性。细胞毒性实验中,相同浓度下GFB-PML比GFB原料药对A549细胞杀伤性更强,可理解为GFB-PML增加了GFB穿过细胞膜的能力,运载GFB进入细胞内并作用于ATP位点,阻断信号传导,从而抑制A549细胞的繁殖、转移[16]。
有研究以100 mg·kg-1剂量的吉非替尼灌胃方式考察吉非替尼对肝癌H22小鼠的肿瘤作用[17]。本文建立了H22小鼠肝癌腹水肿瘤模型,进行了GFB-PML对肝癌H22小鼠肿瘤生长抑制实验,以6 mg·kg-1的给药剂量,尾静脉注射方式给药,考察GFB-PML的肿瘤抑制效果。结果可见,制备的GFB-PML对小鼠肿瘤生长有较强的抑制作用,增强了GFB的抗肿瘤效果。同时对比大剂量灌胃方式,低剂量注射给药也显现出较显著的抑瘤效果,为吉非替尼拓展新剂型应用奠定基础。

