树状大分子作为基因递送载体的研究进展
胡正霞,何东升,涂家生
(中国药科大学药学院,江苏 南京 210009)
基因治疗是指通过基因转移技术将外源治疗基因导入病变的靶细胞中,调控目的基因的表达,实现纠正或补偿缺陷基因,关闭或抑制异常表达的基因,恢复组织或器官的正常功能,从而达到治疗目的。基因治疗需要将治疗基因有效地递送至靶细胞内,因此其关键在于高效、安全的基因载体[1]。
目前常用的基因载体主要有病毒载体(viral vector)和非病毒载体(non-viral vector)。尽管病毒载体具有较高的转基因效率,但因其自身潜在的免疫原性、载体容量小、不易于工业化大规模生产、制备复杂及成本昂贵等,限制了病毒载体的应用。与病毒载体相比,非病毒载体基因递送效率相对较低,但有望克服病毒载体的一些局限性,具有低细胞毒性、低免疫原性、易于大规模生产的优势,但在临床应用上仍存在许多待解决的难题。理想的非病毒基因载体应当:①与核酸形成稳定性好且粒径合适的复合物,免受核酸酶的降解和机体免疫系统的清除;②具有表面保护功能域,避免与血浆蛋白相互作用,介导有效且有选择性地细胞摄取;③有效地从细胞内涵体、溶酶体逃逸;④细胞内定位[2]。
常见的非病毒基因载体主要包括阳离子脂质体(cationic liposome)、阳离子聚合物(cationic polymer,如树状大分子、多聚赖氨酸、聚乙烯亚胺等)、肽类和无机纳米粒子等。其中,树状大分子(dendrimer)因其结构精确、高度枝化、具有三维球形结构而备受关注。
1 树状大分子
“Dendrimer”一词源于希腊语“dendron”(树)和“meros”(部分),最初由Vögtle课题组在20世纪70年代末报道,此后由Tomalia、Newkome和其他研究者进一步发展,产生了多样的树枝状结构[3]。树状大分子由中心核(core)、中间重复单元(interior)和末端基团(exterior)3部分构成,具有高度的几何对称性[4]。阳离子树状大分子,如聚酰胺-胺树状大分子(PAMAM)、聚(丙烯亚胺)树状大分子(PPI)、聚(L-赖氨酸)树状大分子(PLL)、三嗪树状大分子、碳硅烷树状大分子、聚(亚胺)树状大分子(PETIM)、含磷树状大分子和紫腈树状大分子[5],因具有良好的单分散性、可控的分子结构、高密度且数目精确的多个表面功能基团,已经成为核酸递送的重要载体。阳离子树状大分子通过静电作用与核酸结合形成复合物,保护核酸免受降解,并帮助细胞内化作用[3]。阳离子树状大分子的基因转染效率较强,自身具有一定的“质子海绵效应”,可实验细胞内涵体、溶酶体逃逸。但研究表明,树状大分子的细胞毒性随其分子量和电荷密度的增加而增大,即代数越高,分子量越大,转染能力较强,但其细胞毒性也随之增加。因此,在阳离子树状大分子用于基因递送方面,维持高转染效率的同时降低细胞毒性至关重要[6]。
2 树状大分子的基因递送策略
基于早期对树状大分子代数(G1~G10)、种类(如PAMAM、PPI、聚赖氨酸)的研究,目前的研究集中于表面功能基团[5]、中心核[7]、树状大分子结构的修饰和低代树状大分子的组装[6],以克服基因递送过程中的多重障碍,同时增加其生物相容性。
2.1 表面功能基团的修饰 树状大分子外周的多种功能基团为其表面修饰提供了理想的位点,研究人员使用了包括氨基酸、多肽、蛋白质、脂质、氟化物、糖类、聚合物和纳米粒等功能基团对树枝状大分子进行修饰[5]。这些修饰的主要目的是调节树状大分子表面电荷和疏水性。适量的表面电荷密度有助于复合物的形成、细胞摄取和内涵体逃逸,但过量的正电荷会造成严重的细胞毒性。为了降低细胞毒性,可通过引入屏蔽基团以降低表面电荷密度。
Fant等[8]研究了一系列PEG化和乙酰化的PAMAM树状大分子,结果表明,树状大分子的PEG化明显降低了自身的细胞毒性,并且增加了血液循环时间。然而,PEG化或乙酰化的程度与转染效率直接相关。较高程度的PEG化减少了表面电荷,可能会降低核酸的压缩能力、细胞摄取和转染效率。
Choi等[9]将L-精氨酸和L-赖氨酸分别连接到PAMAM树状大分子表面,与未修饰的树状大分子相比,L-精氨酸修饰PAMAM树状大分子具有更好的DNA的压缩、复合能力和更高的转染效率。Yu等[10]在G4.0 PAMAM树状大分子外周修饰带有咪唑基团的组氨酸和精氨酸,咪唑基团在内涵体、溶酶体的pH条件下能够质子化,显著提高了树状大分子的质子缓冲能力,促进了复合物从内涵体的逃逸,在多个细胞系中都表现出了较好的转染效率。相似地,通过胍基[11]、咪唑基团[12]、多胺[13]、PEI聚合物[14]的修饰,树枝状大分子的转染效率能够显著增加。
树状大分子表面修饰的另一个重要作用是赋予载体多种功能,如进行核酸的靶向递送,即通过在树状大分子结构上引入靶头以实现靶向作用,如生物素、叶酸、多肽(如靶向整合素受体的RGD多肽,脑靶向的RVG29肽、angiopeptide和T7肽,以及肿瘤酸性靶向的低pH插入肽(pHLIP)、蛋白质(如转铁蛋白)、糖类(如乳糖、半乳糖)[2]。此外,选择不同种类的多肽或者糖类修饰树状大分子,能够制备不同功能的载体。Arima等[15]在PAMAM树状大分子表面分别连接α、β和 γ 环糊精,显著提高了细胞的转染效率,这可能与提高与细胞膜的亲和能力,改变pDNA的细胞内转运有关。环糊精-PAMAM树状大分子连接靶向多糖在基因递送中能够产生协同作用。多肽修饰方面,细胞穿膜肽能够增强细胞摄取,例如TAT和R9[2];核定位信号多肽能够介导细胞核的进入,如SV40大T抗原的核定位信号[16]。这一类多肽修饰PAMAM树状大分子有助于增强细胞的内吞作用[2]。
树状大分子的表面修饰也包括用纳米粒(如碳纳米管、石墨烯、量子点)和其他功能性配体(如光敏剂)修饰[5],这些经过表面修饰的树状大分子在基因的体内外递送中都具有可观的应用前景。
2.2 中心核的修饰 树状大分子的中心核直接影响外周功能基团的数目、分子大小、形状和整体结构,更重要的是影响树状大分子的柔韧性和强度[17]。在核酸的递送过程中,将核酸有效压缩成稳定的复合物是关键,因此,树状大分子的柔性至关重要。改变中心核的分支单元可以调节树状大分子柔性。Zhang等[18]以三甲基-1,3,5-苯三甲酸、季戊四醇和肌醇为中心核合成的一系列不同代数的PAMAM树状大分子分别往三、四、六个方向生长(见图1),在这些树状大分子中,柔性最好的是以三甲酸酯为核心的六代树状大分子,在体外表现出最好的DNA压缩能力和最高的转染效率。

图1 以三甲基-1,3,5-苯三甲酸(A)、季戊四醇(B)和肌醇(C)为核心的G3.0树状大分子[18]
通过不同的方式对中心核进行修饰可调节树状大分子的疏水性。Chang等[19]系统地比较了以乙二胺、己二胺和二氨基十二烷为中心核的PAMAM树状大分子在基因递送中的作用,结果表明,以二氨基十二烷为中心核的PAMAM树状大分子在保持传统PAMAM树状大分子固有的DNA压缩能力、生物相容性、内涵体逃逸能力的同时,具有最高的转染效率和最低的细胞毒性。引入疏水烷基链作为中心核促进了载体/基因复合物的内化作用,增加了复合物的细胞摄取。
树状大分子的表面修饰能够使其具备多种功能,中心核的调节也能够产生新功能。早期的表面修饰策略,如引入光敏剂、环糊精和PEG已经被用于修饰树状大分子的中心核。Ma等[20]以卟啉为中心核,合成了表面功能化的聚(L-赖氨酸)树状大分子(见图2),卟啉本身即作为光敏剂,这种光化学内化效应使其在不同细胞系中都呈现出光响应的基因表达。Liang等[21]合成了以β-环糊精为中心核的PAMAM树状大分子(见图3),在基因递送过程中呈现出良好的生物相容性、相对较高的转染效率。树状大分子核心的环糊精改善了树状大分子-基因复合物的血清稳定性,并降低了对转染细胞的毒性。Albertazzi等[22]以PEG为核心,分别合成了两分支、四分支不同代数的树状大分子,四分支的树状大分子较两分支具有更好的DNA复合能力和更高的转染效率,此外以PEG为核心的树状大分子对转染细胞均具有很低的毒性。
2.3 低代树状大分子的组装 基于高代树状大分子虽具有高转染效率但细胞毒性大,低代树状大分子尽管细胞毒性小但转染效率低的现状,研究者们提出了将低代树状大分子组装成带一定正电荷的纳米结构,形成稳定复合物和响应性分解的策略,以实现有效转染的同时降低细胞毒性[6]。
低代树状大分子可以通过超分子策略制备成纳米结构,在水溶液中通过离子作用、氢键、疏水作用、亲氟作用,树状大分子间相互连接。Liu等[23]在二代PAMAM树状大分子表面修饰一定数量的苯基硼酸,苯基硼酸与伯胺基通过离子相互作用,形成粒径约100 nm的纳米颗粒(见图4)。该纳米结构较G5.0树状大分子具有更好的DNA和siRNA递送效率,且与Lipofectamine 2000相当。更重要的是在酸性条件下,其能够快速解体为低代树状大分子,因而对转染细胞的毒性低。当低分子量的树枝与脂肪链通过点击化学、原位合成或主客体相互作用共价结合后,生成的两亲性聚合物通过疏水作用能够自组装成纳米结构。分子中脂肪链决定纳米结构的树枝数目、粒径和电荷密度,而树枝则与DNA的结合和内涵体逃逸能力相关。Yu等[24]将十八碳的疏水脂肪链通过点击化学反应与亲水的PAMAM低代树枝共价连接,形成两亲性树状大分子(见图5),用于递送Hsp27 siRNA,在去势抵抗性前列腺癌模型中具有显著的基因沉默和抗癌活性。脂肪链的数目、长度和饱和度均会影响DNA的压缩能力和载体基因复合物的粒径。除了脂肪链,疏水性的胆固醇与低分子量的树枝结合也能生成两亲性的聚合物用于基因递送。胆固醇的耐受性良好,Jones等[25]合成了以胆固醇为核心、末端为精胺的树枝,能够自组装成纳米结构,通过胆固醇与细胞膜磷脂的相互作用扰乱内涵体膜,促进复合物的内涵体逃逸。
脂肪链和胆固醇修饰的树枝或树状大分子在水溶液中稳定性良好,但当其穿过细胞膜后,会因细胞膜磷脂的影响导致稳定性下降。因此,有研究者提出用氟代烷基链取代超分子两亲性化合物中的脂肪链或胆固醇。氟代烷基链疏水且疏脂,碳氟链在亲水和疏水的环境中通过亲氟效应相互结合。Wang等[26]用七氟丁酸对G1.0和G2.0 PAMAM树状大分子进行修饰,组装成与病毒大小相似的纳米颗粒。通过调整表面七氟丁酸的数目以控制整体结构,增加七氟丁酸数目,就能在极低N/P比下实现高转染效率,最有效的结构自组装在20 ng超低DNA剂量下就能实现细胞的高转染效率,即使在50%血清存在下也能维持高效转染,且实验结果证明能够有效转染3D球和实体瘤。氟原子的引入使得较短碳链就能够与12~18碳的脂肪链产生相同的基因递送效率,此外,碳氟链通过“氟效应”(增加血清抗性、细胞摄取、内涵体逃逸和有利于细胞内的DNA释放)提高了阳离子聚合物的转染效率[6]。

图2 以卟啉为中心核的树状大分子[20]

图3 以β-环糊精为中心核的PAMAM树状大分子[21]
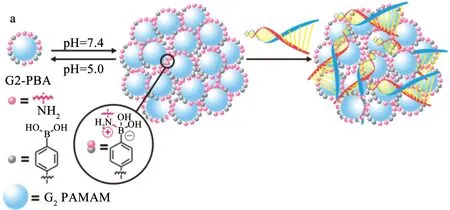
图4 G2.0 PAMAM树状大分子表面修饰苯基硼酸后形成pH敏感的纳米簇[23]

图5 疏水部分为十八碳烷基链,亲水部分为G3.0 PAMAM树枝的两亲性树状大分子[24]
低代树状大分子通过刺激响应型化学键与生物相容性的纳米粒、蛋白质或聚合物连接,暂时生成具有相对高电荷密度的杂交材料,实现高效且无毒的基因递送。Xu等[27]将以硫辛酸为核心的低代多肽树枝通过共价键连接到无机纳米粒子量子点表面,生成多功能的超分子杂交树状大分子,其基因转染效率约为单个多肽树枝的50 000倍。树枝与无机纳米粒通过Au-S键连接,细胞内吞后在胞内谷胱甘肽作用下,化学键断裂,因而在基因转染过程中呈现较低的细胞毒性。无机纳米粒(金、氧化铁、量子点等)的引入赋予杂交基因载体新功能,如金纳米粒可用于X射线计算机断层扫描或组合光热治疗,氧化铁纳米粒可用于磁共振成像,量子点可用于荧光成像[6]。
低分子量的树状大分子通过共价键交联形成更大的纳米簇能够改善基因转染。Liu等[28]将G2.0 PAMAM树状大分子通过二硫键彼此交联,该纳米结构能够将DNA压缩形成约200 nm的复合物,细胞摄取后二硫键断裂分解成彼此独立的G2.0树状大分子,具有较高的基因转染效率和较低的细胞毒性。Jia等[29]将苯基硼酸修饰的低分子量超支化低聚乙烯亚胺通过硼酸-二醇键与富含1,3-二醇的超支化聚甘油反应,生成相对高电荷密度的动态可逆纳米簇(见图6)。与低分子量的低聚乙烯亚胺相比,该纳米簇与siRNA的亲和力强,在溶酶体酸性环境中分解,细胞毒性小。除此之外,超支化的聚甘油疏水内部可用于载抗癌药物如阿霉素,用于癌症的协同治疗。
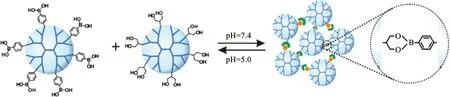
图6 通过低分子量超支化聚合物表面官能团的共价键连接,自组装成pH敏感的纳米簇[6]
3 结语
应用树状大分子作为基因载体的研究已经长达数十年,尽管有商品化的基因转染试剂SuperfectTM和 PrioFectTM,但其在临床应用上依然面临重重困难。高代数的树状大分子虽然转染效率较高,但价格昂贵且细胞毒性大,因此构建高转染效率、低细胞毒性的树状大分子是进一步拓展其应用的关键。研究者们通过对树状大分子的外周官能团修饰、中心核修饰和低代树状大分子的组装等,已经取得了很多突破性的进展,为临床应用的实现奠定了基础。

