探针底物法评价柚皮苷对大鼠肝脏CYP3A1/2酶代谢活性的影响
程可羚,吴灏,白杨,樊威洋,苏薇薇,李沛波
(中山大学生命科学学院,广东 广州 510275)
细胞色素P450(CYP450)酶是肝脏和肠中最为重要的Ⅰ相代谢酶,可催化大多数临床药物代谢;药物对CYP450酶活性的诱导或抑制是引发药物相互作用的常见机制[1]。目前,超过90%的治疗药物被认为主要是由CYP 3A4/5、2D6、2C9、2C19、2E1、1A2等亚型酶所代谢的[2-4]。其中,CYP3A4是非常重要的亚型酶之一,参与了约50%的上市药物的代谢清除[5]。
柚皮苷为二氢黄酮苷类化合物,骨架结构由5,7,4′-三羟基-二氢黄酮苷元(柚皮素)与芸香糖[2-O-(α-L-鼠李糖)-β-D-葡萄糖]构成。柚皮苷广泛存在于芸香科植物葡萄柚、桔、橙等水果植物及化橘红、骨碎补、枳实、枳壳、橘红、菝葜、枸橼等中药材中;日常食用的橙汁及葡萄柚汁也普遍含有柚皮苷[6-7]。目前,关于柚皮苷对CYP3A 酶代谢活性的影响,有关文献报道说法不一。如,Bailey等[8]以12位健康男性为研究对象,研究柚皮苷对尼索地平口服药代动力学的影响,结果表明,柚皮苷不会影响尼索地平口服药代动力学过程;Edwards等[9]用睾酮作为CYP3A的探针底物,采用大鼠肝微粒体体外研究体系研究了葡萄柚汁、鲜榨酸橙汁和柚皮苷对CYP3A的抑制作用,结果表明,葡萄柚汁抑制CYP3A活性的主要成分不是柚皮苷和柚皮素;Bailey等[10]以12位健康男性为研究对象,研究柚皮苷对非洛地平代谢的影响,结果表明,柚皮苷不是葡萄柚汁与非洛地平发生代谢性相互作用的主要活性物质;Ho等[11]的研究表明,柚皮苷和柚皮素对人肝微粒体CYP3A4有较弱的抑制作用;Kim等[12]的研究表明,柚皮苷可能通过抑制CYP3A的活性而减少维拉帕米在家兔体内的代谢;Choi等[13]的研究表明,柚皮苷可能通过抑制CYP3A和 P-gp而提高他莫西芬在大鼠体内的生物利用度。可见,明确柚皮苷是否会通过影响CYP3A4的代谢活性而与其他药物产生相互作用,是十分必要的。体内探针底物法是研究CYP450亚型酶活性的重要方法之一,该法通过给予实验动物CYP450 酶的特异性底物(探针底物),通过考察药物或者其他外源性物质对探针底物的主要药动学参数的影响,间接反映药物或者其他外源性物质对CYP450 酶活性的诱导或抑制效应[14-15]。
CYP3A4酶的底物众多,据统计约有150多种药物,其中,咪达唑仑是美国FDA推荐的常用探针药物。在大鼠体内,CYP3A1/2与人CYP3A4功能相当[16],且有着相同的探针底物[15]。因此,本实验采用体内探针底物法,以咪达唑仑为底物,评价柚皮苷连续7 d给药后对大鼠肝脏CYP3A1/2活性的影响,为柚皮苷临床安全合理用药提供参考。
1 材料
1.1 试药 咪达唑仑(纯度99.9%,批号:171250-201002,中国食品药品检定研究院);皮质酮(纯度98.73%,批号:2750129,德国Calbiochem公司);甲醇(HPLC级,批号:AH230-4,美国Honeywell B&J公司);乙腈(HPLC级,批号:AH015-4,美国Honeywell B&J公司);甲酸(LC-MS级,批号:2017011811A,广州飞恩新材料科技公司);肝素钠(185 USP U·mg-1,上海阿拉丁);柚皮苷(纯度为98.4%,由本团队委托广东环球制药有限公司生产,批号:160901)。
1.2 仪器 1200SL HPLC-6410 Triple Quad 液相色谱-质谱联用仪(美国Agilent公司);Centrifuge 5430R 台式高速冷冻离心机(德国Eppendorf公司);Vortex-Genie 2 涡旋振荡器(美国Scientific Industries公司);MS105DU 电子分析天平(美国 Mettler Toledo公司);Arium mini 超纯水系统(德国Sartorius公司);精密移液器(美国Rainin公司)。
1.3 实验动物 SPF级雄性SD大鼠,体重(250±20)g,动物生产许可证号为SCXK(粤)2013-0002。饲养于中山大学生命科学学院时珍堂,实验动物使用许可证号为SYXK(粤)2014-0020。
2 方法
2.1 溶液与试药配制
2.1.1 咪达唑仑对照品储备液的配制 精密称定咪达唑仑对照品10 mg,置于10 mL棕色容量瓶中,用甲醇溶解后,加甲醇至刻度线,配制成1 mg·mL-1的对照品储备液。
2.1.2 皮质酮(内标)对照品储备液和内标工作液的配制 精密称定皮质酮对照品10 mg,置于10 mL棕色容量瓶中,加入适量甲醇,超声溶解,继续加甲醇定容,配制成1 mg·mL-1的内标储备溶液。精密移取内标对照品储备液400 μL于10 mL棕色容量瓶中,加入70%乙腈定容,配制成40 μg·mL-1的内标工作液。
2.1.3 校正标样工作液的制备 精密移取适量咪达唑仑对照品储备液于10 mL棕色容量瓶中,用70%乙腈稀释成浓度分别为20 000、8 000、4 000、2 000、800、400、200、100 ng·mL-1的8个不同浓度的校正标样工作液。
2.1.4 质控样品工作液的制备 精密移取适量咪达唑仑对照品储备液于10 mL棕色容量瓶中,用70%乙腈稀释成浓度分别为15 000、3 000、240 ng·mL-1的高、中、低浓度质控样品工作液。
2.1.5 探针药物咪达唑仑注射溶液的配制 精密称定咪达唑仑,溶于生理盐水中,配制成浓度为0.8 mg·mL-1的咪达唑仑注射溶液,用于大鼠尾静脉注射,现配现用。
2.1.6 柚皮苷混悬液配制 称取柚皮苷粉末适量,少量多次加入超纯水,超声混匀,制成质量浓度分别为0.01、0.025、0.05和0.1 mg·mL-1的柚皮苷混悬液,供各剂量组大鼠灌胃使用。
2.2 动物分组与给药 大鼠适应环境3 d后开始实验。将大鼠随机分为空白对照组和4个柚皮苷给药组,每组7只。给药期间,自由饮水进食。空白对照组的大鼠灌胃给予等体积的超纯水,柚皮苷给药组分别按50、125、250和500 mg·kg-1的剂量灌胃给药,给药体积均为5 mL·kg-1,每天1次,连续7 d。最后一次灌胃后,大鼠禁食24 h,然后按2.5 mg·kg-1的剂量尾静脉注射咪达唑仑溶液。
2.3 采血与血浆样品处理 准备1%肝素钠浸泡、烘干过的1.5 mL离心管和毛细玻璃管,于注射咪达唑仑溶液前及注射后5、10、20、30、45、60、90、120、180和270 min时用毛细玻璃管于大鼠眼底静脉丛取血0.3~0.4 mL,置于1.5 mL离心管中。全血样品于室温下3 500 rpm离心15 min,移取上层血浆100 μL于新的离心管中,备用。
2.4 色谱条件 采用Agilent Poroshell 120 EC-C18色谱柱(3.0 mm×30 mm,2.7 μm),柱温为25 ℃,流动相为0.1%甲酸水溶液-乙腈,流速为0.4 mL·min-1,进样量为10 μL。梯度洗脱程序为:0~1.7 min,乙腈40%→46%;1.7~1.8 min,乙腈46%→90%;1.8~2.8 min,乙腈90%;2.8~2.9 min,乙腈90%→40%;2.9~7.0 min,乙腈40%。
2.5 质谱条件 采用电喷雾离子化(ESI)电离、正离子模式检测、多反应监测(MRM)模式进行,雾化器温度(Gas temp.)为325 ℃,雾化器流速(Gas flow)为12 L·min-1,雾化器压力(Nebulizer)为30 psi。待定量的离子对及MRM条件(裂解电压/碰撞能量)为:咪达唑仑m/z326.1→291.1,205 V/28 eV;皮质酮(内标)m/z347.2→121,140 V/24 eV。
2.6 样品制备
2.6.1 血浆校正标样的制备 精密移取空白血浆100 μL,加入不同浓度的校正标样工作液10 μL,加内标工作液10 μL,混匀,加乙腈280 μL,制成质量浓度分别为500、200、100、50、20、10、5和2.5 ng·mL-1的血浆校正标样,涡旋1 min,15 000 rpm离心10 min,精密移取上清液100 μL到液相小瓶套管,进样。
2.6.2 血浆质控样品的制备 精密移取空白血浆100 μL,加入不同浓度的质控样品工作液10 μL,加内标工作液10 μL,混匀,加乙腈280 μL,制成质量浓度分别为375、75和6 ng·mL-1的质控样品,涡旋1 min,15 000 rpm离心10 min,精密移取上清液100 μL到液相小瓶套管,进样。
2.6.3 分析批的接受标准 一个分析批包括两条随行标曲(按“2.6.1”项下的方法制备)、两份血浆质控样品(按“2.6.2”项下的方法制备)、待测样品、空白样品和零浓度样品。进样时,血浆质控样品均匀分散于分析批中。至少75%的校正标样的准确度在±15%以内(定量下限在±20%以内),至少67%的质控样品且每一浓度水平至少有50%的质控样品的准确度在±15%以内,则接受该分析批。
2.6.4 血浆样品的制备 大鼠血浆样品和零浓度样品的制备方法为:精密移取待测血浆样品或空白血浆样品100 μL,加入内标10 μL,混匀,加70%乙腈10 μL,加乙腈280 μL,涡旋1 min,15 000 rpm离心10 min,精密移取上清液100 μL到液相小瓶的套管,进样。空白样品的制备方法为:精密移取空白溶剂样品100 μL,加入70%乙腈20 μL,加乙腈280 μL,涡旋1 min,精密移取100 μL到液相小瓶的套管,进样。
2.7 方法学考察
2.7.1 选择性 按“2.6”项下的方法制备空白血浆样品和校正标样中的定量下限样品,空白血浆来自6只不同的大鼠,进样分析并评价干扰。
2.7.2 标准曲线及定量下限 按“2.6”项下的方法,在不同天分别制备校正标样进样。以目标分析物的浓度(ng·mL-1)为横坐标,以目标分析物的响应值与内标响应值的比值为纵坐标,采用加权最小二乘法进行拟合,得到咪达唑仑的线性回归方程。
2.7.3 精密度和准确度 按“2.6”项下的方法制备校正标样、定量下限样品及低、中、高浓度质控样品各6份,以上样品组成一个分析批,于制备当日进样分析。第2天、第3天重复制备前述分析批并进样分析。
2.7.4 残留 在定量上限样品进样后进样空白血浆样品来估计残留。
2.7.5 基质效应 按“2.6”项下的方法,将100 μL的空白血浆替换为100 μL甲醇,制备不含血浆基质的低浓度和高浓度纯溶液样品各1份,进样。按照“2.6.4”项下的方法,制备低浓度和高浓度基质效应样品各6份(空白血浆来自6只不同的大鼠,在最后上清液中按照比例加入质控样品工作液),进样分析。计算基质效应样品和纯溶液样品中目标分析物和内标的基质因子,再以目标分析物的基质因子除以内标的基质因子,得到经内标归一化的基质因子。
2.7.6 提取回收率 按“2.6”项下方法,制备低浓度质控样品和高浓度质控样品各6份,进样,得到咪达唑仑在低浓度质控样品和高浓度质控样品中的响应值(R质控样品),按照“2.7.5”项下的方法,制备低浓度和高浓度的基质效应样品各6份,进样,得到咪达唑仑在低浓度基质效应样品和高浓度基质效应样品中的响应值(R基质效应),以R质控样品/ R基质效应得到咪达唑仑的回收率,计算RSD值评价回收率。
2.7.7 稳定性 根据实验中样品的储存时间,需考察样品在4 ℃储存24 h和36 h、样品在自动进样器温度下储存24 h和36 h、样品在-20 ℃储存2周和3周共六种不同情况下的稳定性。按照“2.6”项下的方法制备低浓度质控样品(6 ng·mL-1)和高浓度质控样品(375 ng·mL-1)各3份,在所评价的储存条件下储存后进样分析,将测得浓度与标示浓度比较。
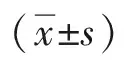
3 结果
3.1 选择性 咪达唑仑及皮质酮(内标)的提取离子流图如图1所示。由表1可见,干扰组分的响应值低于定量下限样品中咪达唑仑响应值的20%,并低于内标响应的5%,符合生物样品定量分析方法的要求。
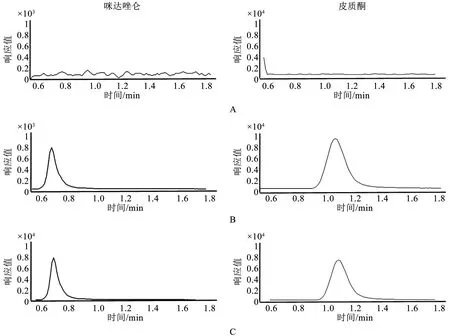
A.空白血浆样品;B.空白血浆样品+混标+内标;C.尾静脉注射探针底物后1 h的血浆样品+内标图1 咪达唑仑及皮质酮(内标)的提取离子流色谱图
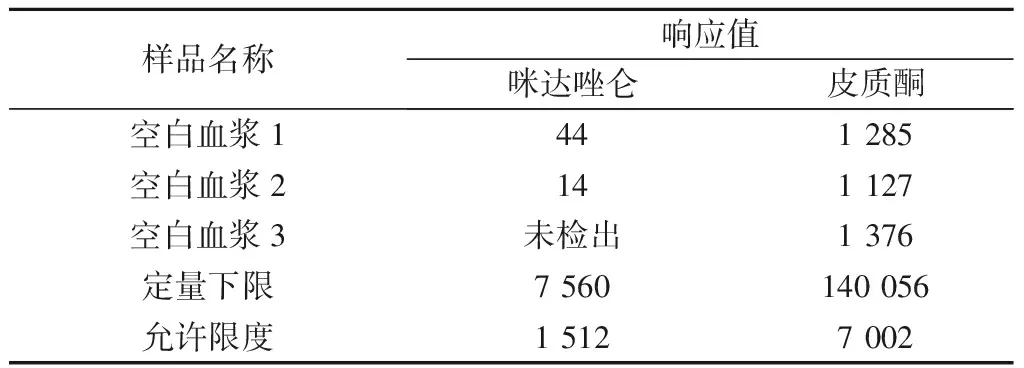
表1 咪达唑仑及皮质酮(内标)在空白血浆样品和定量下限样品中的响应值
3.2 标准曲线及定量下限 由表2可见,校正标样的准确度均在±15%以内,定量下限在±20%以内,符合生物样品定量分析方法的要求;咪达唑仑在浓度范围为2.5~500 ng·mL-1的线性回归方程为Y=0.033X+0.266(r=0.994),线性良好。
3.3 精密度和准确度 质控样品的批内和批间精密度均小于15%,批内和批间准确度均在±15%以内,定量下限样品的批内和批间精密度均小于20%,批内和批间准确度均在±20%以内,符合生物样品定量分析方法的要求,结果见表3。
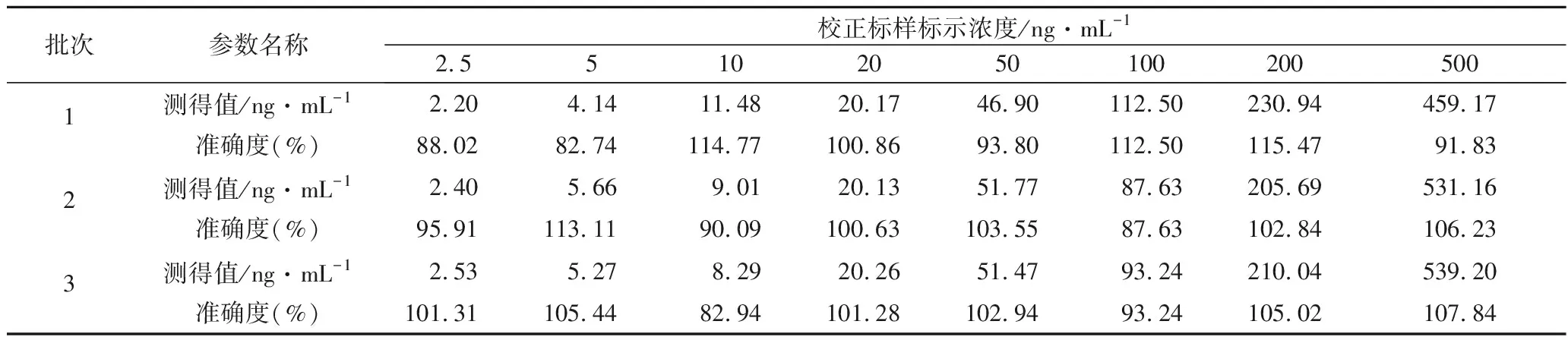
表2 血浆校正标样中测定咪达唑仑的准确度
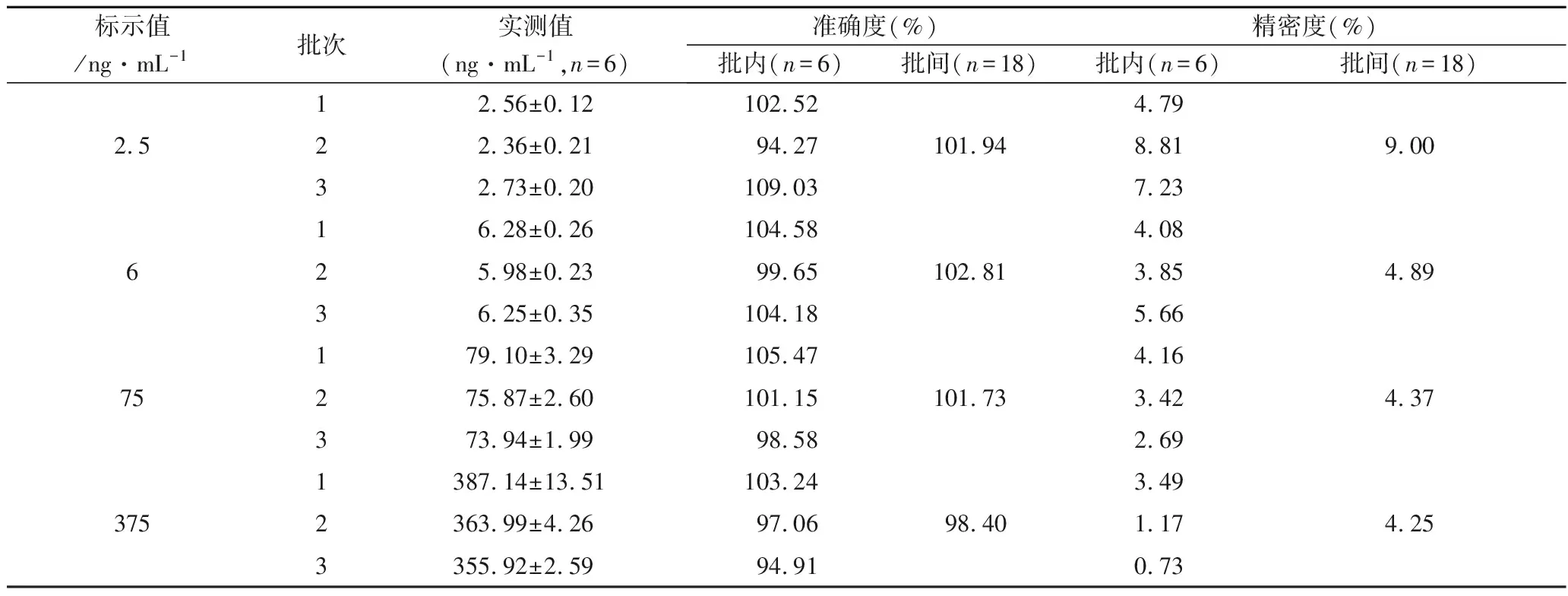
表3 质控样品和定量下限样品的准确度和精密度
3.4 残留 由表4可见,在定量上限样品后所注射的空白样品中,咪达唑仑的残留值不超过定量下限的20%,且不超过内标的5%,符合生物样品定量分析方法的要求。
表4 咪达唑仑和皮质酮(内标)在空白血浆样品中的残留值
3.5 基质效应 进样分析结果表明,低浓度和高浓度质控样品中咪达唑仑从6批基质计算的内标归一化的基质因子的变异系数分别为5.65%、4.54%,均小于15%,表明基质效应符合生物样品定量分析方法的要求。
3.6 提取回收率 提取回收率实验结果见表5,由表5可见,低浓度样品和高浓度样品的平均提取回收率分别为80.02%、78.19%,RSD值分别为3.94%、4.18%,均小于15%,表明提取回收率符合生物样品定量分析方法的要求。
3.7 稳定性 由表6可见,血浆样品在4 ℃储存24 h和36 h、样品在自动进样器温度下放置24 h和36 h、样品在-20 ℃储存2周和3周共6种不同情况下,所测得的咪达唑仑浓度的准确度均在±15%范围内,表明稳定性良好。
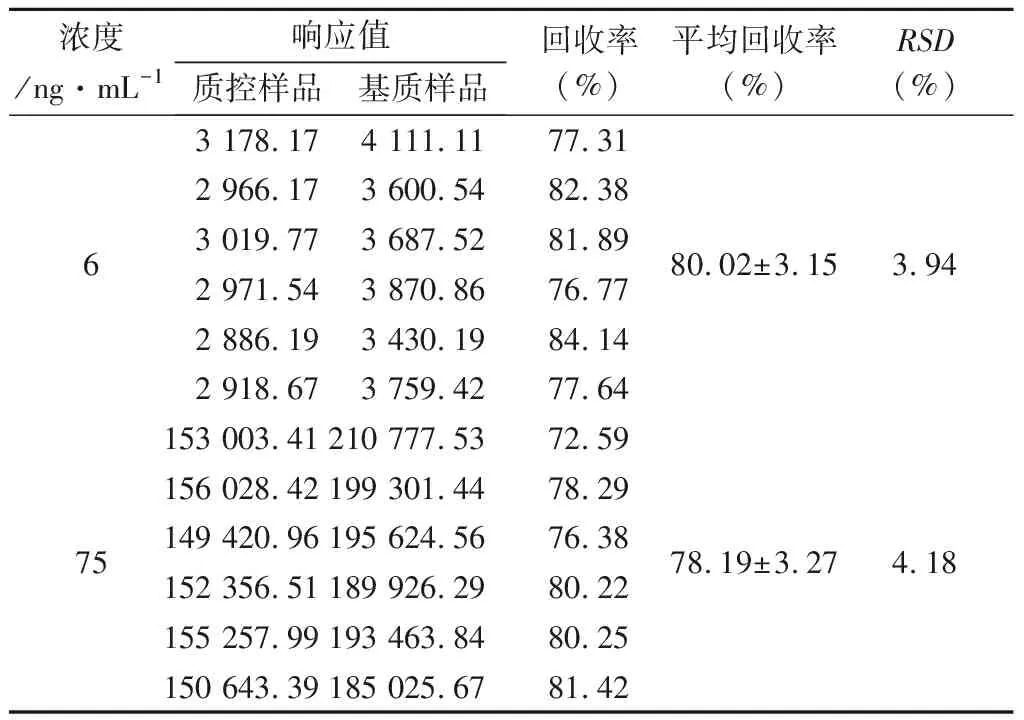
表5 血浆样品中咪达唑仑的提取回收率
3.8 药动学参数 各组咪达唑仑的平均药时曲线见图2、药动学参数见表7。由表7可见,与对照组比较,柚皮苷4个剂量组的咪达唑仑的药代动力学参数AUC0~t、AUC0~∞、MRT0~t、MRT0~∞、t1/2、V、Cl和Cmax均无显著性差异(P>0.05)。说明口服剂量在50~500 mg·kg-1范围内的柚皮苷给药7 d对大鼠体内CYP3A4活性无明显影响。
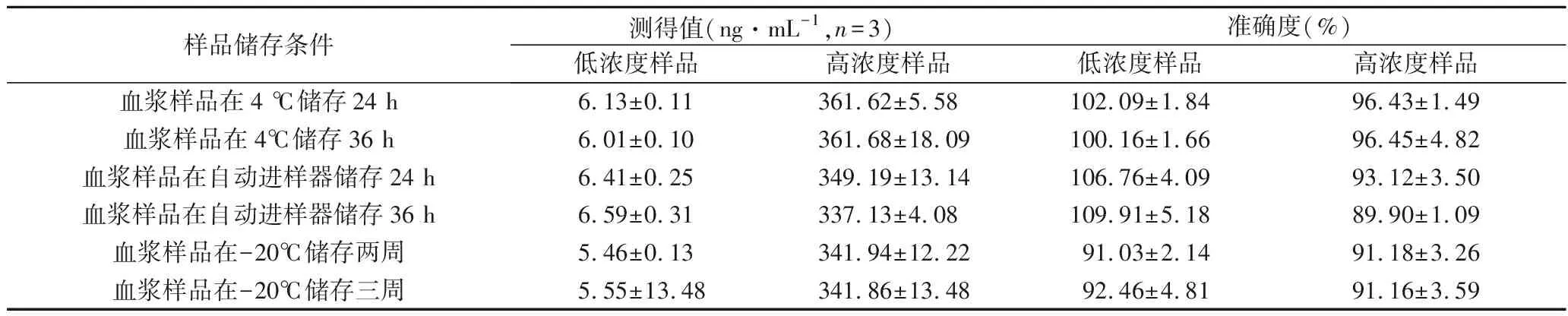
表6 血浆样品中咪达唑仑的稳定性考察
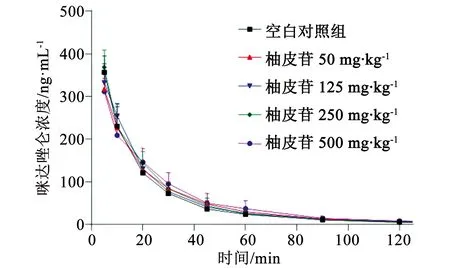
图2 咪达唑仑的平均药时曲线图(n=7)
4 讨论
近年来,柚皮苷因具有广泛的药理活性而受到关注,大量研究表明,柚皮苷或柚皮素具有抗骨质疏松、抗氧化、改善神经功能障碍、抗炎、改善糖脂代谢紊乱、抗动脉粥样硬化、免疫调节、抗癌等多种药理作用[17-18]。由于柚皮苷广泛存在于葡萄柚、桔、橙等水果植物及化橘红、骨碎补、枳实、枳壳、橘红、菝葜、枸橼等中药材中[6-7],因此,研究柚皮苷与其他药物之间的相互作用是十分必要的。
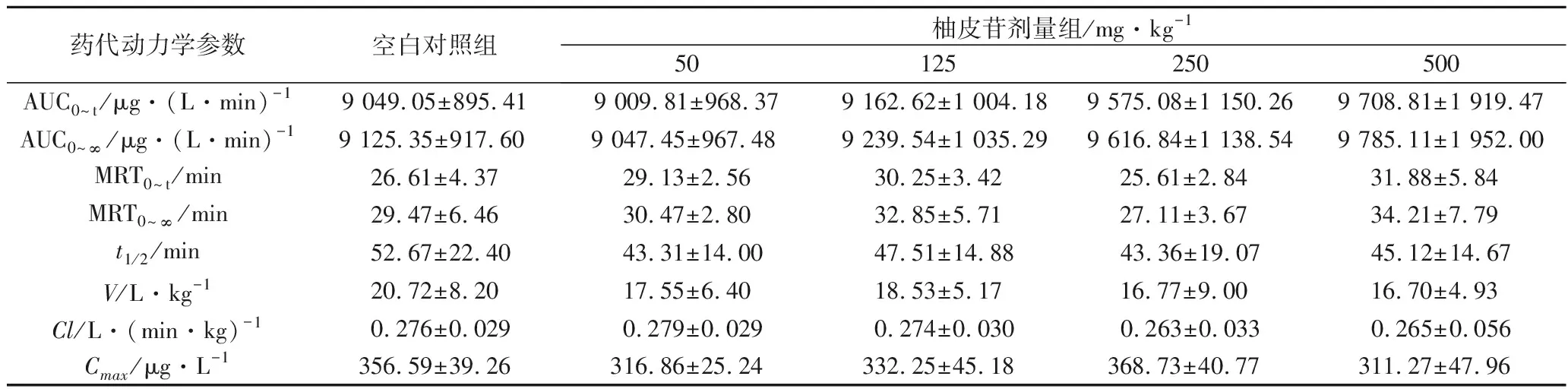
表7 咪达唑仑药代动力学参数(n=7)
在药物代谢研究中,液相色谱串联质谱法应用广泛,其具有操作简单、分析速度快、所需样品量少、灵敏度高、特异性好、结果可靠、重现性好等特点[19]。本文根据《中国药典》2015年版(四部)中的“9012-生物样品定量分析方法验证指导原则”,采用一种基于探针底物法和高效液相串联质谱法的方法来测定大鼠血浆中咪达唑仑的含量,评价了柚皮苷对大鼠肝脏细胞色素P450 同工酶CYP3A1/2代谢活性的影响,结果表明,与对照组比较,柚皮苷四个剂量组(50、125、250和500 mg·kg-1)的咪达唑仑的主要药代动力学参数AUC0~t、AUC0~∞、MRT0~t、MRT0~∞、t1/2、V、Cl和Cmax均无显著差异,说明柚皮苷连续灌胃给药7 d(给药剂量在50~500 mg·kg-1范围内)对大鼠肝脏CYP3A1/2酶活性无明显影响。有文献报道[20],柚皮苷及其苷元柚皮素会抑制肠道某些药物转运体(OATPs转运体、P-gp)的活性,因此,为排除柚皮苷可能对探针药物咪达唑仑的吸收产生复杂的影响,在本实验中,咪达唑仑采用静脉注射的方式给药。
由于CYP3A4亚型酶的表达调控机制存在明显种属差异[21],因此,不能简单地由动物实验结果外推到人体。关于柚皮苷对人体内CYP3A4亚型酶活性的影响,仍需要进一步研究并加以验证。

