丹参川芎嗪注射液对脓毒症幼鼠急性肝损伤保护作用的研究∗
肖 雷 梅贵春 武丽华 谢玉秀
(湖北省武汉市汉阳医院,湖北 武汉 430000)
脓毒症是新生儿及儿科重症监护病房中常见的危急重症。据报道,在所有脓毒症死亡患者中,新生儿及儿童脓毒症死亡率占比高达70%[1]。脓毒症常累及肝脏,造成急性肝损伤,是脓毒症死亡的危险因素之一[2]。因此减轻脓毒症致急性肝损伤对改善患者预后具有重要意义。氧化应激失衡是脓毒症致急性肝损伤的重要机制之一。核转录因子E2相关因子2(Nrf2)是调控细胞抗氧化能力的关键转录因子,氧化应激状态下,可与抗氧化物元件(ARE)结合激活下游血红素氧化酶1(HO-1)、超氧化物歧化酶(SOD)等抗氧化酶基因表达,增强细胞抗氧化能力[3]。目前已成为肝脏疾病治疗的潜在靶点。丹参川芎嗪注射液的主要组分是丹参素和盐酸川芎嗪,其中盐酸川芎嗪具有抗氧化、抗纤维化、改善微循环等作用。已有研究报道,丹参川芎嗪注射液可通过减轻炎症反应和氧化应激水平对慢性阻塞性肺疾病致肺功能损伤、慢性肾衰竭等辅助治疗起积极作用[4-5]。但其对脓毒症致急性肝功能损伤的作用尚不清楚。本研究建立脓毒症幼鼠模型,观察丹参川芎嗪注射液对脓毒症幼鼠急性肝损伤的保护作用及其可能机制。现报告如下。
1 材料与方法
1.1 实验动物 36只SD幼鼠,SPF级,4周龄,体质量80~100 g,雌雄各18只,由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2011-0003。饲养条件:温度20~25℃,相对湿度50%~60%,光照12 h,自由饮食。
1.2 试药与仪器 1)试药:丹参川芎嗪注射液(贵州拜特制药有限公司,批号H52020959,规格:5 mL/支,每支加入250 mL 0.9%氯化钠溶液稀释),脂多糖(lipopolysaccharide,LPS,Sigma公司,批号:1010A032,纯度≥99%);二甲苯、柠檬酸缓冲液(上海阿拉丁生化科技股份有限公司);苏木精-伊红染色液(北京索莱宝科技有限公司);丙二醛(MDA)检测试剂盒(TBA比色法)、谷胱甘肽检测试剂盒、SOD活力检测试剂盒和BCA蛋白定量分析试剂盒(Sigma公司);Trizol试剂、RIPA裂解液(Invitrogen公司);鼠抗人Nrf2单克隆抗体、鼠抗人HO-1单克隆抗体和β-actin抗体(Abcam公司);ECL化学发光液(上海慧颖生物科技有限公司)。2)仪器:XZ-5A低速医用离心机(长沙湘智离心机仪器有限公司);迈瑞BS-490型全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司);Leica DM1000显微镜(德国徕卡);IKA T10型组织匀浆机(广州艾卡仪器设备有限公司);Tanon 4800全自动化学发光图像分析系统(上海天能科技有限公司);2400型PCR仪(Perkin Elmer公司);7300型实时定量PCR仪(ABI公司)。
1.3 选模及给药 36只幼鼠随机分为3组:对照组、模型组、丹参川芎嗪注射液组,各12只。对照组幼鼠给予腹腔注射10 mg/kg 0.9%氯化钠注射液,正常条件饲养。模型组及丹参川芎嗪注射液组给予腹腔注射LPS 10 mg/kg建立脓毒症幼鼠模型[6],幼鼠常规饲养1周后,模型制备前12 h禁食,自由饮水,采用0.2 mL/100 g戊巴比妥钠2%进行腹腔内注射麻醉,麻醉后固定,并在无菌条件下沿腹中线切1 cm切口,并将盲肠和肠系膜游离出,并结扎盲肠根部,并采用14号针在结扎处远端进行贯穿盲肠4次,术中避免刺穿回肠和盲肠系膜血管,之后将盲肠送入腹腔,并逐层缝合腹壁切口,术前30 min及1 h后腹腔注射0.9%氯化钠注射液溶液5 mL,正常条件饲养。丹参川芎嗪注射液组在造模前30 min及造模1 h后腹腔注射丹参川芎嗪注射液5 mL,正常条件饲养。
1.4 样本采集 于建模后6、12 h分别各采集每组6只幼鼠麻醉后取下腔静脉血后处死取肝组织,全血在室温下静置1 h后,使用XZ-5A低速医用离心机,3000 r/min离心10 min,取上清液保存于超低温冰箱。肝组织样品一部分用4%多聚甲醇固定以进行组织病理学观察,一部分用于制作组织匀浆以检测氧化活性物质,另取肝组织样品在液氮中速冻保存。
1.5 观察指标 1)血清生化指标检测:取保存血清样品,使用迈瑞BS-490型全自动生化分析仪(迈瑞医疗)及其配套试剂,分析血清中谷草转氨酶(AST)、谷丙转氨酶(GOT)和乳酸脱氢酶(LDH)水平。2)肝组织病理学形态观察:肝组织使用4%多聚甲醇固定24 h后,取出蒸馏水冲洗3次,使用50%、70%、80%、95%、100%梯度酒精脱水,加入二甲苯溶液透明30 min,重复透明1次,将组织浸入石蜡进行包埋,切成4 μm切片,放入恒温烘箱中烘烤2 h。分别使用二甲苯、酒精进行脱蜡、水化,然后加入苏木精染色7 min,PBS冲洗后加入伊红复染10 s,PBS冲洗切片,分别使用酒精、二甲苯脱水、透明,使用中性树胶封片,在Leica DM1000显微镜(德国徕卡)下观察组织形态学变化。3)肝组织氧化应激相关指标检测:取肝组织,用0.9%氯化钠注射液冲洗掉血液,滤纸吸干水分,称取适量肝组织加入离心管中,按组织质量∶0.9%氯化钠注射液体积=1∶9加入预冷0.9%氯化钠注射液,使用IKA T10型组织匀浆机(广州艾卡仪器设备有限公司)制成10%肝组织匀浆液。组织中MDA、谷胱甘肽(GSH)水平及SOD、谷胱甘肽硫转移酶(GST)活性和蛋白定量使用试剂盒检测,检测方法严格参照说明书进行。4)肝组织Nrf2、HO-1 mRNA表达检测:取肝组织样品,加液氮研磨,加入Trizol试剂提取总RNA,逆转录合成cDNA,进行实时荧光定量PCR(qRT-PCR),以β-actin为内参检测组织中Nrf2、HO-1 mRNA相对表达量。qRT-PCR程序:95℃预变性30 s;95℃变性5 s,60/58℃退火30 s,72℃延伸30 s,共40个循环。Nrf2引物序列:上游5′-CCATTTGTAGATGACCATGAGTCGCA-3′,下 游 5′-ATCAGGGGTGGTGAAGACTG-3′;HO-1引物序列:上游 5′-TGCAGGTGATGCTGACAGAGG-3′,下 游 5′-GGGATGAGCTAGTGCTGATCTGG-3′。 Nrf2、HO-1 mRNA相对表达量采用2-ΔΔCT法计算。5)肝组织Nrf2、HO-1蛋白表达检测:取肝组织样品,加液氮研磨,加入RIPA裂解液提取组织总蛋白,检测蛋白浓度,以等质量蛋白样品进行SDS-PAGE电泳,分离目的蛋白转移至硝酸纤维素膜(NC膜),室温下5%脱脂奶粉封闭1 h。分别加入按1∶500比例稀释的鼠抗人Nrf2单克隆抗体、鼠抗人HO-1单克隆抗体和β-actin内参抗体,4℃孵育过夜,再加入按1∶1000比例稀释的兔抗鼠βactin抗体、辣根过氧化物酶标记山羊抗兔二抗,室温孵育1 h,TBST溶液冲洗3次。加入ECL化学发光液中显色,使用Tanon 4800全自动化学发光图像分析系统进行拍照,Image J软件分析条带灰度值。
1.6 统计学处理 应用SPSS19.0统计软件。计量资料以(±s)表示,多组比较采用方差分析检验,进一步两两比较采用LSD-t检验,计数资料用百分数表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组肝组织病理学改变 见图1。对照组肝细胞以中央静脉为中心呈放射状排列,形态正常,结构完整无病理改变。模型组6 h时肝细胞出现水肿、少量坏死,12 h时水肿加重,部分肝细胞颗粒变性,细胞排列紊乱。丹参川芎嗪注射液组6、12 h肝细胞水肿、坏死、颗粒变性与模型组比较明显减轻。
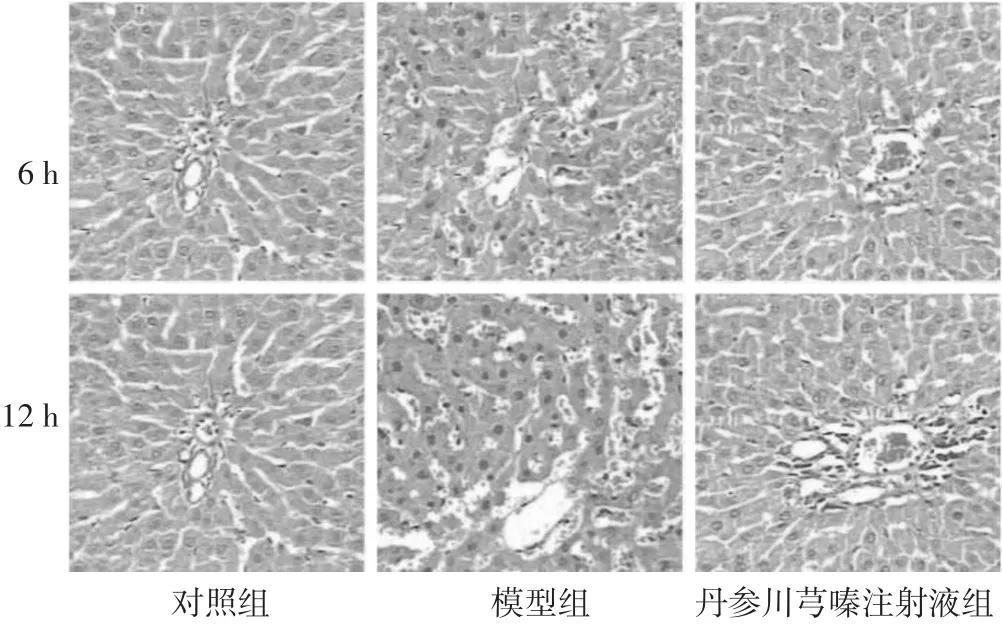
图1 各组肝组织病理学形态(HE染色,200倍)
2.2 各组血清生化指标比较 见表1。与对照组比较,不同时间点模型组血清AST、GOT和LDH水平均升高(P<0.05);与模型组比较,不同时间点丹参川芎嗪注射液组血清AST、GOT和LDH水平降低(P<0.05);不同时间点,丹参川芎嗪注射液组血清AST、GOT和LDH水平高于对照组(P<0.05)。
表1 各组不同时间点血清AST、GOT和LDH水平比较(U/L,±s)
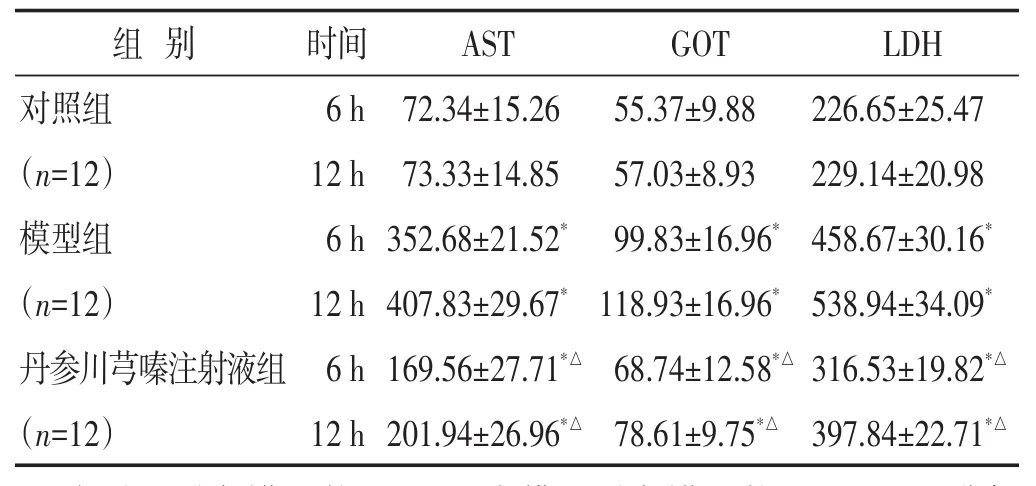
表1 各组不同时间点血清AST、GOT和LDH水平比较(U/L,±s)
与对照组同时期比较,∗P<0.05;与模型组同时期比较,△P<0.05。下同
组别LDH时间AST GOT 226.65±25.47229.14±20.98458.67±30.16*538.94±34.09*316.53±19.82*△397.84±22.71*△对照组(n=12)模型组(n=12)丹参川芎嗪注射液组(n=12)6 h 12 h 6 h 12 h 6 h 12 h 72.34±15.2673.33±14.85352.68±21.52*407.83±29.67*169.56±27.71*△201.94±26.96*△55.37±9.8857.03±8.9399.83±16.96*118.93±16.96*68.74±12.58*△78.61±9.75*△
2.3 各组肝组织生化指标水平比较 见表2。与对照组比较,不同时间点模型组肝组织总MDA水平均升高(P<0.05),GSH水平降低(P<0.05),SOD和GST活性降低(P<0.05);与模型组比较,不同时间点丹参川芎嗪注射液组肝组织中MDA水平均降低(P<0.05),GSH水平升高(P<0.05),SOD和GST活性升高(P<0.05);不同时间点,丹参川芎嗪注射液组MDA水平高于对照组(P<0.05),SOD、GSH、GST与对照组比较差异无统计学意义(P>0.05)。
表2 各组肝组织中MDA、SOD、GSH、GST水平比较(±s)

表2 各组肝组织中MDA、SOD、GSH、GST水平比较(±s)
组 别 时间MDA(nmol/mg)SOD(U/mg)GSH(mg/g)GST(U/mg)75.39±6.1477.14±5.8248.92±3.38*39.26±4.46*67.83±5.17△58.19±5.24△1.77±0.281.71±0.243.02±0.36*5.17±0.42*2.14±0.41*△3.03±0.58*△6 h 12 h 6 h 12 h 6 h 12 h对照组(n=12)模型组(n=12)丹参川芎嗪注射液组(n=12)7.92±2.148.04±1.964.83±1.35*3.66±0.99*7.11±1.82△6.79±1.27△118.92±16.75120.39±19.8279.68±20.39*83.67±14.95*95.42±15.57△111.62±13.24△
2.4 各组肝组织Nrf2、HO-1 mRNA表达水平比较见表3。6、12 h,模型组和丹参川芎嗪注射液组肝组织中Nrf2、HO-1 mRNA相对表达量均高于对照组(P<0.05),丹参川芎嗪注射液组肝组织中Nrf2、HO-1 mRNA相对表达量均高于模型组(P<0.05)。
表3 各组肝组织中Nrf2、NO-1 mRNA相对表达量比较(±s)

表3 各组肝组织中Nrf2、NO-1 mRNA相对表达量比较(±s)
组别对照组(n=12)模型组(n=12)丹参川芎嗪注射液组(n=12)时间6 h 12 h 6 h 12 h 6 h 12 h Nrf2 mRNA相对表达量0.98±0.180.96±0.191.56±0.19*1.74±0.21*2.67±0.22*△3.02±0.34*△HO-1 mRNA相对表达量2.03±0.542.12±0.612.89±0.67*3.36±0.72*3.48±0.72*△4.19±0.81*△
2.5 各组肝组织Nrf2、HO-1蛋白表达比较 见图2,表4。6 h、12 h,模型组和丹参川芎嗪注射液组肝组织中Nrf2、HO-1蛋白相对表达量均高于对照组(P<0.05),丹参川芎嗪注射液组肝组织中Nrf2、HO-1蛋白相对表达量均高于模型组(P<0.05)。

图2 肝组织中Nrf2、HO-1蛋白表达水平检测
表3 各组肝组织中Nrf2、HO-1蛋白表达水平比较(±s)
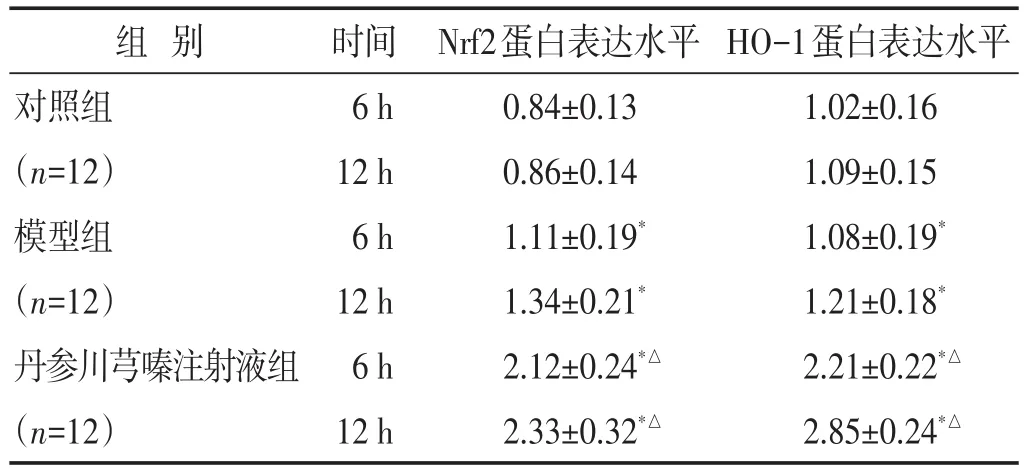
表3 各组肝组织中Nrf2、HO-1蛋白表达水平比较(±s)
组别对照组(n=12)模型组(n=12)丹参川芎嗪注射液组(n=12)时间6 h 12 h 6 h 12 h 6 h 12 h Nrf2蛋白表达水平0.84±0.130.86±0.141.11±0.19*1.34±0.21*2.12±0.24*△2.33±0.32*△HO-1蛋白表达水平1.02±0.161.09±0.151.08±0.19*1.21±0.18*2.21±0.22*△2.85±0.24*△
3 讨论
脓毒症引起的多器官功能障碍是患者死亡的主要原因,急性肝损伤可发生在脓毒症的任何阶段且对脓毒症病情发展具有重要影响[7]。脓毒症致急性肝损伤的机制目前尚不完全清楚,多认为与氧自由基损伤、过度炎性反应、氧供需失衡等有关[8-9]。本研究通过腹腔注射LPS建立脓毒症幼鼠模型,给予丹参川芎嗪注射液干预治疗,肝组织病理学检查结果说明丹参川芎嗪注射液能够缓解模型幼鼠肝功能损伤,对脓毒症致急性肝功能损伤起保护作用。观察造模后6 h和12 h各组幼鼠血清中肝功能指标,结果模型组血清AST、ALT和LDH水平均高于对照组,但丹参川芎嗪注射液组血清AST、GOT和LDH水平较模型组降低,说明丹参川芎嗪注射液组肝功能损伤程度明显降低,证实丹参川芎嗪注射液的肝组织保护作用。
脓毒症发生及进展过程中,肝脏巨噬细胞在吞噬和清楚病原体的同时会释放大量炎性因子、活性氧自由基等,引起氧化应激而损伤肝组织[10-11]。川芎嗪属酰胺类生物碱,临床研究表明,其药理作用有降低氧自由基水平、免疫调节功能、钙拮抗、抗凝等[12]。本研究模型组肝组织中MDA水平明显高于对照组,而GSH水平和SOD、GST活性均明显低于对照组,说明脓毒症引起幼鼠肝组织脂质过氧化反应增强,抗氧化能力减弱。而与模型组比较,丹参川芎嗪注射液组肝组织中MDA水平明显降低,GSH水平和SOD、GST活性明显升高,说明丹参川芎嗪注射液能够增强肝组织抗氧化能力。
Nrf2是真核生物氧化还原活性因子,主要参与调控生物体细胞氧化还原平衡及保护性抗氧化和Ⅱ期解毒反应[13-14]。正常生理条件下,Nrf2在胞质中与Keap1蛋白结合而被泛素化和降解,但在氧化应激条件下,Nrf2依赖的细胞防御机制被激活,Nrf2与Keap1解偶联并迅速移位到细胞核,与ARE结合,激活HO-1、SOD、GST等基因转录,最终影响细胞氧化状态,增强细胞抗氧化能力[15-16]。研究表明,Nrf2/HO-1信号通路在生物体抵抗各种外来刺激产生的氧化应激损伤中起重要作用,是生物体内最重要的内源性抗氧化信号通路[17]。本研究结果,模型组肝组织中Nrf2、HO-1 mRNA和蛋白表达量均高于对照组,而丹参川芎嗪注射液组肝组织中Nrf2、HO-1 mRNA和蛋白表达量均明显高于模型组,提示丹参川芎嗪注射液增加肝组织抗氧化能力,可能是通过激活Nrf2/HO-1通路实现的。但模型组Nrf2、HO-1表达升高是否也参与肝组织氧化损伤有待进一步探讨。此外,Zheng等研究报道,丹参川芎嗪注射液能够抑制人肝星状细胞LX-2增殖,在抑制肝纤维化中起作用[18]。提示丹参川芎嗪注射液对肝组织具有保护作用。
综上所述,丹参川芎嗪注射液可能通过激活Nrf2/HO-1通路,增强肝组织SOD、GST活性,并降低MDA水平,增强肝组织抗氧化能力,保护脓毒症所引起的急性肝组织损伤,为临床预防及辅助治疗脓毒症致急性肝损伤提供了参考。

