DEB-TACE治疗消化道肿瘤肝转移的初步观察
李 臻,李 鑫,白亮亮,纪 坤,詹鹏超,任建庄,段旭华,韩新巍
郑州大学第一附属医院放射介入科郑州450052
肝脏是肿瘤发生血行转移最常见的部位之一,由于肝转移癌常多发,外科切除率并不高,因此姑息性治疗成为肝转移癌主要的治疗方式,方法有全身化疗、经动脉化疗栓塞术(transarterial chemoembolization,TACE)、射频消融术、靶向治疗、放射治疗等,其中TACE因具有微创、可重复性强、疗效确切等优势,已经成为治疗肝转移癌的重要手段[1]。栓塞剂是影响TACE疗效的主要因素之一。传统TACE(c-TACE)常采用碘油与化疗药物乳剂作为栓塞剂,但肝转移瘤是一种乏血供肿瘤,使得碘油沉积不良;因此栓塞效果不尽如人意。近年来载药微球(drug-eluting bead,DEB)作为新型栓塞剂,逐步应用于临床。用加载缓释药物的DEB栓塞肿瘤血管床可具有双重治疗作用,已初步显示出对肝转移癌有疗效[2]。本文分析了DEB-TACE治疗的25例消化道肿瘤肝转移患者的资料,并与c-TACE治疗的23例进行对比分析,探讨DEB-TACE治疗肝转移癌的可行性、安全性及近期疗效。
1 临床资料
1.1 一般资料 病例纳入标准:经影像学或病理学确诊的消化道肿瘤肝转移患者,无法切除或拒绝外科手术;临床治疗后肿瘤复发者;无心、脑、肾等重要脏器功能障碍;年龄18~85岁。排除标准:肝功能严重障碍(Child-Pugh C级)者,包括黄疸、肝性脑病、难治性腹水或肝肾综合征;严重凝血功能障碍者;门静脉主干完全阻塞,且侧支血管较少者;恶病质或多器官功能衰竭者;肾功能障碍(尿肌酐>20 mg/L或者肌酐清除率<30 mL/min)者;妊娠期患者。2016年5月至2018年12月我科收治的符合上述标准的消化道肿瘤肝转移患者48例,均接受化疗栓塞治疗。DEB-TACE治疗25例,其中男20例,女5例,年龄31~75(59.9 ±3.3)岁;结直肠癌肝转移17例,胃癌肝转移8例;16例原发灶已切除;8例有单个肝转移灶,17例有多个转移灶。c-TACE治疗23例,其中男15例,女8例,年龄27~77(60.1±10.0)岁;结直肠癌肝转移16例,胃癌肝转移7例;13例原发灶已切除;3例有单个肝转移灶,20例有多个转移灶。
1.2 介入手术 术前完善影像学检查(CT/MRI平扫+增强扫描)、心电图、实验室检查等,明确诊断。患者签署治疗知情同意书。介入手术器械:5F鞘管、5FRH 导管(美国库克公司),0.889 mm(0.035英寸)亲水膜导丝、微导管系统2.7F(日本泰尔茂医疗产品有限公司),直径100~300μm及300~500 μm CalliSpheres微球、罂粟乙碘油(江苏恒瑞医药股份有限公司)。
DEB的制备:术前30 min开始载药。以20 mL注射器抽出全部微球,然后将注射器竖立放置2~3 min,直至微球沉降、分层明显,去除上清液。用10 mL注射器抽取注射用水或50 g/L葡萄糖水溶解待载药物,确认化疗药物完全溶解。将微球与化疗药物混合,每5 min轻摇1次,共6次。加载药物完毕后,按1∶1比例加入对比剂,接三通及另一注射器充分混匀备用。
介入手术操作:患者仰卧位,心电监护。双侧腹股沟区消毒铺巾。一般行右股动脉穿刺,置入5F鞘管。引入亲水膜导丝及5FRH导管,行肝动脉造影,明确肿瘤供血动脉,必要时以微导管超选。根据病理结果选择个体化化疗药物,依据转移灶大小、数目、血供情况选择DEB大小(表1)。缓慢推注预先配制好的DEB栓塞肿瘤血管床,直至造影示肿瘤无染色。c-TACE术中操作与DEB-TACE相同,以碘油乳剂栓塞肿瘤血管床,直至造影示肿瘤无染色。
术后主要针对栓塞后综合征(恶心、呕吐、腹痛、发热)常规给予对症处理,包括止吐、止疼、保肝、预防感染等。

表1 DEB方案
1.3 疗效评估 ①分析患者术前、术后1周、术后1个月的血常规、肝肾功能、凝血功能等实验室指标,包括谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)、凝血酶原时间(PT)、血尿素氮(BUN)、白细胞计数(WBC)、血小板计数(PLT)。②记录患者术前及术后1、3、6个月的CT或MRI检查结果,根据实体瘤疗效评价标准(mRECIST)[3]评价疗效,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),死亡病例归为PD。CR+PR为疾病客观缓解,CR+PR+SD为疾病控制。
1.4 统计学处理 应用SPSS 23.0进行数据处理。两组疾病客观缓解率、控制率及主要并发症发生率的比较采用χ2检验,治疗前后实验室指标的比较应用重复测量数据的方差分析,检验水准α=0.05。
2 结果
2.1 治疗效果 典型病例DSA表现见图1。DEBTACE组25例中,有3例随访时间未达6个月;c-TACE组23例随访时间均达6个月。两组不同时间点疾病客观缓解率和控制率差异均无统计学意义(表2)。
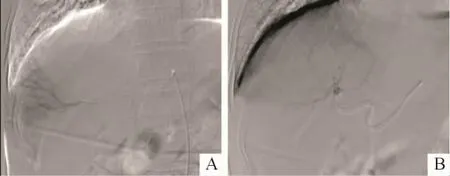
图1 典型病例DSA表现

表2 两组不同随访时间疾病客观缓解和疾病控制状况的比较 例
2.2 两组实验室指标的比较 两组患者术前及术后1个月内实验室指标检测结果见表3。两组患者均主要表现出一过性ALT升高及WBC升高。
2.3 并发症发生情况 患者术前均预防性应用镇痛及止吐药物,部分患者术中出现腹痛,可耐受。两组术后均未发生严重并发症,两组术后栓塞后综合征发生率差异无统计学意义(表4)。
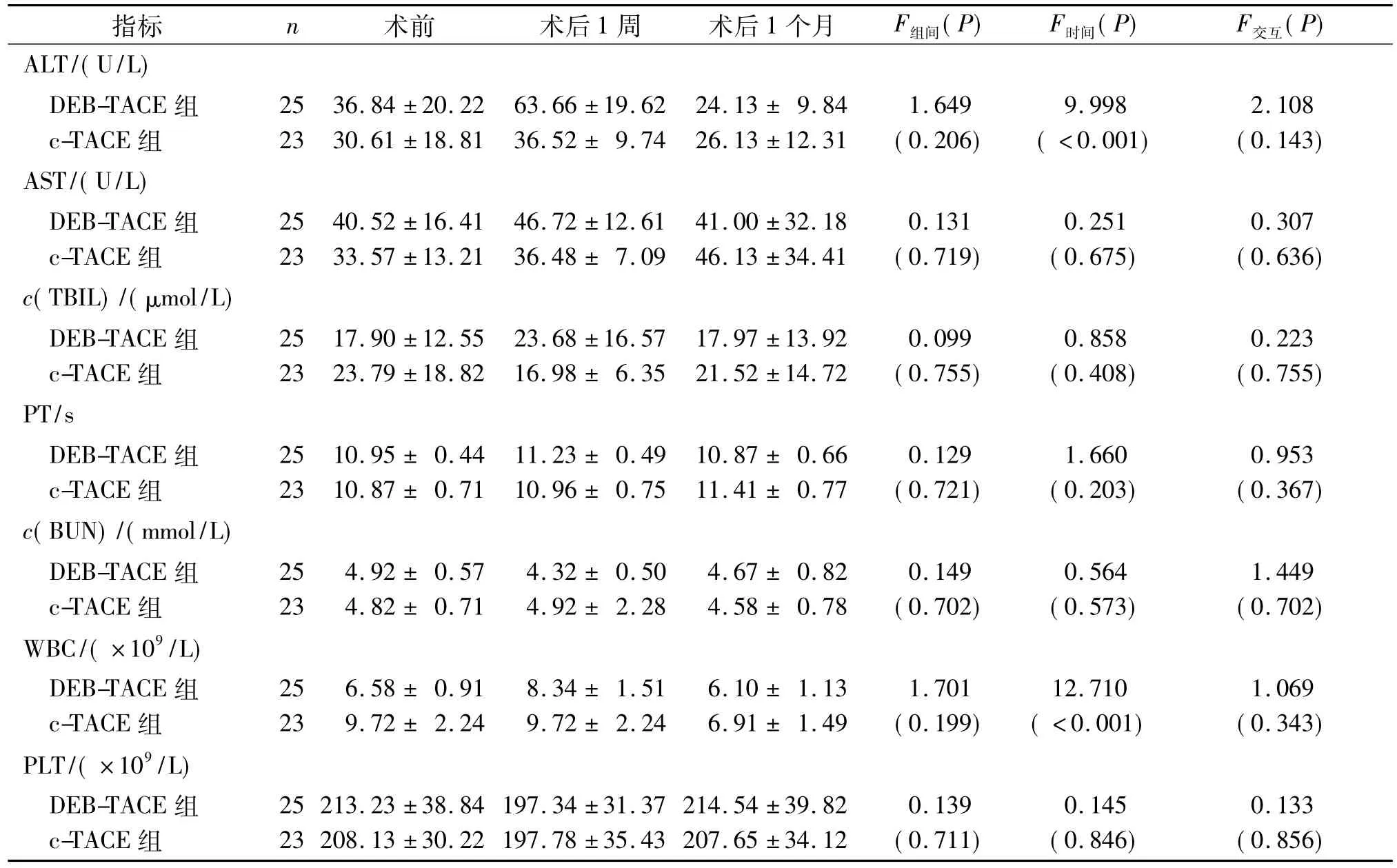
表3 两组实验室指标的比较

表4 两组术后栓塞后综合征发生情况的比较 例
3 讨论
肝转移癌最常见于消化道恶性肿瘤,尤以结直肠癌、胃癌多见,25% ~50%的结肠癌患者确诊时已出现肝转移[4],胃癌的肝转移发生率亦较高,为4% ~14%[5]。临床对于消化道癌肝转移的治疗主要有外科切除、内科化疗及介入治疗,肝功能基础较好的寡转移灶,可以外科切除或消融治疗;但肝转移灶主要表现为多发,接受内科化疗或免疫治疗者居多。c-TACE作为介入治疗的代表性技术,最早用于肝癌的治疗,并取得了显著效果,但c-TACE亦存在诸多临床缺陷:①由于肝肿瘤是一种既乏血供又多重血供的肿瘤,加之碘油本身的易流动性,导致碘油沉积不良,易发生肿瘤血管再通。②碘油可通过肝血窦进入瘤周的门静脉,最后沉积在正常肝组织中。反复使用碘油会严重损害肝功能[6]。③碘油与化疗药物结合不牢固,易致化疗药物进入体循环,引起全身毒性。
与碘油相比,DEB具有以下特点:微球形态均匀、规则,粒径规格齐全,能更好地栓塞肿瘤供血动脉;DEB可在肿瘤组织内持续、缓慢释放抗肿瘤药物,使肿瘤组织中药物浓度显著增加[7],有效控制转移癌的复发;微球与抗肿瘤药物结合牢固,可使进入体循环的药物明显减少,减轻药物的毒副作用。当前DEB-TACE在治疗原发性肝癌领域应用广泛,且取得满意疗效[8-9]。
关于DEB-TACE治疗消化道肿瘤肝转移的研究,国外研究[10]报道,应用伊立替康载药微球栓塞(DEBIRI)治疗15例结直肠癌肝转移,无进展生存期和总生存期分别为8个月和13个月,其中1例肝内转移灶缩小至可外科手术切除。Iezzi等[11]应用DEBIRI治疗20例结直肠癌肝转移,无进展生存期和总生存期分别为4个月和7.3个月。此两项研究表明应用DEB治疗消化道肿瘤肝转移是安全可行的。Fiorentini等[12]纳入了74例结直肠癌肝转移患者,对比DEBIRI与内科化疗FOLFIRI(伊立替康+氟尿嘧啶+亚叶酸钙)的疗效,结果显示DEBIRI组患者无进展生存期和总生存期均较FOLFIRI组延长,且患者全身不良反应较小。Akinwande等[13]应用DEBIRI联合FOLFOX治疗肝转移癌,肿瘤坏死率明显增加,患者生存期显著延长。此外,Cucchetti等[9]发现DEB-TACE治疗能缩短患者住院时间,改善患者生活质量。
本研究应用DEB-TACE治疗25例消化道肿瘤肝转移患者,应用c-TACE治疗23例。结果显示,两组术后1、3及6个月疾病控制率和缓解率差异无统计学意义。两组术后1周均主要表现出一过性ALT升高和WBC升高。分析其原因为化疗栓塞导致一过性肝损伤,引起ALT升高;栓塞后瘤体坏死引起局部炎症,导致WBC升高。术后两组栓塞后综合征发生率均不高,且差异无统计学意义,说明DEB-TACE并不增加患者术后不良反应,经保肝、抗炎、镇痛、止吐等对症治疗后症状均缓解。术后1个月再次复查相关实验室指标,已恢复至术前水平。本研究结果说明DEB-TACE治疗消化道肿瘤肝转移近期疗效确切,技术安全、可行。
治疗中需要注意因肝转移癌多缺乏血供,需术中结合影像学检查结果,超选择供血动脉后造影,必要时增加对比剂剂量并延长曝光时间,以充分显示病灶。特别强调在重视肝转移癌局部治疗的同时,要兼顾全身治疗,如内科化疗、靶向治疗等,局部与整体相结合,以达到最佳疗效。DEB-TACE治疗消化道肿瘤肝转移的远期疗效还有待于大样本前瞻性随机对照研究。