甘露寡糖的生理功能及其在畜禽生产中的研究进展
刘事奇, 贺宇佳, 沈煜政, 李柏珍, 伍树松*
(1.湖南农业大学动物科学技术学院,湖南长沙 410128;2.湖南农业大学动物医学院,湖南长沙 410128)
甘露寡糖(MOS)又称甘露低聚糖、葡甘露寡聚糖,其是从酵母培养细胞壁中提取的一类抗原活性物质,广泛存在于多种微生物细胞壁内,以及田菁胶、魔芋粉、瓜儿豆胶等植物的种子和块茎中。有研究发现,MOS具有多种生物学活性,可增强动物免疫、调节糖脂代谢和维持肠道健康,并具有促生长和抗氧化等作用 (Wang等,2018;李玉欣,2015)。MOS安全无毒,并具有低热、稳定等良好的理化性质,与其他添加剂产品联用不会产生不良作用,国内外已将其作为添加剂广泛应用于食品和动物饲料中(赵晓峰,2008)。本文通过综述MOS制备方法、生理功能及其在畜禽生产中的研究进展,以期为进一步探索其在畜禽生产中的应用提供参考。
1 甘露寡糖的理化性质
MOS属寡糖的一类,由几个甘露糖分子或甘露糖和葡萄糖主要通过α-1,2糖苷键、α-1,3糖苷键、α-1,6 糖苷键、β-1,4 糖苷键或 β-1,3 糖苷键连接而成(姚喜梅,2011)。不同来源的MOS理化性质有所区别,MOS易溶于水,不溶于有机溶剂,和有机溶剂共存可产生沉淀或结晶。MOS有一定黏度,且黏度与温度成反比关系,另外,当pH为1.5~3时,黏度上升;pH为3~9时,黏度比较稳定(陈小瑛,2017)。某些分子量为20~2000万的MOS具有一定凝胶方面的作用 (杨华等,2005)。MOS结构性质较稳定,含有大量不能被淀粉酶水解的化学键,以多糖混合物的形式存在(梁永等,2013)。
2 甘露寡糖的制备方法
目前MOS的主要制备方法有:(1)降解法,如酶降解法、氧化酸化降解法、超声波降解法和辐照改性降解法等;(2)合成法,如微波固态合成法。由于合成法成本高、技术难度大,目前工业生产MOS多采用降解法。
2.1 降解法 多糖在190℃条件下可发生自动水解(Carvalheiro等,2004),通过电离辐射如 c射线、微波和水热处理可发生解聚(Devin等,2010;Singh 等,2009)。弱酸(H2SO4)可将含羞草种子的半乳甘露聚糖水解成 MOS(Joana等,1995);强碱(NaOH)可水解解聚植物细胞壁的甘露聚糖,用强酸(HCl)进一步中和可以生产甘露寡糖(Mia等,1995)。降解法制备MOS分为制备甘露聚糖和降解甘露聚糖两步。李颍等(2015)采用热水浸提法制备葡萄酒泥酵母甘露聚糖,最优提取工艺条件为:料液比 1∶23(g/mL)、浸提温度 124 ℃、浸提时间5 h、浸提次数3次,甘露聚糖得率为14.27%。甘露聚糖的降解方法因其来源不同而有所差异,刘紫征(2016)采用单因素试验和正交试验发现,酶解(β-甘露聚糖酶)制备MOS的最佳反应条件为:降解温度50℃、降解pH 5.5、反应时间2 h、酶底比150 U/g,目标MOS得率为65.72%。陈小瑛 (2017)通过正交试验,确定从废弃酵母制备MOS的最佳工艺条件为:木瓜蛋白酶浓度2.25‰、酶解时间6 h、碱温度45℃、碱解时间5.5 h和液碱物质的量浓度0.5 mol/L;通过平行中试测得MOS平均得率为2.14%,平均含量为40.96%。
2.2 合成法 以单糖或双糖为底物,微波固态合成低聚糖反应速度快,合成产率高且清洁无污染。李新明(2008)发现,以甘露糖和葡萄糖为反应物微波固态合成MOS的最适反应条件为:微波功率1000 W、微波处理时间4 min、引发剂添加量15%、催化剂添加量3%,合成产率为86.50%。高效液相色谱分析初产物MOS成分:单糖占13.50%,二糖占3.82%,三糖占7.56%,四糖占6.84%,五糖占4.77%,六糖占5.54%,七糖及以上占57.97%。
3 甘露寡糖主要的生物学功能及其作用机制
3.1 抗氧化 反应性活性氧簇(ROS)作为机体内最常见的自由基,包括超氧离子(O2-)、羟自由基(·OH)和单线态氧等,自由基过多会对机体造成危害。细胞内游离的Fe2+与·OH反应生成ROS(徐文哲,2018),Fe2+的沉积可导致氧化应激。MOS具有清除自由基的作用(和智坤等,2013)。杨学山等(2015)通过体外试验发现,MOS 对·OH、O2-、二铵盐 (ABTS+·)、1,1-二苯 基-2-三硝 基苯 肼(DPPH)自由基和螯合Fe2+均具有良好的清除效果。李新明(2008)经动物试验发现,MOS通过增加过氧化氢酶(CAT)、超氧化物岐化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、Na+-K+-ATP酶的活性和谷胱甘肽(GSH)的含量,增强小鼠总抗氧化能力(T-AOC)。丙二醛(MDA)是脂质过氧化产物,具有细胞毒性,MDA的含量可反映脂质过氧化及氧化应激水平 (Quan等,2014)。郭云贵等(2010)研究表明,MOS可显著降低三黄鸡血清、肝脏、心肌和肌肉MDA含量。因此MOS作用机制可能是通过自身的理化性质与细胞中的自由基等反应(张帅,2018),起到清除自由基的作用,发挥抗氧化功能;另一方面,MOS可激活体内的抗氧化酶系统,提高抗氧化酶活性和抗氧化物含量,并抑制脂质过氧化,进而维持机体抗氧化平衡。
3.2 免疫调节 MOS本身为抗原活性物质,具有一定免疫原性,可诱导机体产生免疫应答(李国辉等,2017),并且能作为外源抗原的佐剂与某些毒素、病毒和真菌细胞表面结合(寇庆等,2012),以增强机体对抗原的免疫应答或改变免疫应答类型,从而增强动物机体的细胞和体液免疫。MOS除了具有辅剂和抗原特性,还能和免疫细胞表面蛋白质受体发生反应,干预淋巴结和黏膜固有层记忆细胞上的信号系统以发挥免疫调节作用 (陈小兵等,2005),并可以通过激活补体系统提高天然抗感染免疫的功能(熊阿玲,2014)。
3.2.1 提高非特异性免疫和特异性免疫 一方面,MOS通过提高免疫器官指数和促进天然免疫相关基因表达(熊阿玲,2014),提高机体非特异性免疫功能;另一方面,MOS可促进T、B淋巴细胞增殖、提高 CD4+/CD8+比值(李新明,2008),激活Toll样受体(TLR)信号通路关键分子(段绪东,2013),进而提高机体特异性免疫。研究表明,MOS可显著提高小鼠吞噬细胞吞噬指数、红细胞计数、胸腺指数和50%CH50的含量,增强动物体的非特异性免疫(沈文康等,2015)。MOS能不同程度地上调肉鸡组织天然免疫相关基因AvBD9、TLR2、TLR4和Cath-B1的表达,通过提高肉鸡组织TLRs表达并由TLRs介导上调p-防御素和Cathelicidins等抗菌肽表达而提高肉鸡天然免疫防御功能(熊阿玲,2014)。李新明(2008)研究表明,动物经衰老造模后,组织各项免疫指标显著下降,MOS可显著提高衰老小鼠的肝脏、肾脏、脾脏和胸腺指数以及血清中免疫球蛋白IgA、IgG和IgM水平;在刀豆蛋白A(ConA)刺激下,MOS使胸腺T细胞的增殖指数和脾脏淋巴细胞转化率显著提高,从而提高衰老模型小鼠的体液免疫和细胞免疫水平。另外,MOS一方面可激活TLR信号通路关键分子,提高仔猪空肠组织免疫反应的灵敏性,另一方面可通过抑制肠系膜淋巴结中TLR信号通路的过度激活,最终改善仔猪的肠道免疫(段绪东,2013)。
3.2.2 抗炎症 炎症是损伤因子诱导机体所发生的防御反应。一般情况下,炎症反应是由外源性物质和组织损伤产物诱发,并伴随着促炎细胞因子的产生、免疫细胞的募集和活化以及自由基的产生。白细胞介素(IL)为免疫因子,包括 IL-2、IL-4、IL-10等,可下调炎症介质因子促进机体免疫反应(Liang 等,2012)。 Che等(2013)研究发现,MOS可提高血清IL-10含量和白细胞、淋巴细胞数量,降低机体炎症反应的强度。在葡聚糖硫酸钠(DSS)诱导的急性结肠炎小鼠模型中,MOS使结肠黏蛋白2表达正常化并减弱促炎细胞因子IL-1α,IL-1β,IL-6 和单核细胞趋化蛋白 (MCP)-1以及Toll样受体TLR4和NLRP3炎性小体的局部表达。MOS保护作用可能是通过局部巨噬细胞直接介导的,在脂多糖(LPS)诱导的小鼠巨噬细胞(RAW264.7)模型中,MOS 可以抑制 IL-1α、IL-1β、IL-6和粒细胞集落刺激因子(G-SCF)的产生(Szilamer等,2016)。 可见,MOS 通过调节非免疫和免疫基因表达,可促进免疫因子产生,进而发挥抗炎功效。
丝裂原活化蛋白激酶(MAPKs)和核转录因子-κB(NF)是调节炎症反应的重要下游信号传导通路(Kim等,2006)。炎性介质过量可使NF-κB活化,使其脱离抑制蛋白-κB(IκB),并进入细胞核诱导炎性介质基因的表达,从而加重炎症反应(Joel等,2002)。而 MAPKs家族蛋白 ERK、JNK 和p38调节炎症反应时是针对NF-κB的调节介质(Matthew 等,2014)。 据 Zhou 等(2015)报道,MOS可显著降低LPS与小鼠巨噬细胞RAW 264.7细胞表面的结合以及LPS诱导的TLR4和分化簇(CD)14的表达;显著抑制 LPS诱导的 RAW 264.7细胞 NF-κB和 MAPKs的激活途径,MOS通过阻断NF-κB和MAPKs的激活而减少LPS引起的炎症反应。另外,MOS通过抑制由LPS诱导的肿瘤坏死因子 (TNF)-α和干扰素 (IFN)-γ的增加(Pourabedin等,2016),发挥抗炎功能。
3.3 调节微生物菌群和维持肠道健康 有研究发现,MOS在体外具有良好的抑菌效果(Bozkurt等,2016;杲龙,2016)。MOS通过促进乳酸杆菌产生乳酸来降低pH,从而有效地抑制致病性大肠杆菌的生长(杭苏琴,2007)。在沙门氏菌(或大肠杆菌)与Caco-2细胞的黏附和抑制黏附试验中,MOS具有抑制沙门氏菌和大肠杆菌黏附的作用,且浓度为0.0005~0.005 mol/L时MOS对沙门氏菌的抑制存在剂量效应,抑制黏附效果为:α-甘露二糖>β-甘露二糖≥甘露葡二糖(杲龙,2016)。
肠道作为机体内最大的免疫隔室,具有预防黏膜感染和调节微生物定植等功能 (Mehmet等,2010)。MOS可增加肠道中双歧杆菌和乳酸杆菌等有益菌数量(刘紫征,2016),减少大肠杆菌等有害菌数量(刘卫东等,2011),并提高肠道微生物的多样性(Hang等,2012),进而改善肠道菌群组成。王洪善等(2018)研究发现,MOS能够选择性地调节一些微生物,显著提高艾克曼菌、乳酸菌和双歧杆菌等益生菌的相对丰度。另外,MOS可修复肠道损伤,维持肠道健康。李玉欣(2015)研究发现,在大肠杆菌攻毒试验中,MOS降低未攻毒时肠道黏膜中TLR4和IL-1β的mRNA表达量,增加大肠杆菌攻毒后上皮细胞间淋巴细胞和杯状细胞数量,MOS通过调节肠道黏膜细胞因子的基因表达和改变肠道免疫细胞数量来提高机体局部免疫反应,进而维持肠道健康。紧密连接是肠黏膜上皮细胞之间主要连接方式,对维持肠黏膜屏障机械结构的完整和正常功能具有重要作用(陈婷,2016)。最重要的三种紧密连接蛋白是ZO-1、Occludin和Claudins(Zhang 等,2015)。 吴士(2017)研究发现,MOS对肠上皮细胞具有一定修复功能,与LPS损伤组相比,MOS使Caco-2细胞活性显著上调,IL-6、TNF-α、IL-1β mRNA 表 达 显 著 下 调 ,Claudin-1、ZO-1、MUC-2 mRNA 表达显著上调,ZO-1蛋白表达上调,这表明MOS能对LPS引起的Caco-2细胞损伤进行修复。
3.4 调节糖脂代谢 MOS具有调节糖脂代谢的功效。在高脂(HFD)小鼠模型中,MOS可降低肝脏和血清甘油三酯(TG)水平,显著增加粪便TG含量以及排泄的脂肪含量(Izumi等,2006)。高启禹等(2012)通过腹腔注射四氧嘧啶构建糖尿病小鼠模型发现,MOS可显著降低小鼠的TG、血糖和胆固醇 (CHO)的水平,而高密度脂蛋白胆固醇(HDL-C)水平显著升高,且高剂量的MOS降糖脂效果优于低剂量。肠道中的短链脂肪酸以乙酸、丙酸和丁酸为主。乙酸、丙酸和丁酸可通过调节宿主的能量摄取和消耗来控制体重(Dinesh等,2017),并有助于减轻高脂饮食造成的体重增长(Den等,2015)。王洪善等(2018)研究发现,MOS能够显著提高正常及高脂饮食小鼠盲肠中乙酸、丙酸和丁酸的含量,有效减缓高脂饮食造成的小鼠体重增长,提高小鼠肠道菌群脂代谢的能力。Silvia等(2015)研究发现,MOS可促使机体优先保留长链多不饱和脂肪酸(LC-PUFA),降低作为β-氧化底物的脂肪酸水平,借以改变肝脏和肌肉脂肪酸成分,这与肝脏中去饱和酶基因表达降低有关。此外,MOS可通过影响肠相关淋巴组织相关参数和调节肌肉和肝脏中的脂质代谢来促进LC-PUFA积累以及β-氧化。 瘦素是一种主要由脂肪细胞产生的蛋白质,其可通过抑制饥饿来调节能量平衡。Wang等(2018)研究发现,HFD小鼠瘦素基因转录水平显著升高,而添加MOS使瘦素基因转录水平显著降低,进而抑制HFD小鼠的体重增加和脂肪蓄积;另外,MOS可通过降低HFD小鼠脂联素基因转录水平来减轻HFD诱导的胰岛素抵抗和葡萄糖不耐受。
4 甘露寡糖在畜禽生产中的应用现状
4.1 在猪生产中的应用 在猪生产中,MOS具有促进生长、改善饲料报酬、增强动物免疫、提高抗体效价和改善肉品质等作用 (Porntrakulpipa等,2016;Su 等,2016)。Zhao 等(2012)研究发现,添加0.1%MOS不仅能显著改善断奶仔猪的生长性能,还能显著提高干物质和氮的消化率,显著降低仔猪的腹泻率。另外,有报道指出MOS并不能改善动物的生长性能(Hrvoje等,2016)。中和抗体是具有吸附穿入功能的病毒表面抗原刺激机体产生的抗体。Porntrakulpipat等 (2016)研究表明,400 ppm MOS能有效增强PRRS特异性抗体,但不适用于中和抗体;800 ppm MOS可显著增强中和抗体。由此可见,在母猪饲料中添加MOS有助于增强母猪PRRS疫苗接种作用。综上所述,对于MOS促生长作用报道趋于正效果,但其作用机制需进一步探究。近几年国内外MOS在猪中的研究报道见表1。

表1 甘露寡糖在猪生产中的主要研究与应用
4.2 在家禽中的应用 在肉鸡生产中,MOS可促进LUM、LYZ和APOA1等与肠道健康密切相关的基因表达,进而调节肠道的免疫反应和保护动物免受肠道致病细菌的毒害,来维持肉鸡肠道健康(Xiao等,2012)。 武威等(2017)研究发现, 50、75 mg/kg MOS可显著提高肉仔鸡的体重和采食量,其中50 mg/kg MOS显著改善了饲料报酬;MOS还可显著提高 CAT、SOD活性,GSH-Px活性、T-AOC有提高趋势,MOS适宜添加量为50 mg/kg。宋新磊等(2018)研究发现,MOS可显著提高肉鸡血液IgA和IL-2的含量,可增强机体免疫力。此外,MOS具有一定缓解肉鸡热应激作用(Sohail 等 ,2010)。 在 蛋 鸡 研 究 中 ,Zaghini 等(2005)研究表明,MOS具有吸附降解黄曲霉毒素B1(AFB1)的能力,可降低 AFB1在胃肠道的吸收量。Bozkurt等(2016)研究发现,蛋鸡日粮中添加MOS可显著改善其产蛋量、蛋重及饲料报酬,提高抗氧化能力,并减少盲肠后段致病菌数量。综上所述,家禽饲粮中添加适量MOS具有改善生长性能、增强免疫及提高抗氧化能力等多种生理功能,但MOS的作用机制有待深入研究。近几年国内外MOS在家禽中的研究报道见表2。
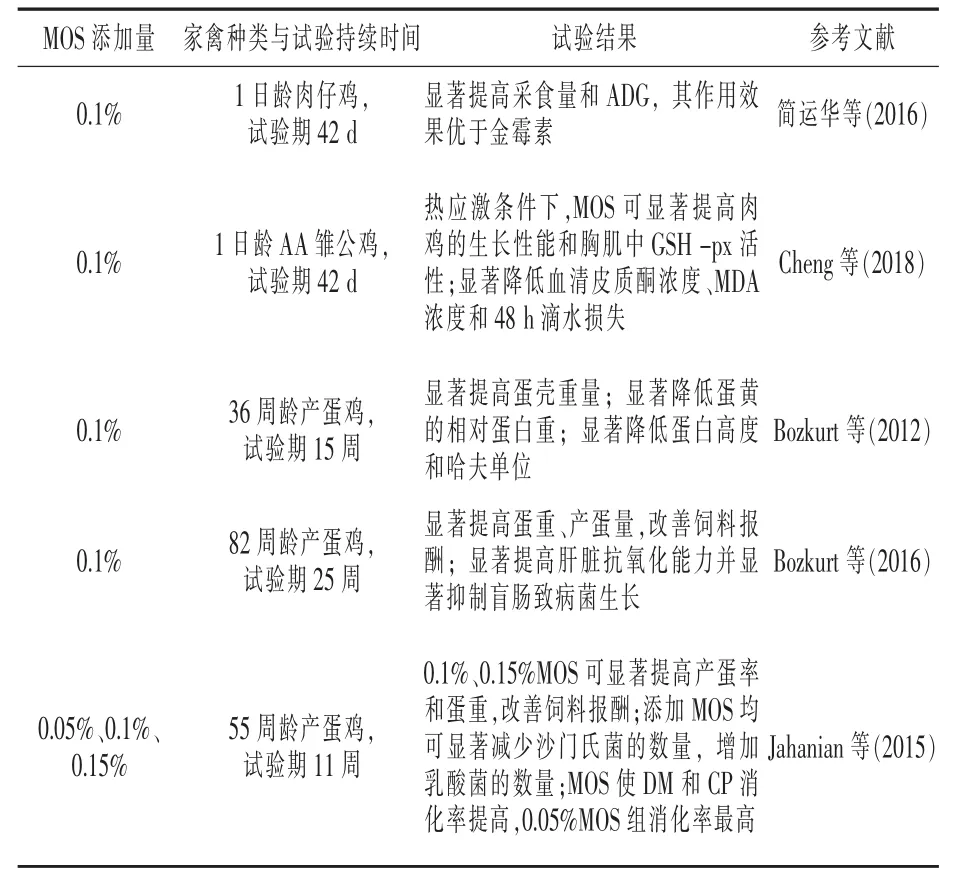
表2 甘露寡糖在家禽生产中的主要研究与应用
4.3 在反刍动物中的应用 MOS在反刍动物中的研究相对较少。肖宇(2012)研究发现,MOS可显著降低山羊瘤胃pH;显著降低血清MDA含量和谷丙转氨酶(ALT)活性,显著提高血清中球蛋白和血清磷含量;显著提高21 d时血清IgA、7 d和14 d血清IgM的含量,MOS具有改善山羊瘤胃发酵参数和增强免疫的作用。谢欣明等(2018)发现,MOS可改善蒙古羊生长性能和免疫性能。MOS可提高犊牛ADG和饲料报酬,提高血清中免疫球蛋白含量和粪便中双歧杆菌数量,降低粪便中大肠杆菌数量 (金亚东等,2016)。郭婷婷等(2017)报道,MOS可显著提高奶牛瘤胃中总的挥发酸及氨态氮的含量,其中瘤胃液中乙酸含量极显著增高;乳脂率显著提高,乳中体细胞数降低。Westland等(2017)研究发现,MOS可显著提高奶牛初乳重,具有改善生长性能的作用。
5 结语
甘露寡糖作为一种新型饲料添加剂,现已被广泛应用于饲料行业。但在应用过程中仍有一些问题还未解决,这制约了其在养殖业中的推广应用。今后应加大甘露寡糖在动物体内的作用机制;动物不同阶段甘露寡糖的添加方式及其适宜添加量;甘露寡糖与其他饲料添加剂联用的作用效果;甘露寡糖与动物肠道菌群之间的互作等方面的研究。随着研究的不断深入和相关作用机制的进一步明确,甘露寡糖将得到更加合理和广泛的应用,并更大限度地发挥其应用价值。

