自然老化与人工老化对燕麦种子的遗传完整性分析比较
方青慧, 刘 欢, 赵桂琴, 文 铜, 王 婷, 孙守江, 许 铭
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心, 甘肃 兰州730070)
皮燕麦(AvenasativaL.)和莜麦(AvenanudaL.)均为禾本科燕麦属(AvenaL.)一年生草本植物,前者籽粒带稃,为世界广泛栽培种,主要分布在加拿大,澳大利亚和美国等地,后者外稃易与籽粒分离,称为裸燕麦,玉麦、铃铛麦[1-2],主要分布在我国东北、华北及西北地区。燕麦是优质高产的粮、饲兼用作物,随着种草养畜配套技术的蓬勃发展,我国燕麦种植面积不断扩大,种子需求量也逐年增加[3-4]。优质的种子是农业可持续发展的基础,成功地贮藏种子具有重大意义。近年来,高品质燕麦籽粒的需求不断增加,并在食品工业中得到了积极的应用[5],我国目前种质资源保存最普遍的方法是种子贮藏,而国内由于牧草种子生产技术落后,产量低且质量差,国产牧草种子的质量合格率仅为50%[6-7]。种子从形成、发育到成熟,再到仓库贮藏,时刻受到外界环境的影响。种子生理成熟时,活力最高,随后衰老而走向死亡,相应的活力也越来越低,即发生劣变和老化[8-9]。研究种子劣变过程及相关机理,可尽量减少因种子劣变导致质量下降所带来的经济损失。
种子活力是决定农业成败的最基本因素,在老化过程中,线粒体受损,呼吸速率和氧化磷酸化效率降低[10],这不仅影响种子质量,并直接影响种子萌发与幼苗生长,最终影响植株生长后期的产量与品质[11]。种子活力的降低经常伴随着生理生化特性改变,或是植物细胞中染色体、蛋白质和DNA水平的异变,这种现象在脂肪类(油菜BrassicacampestrisL.)、淀粉类(小麦TriticumaestivumL.)和蛋白类(大豆Glycinemax(L.) Merr.)等作物和牧草种子中均有研究[12-15]。近年来,国内外学者多利用醇溶蛋白标记、分子标记等遗传分析手段检测燕麦种质遗传多样性,而相关燕麦老化种子的遗传完整性研究较少[16-17]。因此,本研究以贮藏不同年限的皮燕麦和莜麦种子为自然老化材料,另外,利用高温高湿法将种子人工老化,探究皮燕麦和莜麦不同种质种子贮藏过程中醇溶蛋白遗传完整性的变化,进一步揭示2种老化方式在种质遗传完整性上的差异,为燕麦耐储藏性遗传机理的研究奠定基础,并为禾本科牧草遗传完整性的检测和种子的繁殖更新标准提供科学的方法和依据。
1 材料与方法
1.1 材料
由甘肃农业大学草业学院提供皮燕麦品种‘陇燕3号’和莜麦品种‘白燕2号’种子。自然老化种质材料于2012—2016年收获,并在常温仓库(0℃~10℃,室内通风)贮藏1~5年。

表1 皮燕麦、莜麦的人工老化和自然老化各处理Table 1 Treatments of A. sativa L. and A. nuda L. under artificial aging and natural aging
1.2 人工老化处理
选取2016年秋季收获的皮燕麦、莜麦种子,测定初始含水量,参照国际种子检验协会提供的老化方法[18],将种子置于高温、高湿条件下(温度45℃,相对湿度100%)进行人工老化处理。设定光照培养箱为黑暗24 h,温度45℃。老化处理时间分为24 h,48 h,72 h,96 h共4个处理梯度,每个梯度取100 粒燕麦种子,置于培养皿中,保持干燥器内相对湿度(Relative Humidity,RH)为100%,以未老化种子为对照(Control Check,CK)。老化完毕后取出种子,晾3~4 d,使种子含水量降至原状态,4℃冰箱中保存备用。
1.3 种子发芽率测定
取自然老化及人工老化各处理的皮燕麦和莜麦种子放入培养皿,每皿50粒,4次重复,参照牧草种子检验规程[19]中燕麦标准发芽条件进行发芽实验,发芽床铺两层滤纸,每天光照8 h,温度为25℃,黑暗16 h,温度为 15℃,第10 d统计发芽率,取平均值。
1.4 燕麦种子醇溶蛋白测定
采用考马斯亮蓝法[20]测定燕麦种子醇溶蛋白含量:取10 mL离心管,加入100 uL蒸馏水,5 mL考马斯亮蓝G-250作为对照,在若干支试管中依次加入5 mL考马斯亮蓝G-250,100~0 uL蒸馏水(以20 uL为梯度依次递减),0~100 uL 0.4 mg·mL-1的标准蛋白溶液(以20 uL为梯度依次递增),利用分光光度计测量A595值,以标准蛋白质质量(ug)为横坐标,吸光度A595为纵坐标,作图得到标准曲线为y=0.0046x-0.0376(R2=0.9923)。利用标准曲线计算其醇溶蛋白含量。
1.5 酸性聚丙烯酰胺凝胶电泳
取自然老化及人工老化皮燕麦和莜麦种子,从不同处理中随机取样30 粒,放入研钵中研磨至粉末状,加入1 mL 25%2-氯乙醇和5%丙三醇混合体系,室温下进行提取过夜,保存在4℃下备用[21]。使用ISTA(1986)颁布的酸性聚丙烯酰胺凝胶电泳(Acid polyacrylamide gel electrophoresis,A-PAGE) (pH=3.2)标准程序(改进)对处理样品的醇溶蛋白进行电泳分析[22-23]。使用垂直板电泳槽(型号SQ-189)和电泳仪(型号DYY-6D型),电压300 V,控制温度为10℃~15℃,恒压电泳135 min。5 mL 1%的考马斯亮蓝及三氯乙酸溶液组成的混合液中固定染色 24 h,冲洗后拍照。
1.6 数据分析
按照条带的有无分别赋值,有带记为1,无带记为0,并观察蛋白质分子的迁移率,把相同迁移率的谱带视为同一条带,每一条带视为一个位点,在Excel 2010中进行相关数据统计,统计数据用Popgene 32 软件进行遗传参数分析。
2 结果与分析
2.1 自然老化和人工老化下燕麦醇溶蛋白电泳图谱的变化
根据皮燕麦和莜麦种子醇溶蛋白PAGE电泳图(图1)所示,不同贮藏年限的燕麦种子醇溶蛋白电泳条带随着种子贮藏时间的增长而逐渐模糊。由于贮藏时间梯度仅为1年间隔,不同处理间差异较小,但贮藏5年与贮藏1年之间的条带清晰度差异明显。
图1中,人工老化96 h(AL5,AB5)和未人工老化种子(AL1,AB1)的醇溶蛋白条带差异明显,前者较为模糊且有拖尾现象,可见高温高湿老化会影响醇溶蛋白的性质,使得电泳条带无法分开,且随着老化时间的增加,这种现象愈加明显。另外,人工老化后燕麦种子ω、γ区醇溶蛋白的谱带也发生了变化,说明种子老化后遗传完整性的变化与ω、γ区谱带有关。
不同种质之间,皮燕麦的电泳条带数量明显多于莜麦。比较而言,莜麦‘白燕2号’的醇溶蛋白PAGE图谱的变化程度在人工老化和自然老化条件下均较皮燕麦‘陇燕3号’明显,说明其醇溶蛋白更易发生劣变,老化速度更快。
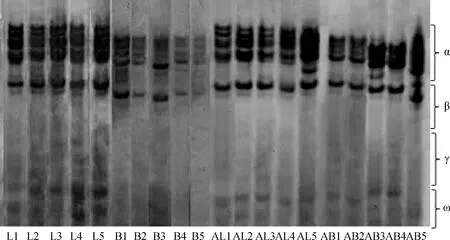
图1不同贮藏年限及人工老化皮燕麦、莜麦醇溶蛋白聚丙烯酰胺凝胶电泳图Fig.1 Gliadin Polyacrylamide gel electrophoresis of A. sativa L. and A. nuda L.in different storage time and artificial aging注:图中序号见表1Note:Numbers in the figure are shown in table 1
2.2 人工老化及自然老化对燕麦种子醇溶蛋白含量的影响
皮燕麦和莜麦种子中醇溶蛋白的含量随着贮藏年限的增加而有所降低(图2)。皮燕麦贮藏4年间(L1~L4)醇溶蛋白含量差异不显著;贮藏1~3年的莜麦(B1-B3)醇溶蛋白含量差异不显著,但第4年后出现显著下降趋势,其劣变速度加快;尤其是贮藏5年皮燕麦和莜麦种子中醇溶蛋白含量与其他年份种质均有显著性差异(P<0.05)。陇燕3号籽粒中平均醇溶蛋白含量为534.356 ug·g-1,白燕2号为480.784 ug·g-1,皮燕麦的醇溶蛋白含量显著高于莜麦(P<0.05)。
同样,随着人工老化时间的延长,皮燕麦和莜麦种子的醇溶蛋白含量也在逐渐降低,人工老化的皮燕麦籽粒中平均醇溶蛋白含量为517.054 ug·g-1,莜麦为437.334 ug·g-1。皮燕麦在老化48 h(AL3)后出现明显下降趋势;而莜麦在老化24 h(AB2)后下降趋势明显。可见,皮燕麦较莜麦醇溶蛋白含量下降较慢,较为耐贮。
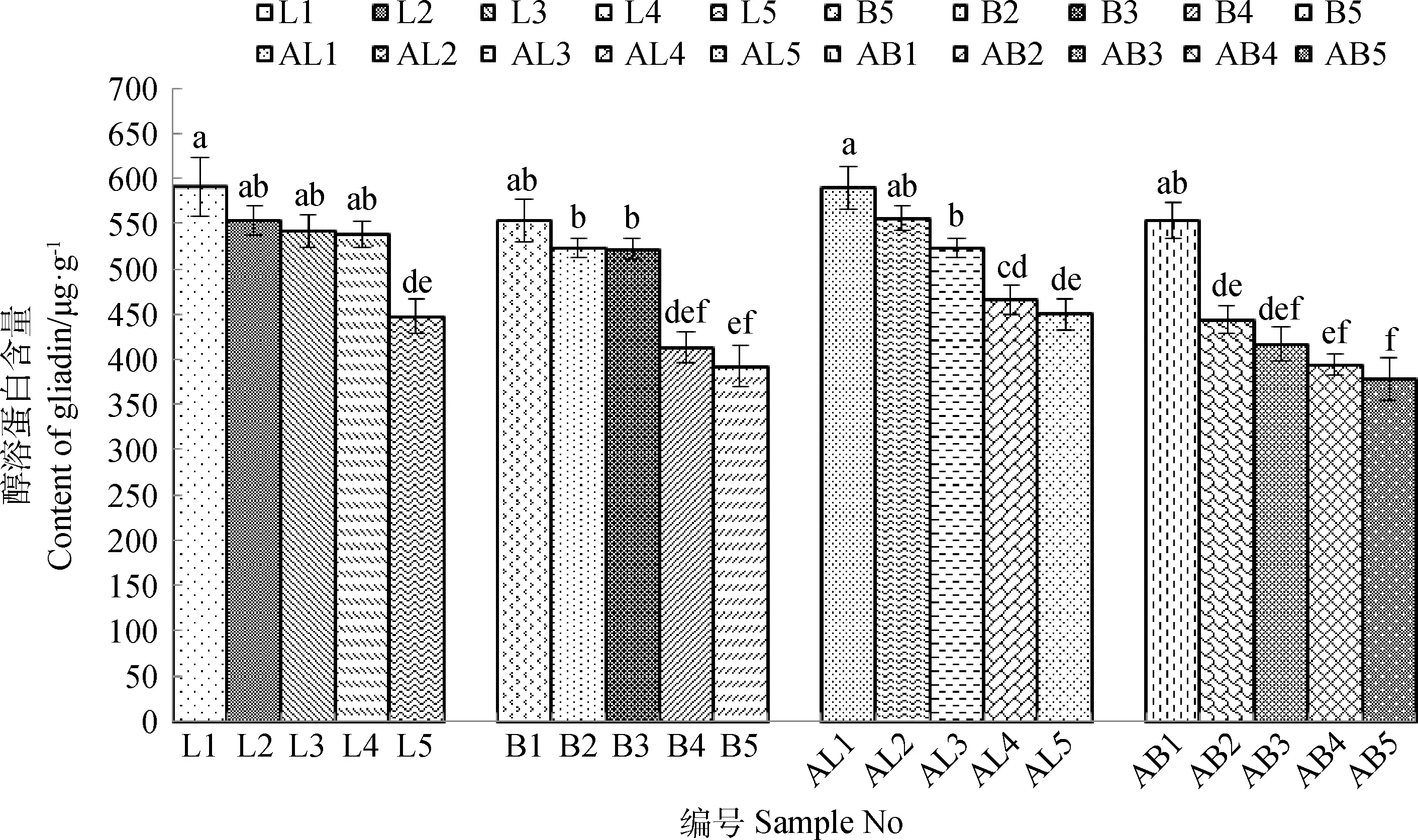
图2 不同贮藏年限及人工老化皮燕麦和莜麦醇溶蛋白含量Fig.2 Content of gliadin of A. sativa L. and A. nuda L.in different storage time and artificial aging注:图中序号见表1,下同Note:Numbers in the figure are shown in table 1,the same as below
2.3 人工老化与自然老化对燕麦发芽率的影响
图3所示,人工老化与自然老化对燕麦发芽率均有影响,随着贮藏年限及人工老化时间的增加,皮燕麦和莜麦的发芽率均呈下降趋势,且人工老化后燕麦种子的发芽率降低程度较自然老化显著。总体来看,不同贮藏年限下的皮燕麦发芽率显著高于莜麦,且贮藏年限对莜麦发芽率的影响较皮燕麦更加明显。贮藏1年莜麦发芽率超过90%,随后降幅逐年增大,第5年发芽率降至54%,而贮藏1~5年皮燕麦发芽率均达到80%以上。高温高湿人工老化处理72 h,96 h后的发芽率与对照组差异显著(P<0.05),且人工老化处理对莜麦发芽率影响大于皮燕麦。
2.4 人工老化与自然老化下燕麦A-PAGE遗传分析
对人工老化与自然老化皮燕麦和莜麦A-PAGE进行遗传分析(表2),共检测到41个等位位点,其中多态性位点有37个,每个位点平均等位基因为1.902,平均Nei’s信息指数为0.360,平均Shannon信息指数(I)为0.523。自然老化下皮燕麦和莜麦扩增出的多态性条带比例分别为70%,64.865%;人工老化条件下皮燕麦和莜麦的多态性条带比例为59.459%,57.143%。显然,人工老化后皮燕麦以及莜麦的多态性降低明显。
本研究利用Popgen 32软件中各遗传参数分别估计了自然老化和人工老化各群体的遗传变异。与自然老化相比较,人工老化燕麦种子的Na,Ne,H,I这4 个指标都有所下降(表3),由此表明,人工老化更易于破坏燕麦种质资源遗传完整性。自然老化条件下,皮燕麦H值为0.215±0.221,I值为0.313±0.312,莜麦H和I 值分别为0.191±0.212,0.280±0.305。可见,皮燕麦的遗传多样性稍高于莜麦。
遗传相似性分析(附表4)表明,随着贮藏年限的增加,皮燕麦和莜麦的遗传相似性逐年降低,种子贮藏年限相隔越远,其相似性系数越小。各种老化处理燕麦种子的平均相似性系数为0.637,自然老化下皮燕麦遗传相似系数在0.976~0.781间,莜麦为0.927~0.732;人工老化各处理皮燕麦遗传相似系数为0.951~0.732;莜麦为0.902~0.707。
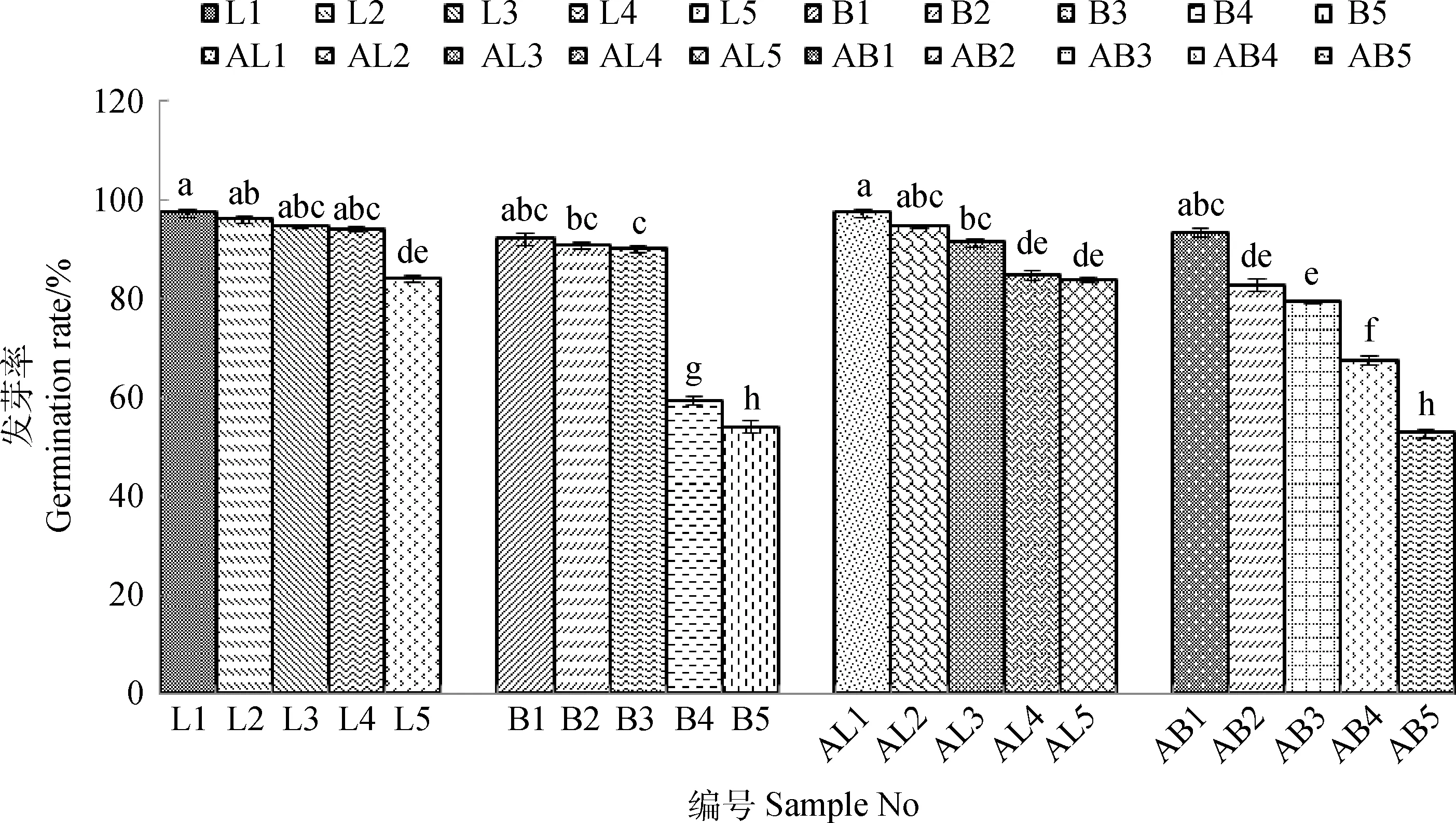
图3 人工老化与自然老化下皮燕麦和莜麦的发芽率Fig.3 Germination rate of A. sativa L. and A. nuda L. in artificial aging and natural aging treatments
表2 人工老化与自然老化皮燕麦、莜麦A-PAGE分析的遗传变异Table 2 Genetic variation of artificial aging and natural aging in A. sativa L. and A. nuda L. based on A-PAGE analysis

群体 Population多态性位点数 K多态性等位基因数 Np多态性条带比例数 PPB/%L142870B122464.865AL112259.459AB102057.143
注:L,B分别表示自然老化下的皮燕麦、莜麦群体;AL,AB分别表示人工老化下的皮燕麦、莜麦群体。下同
Note:L and B representA.sativaL. andA.nudaL. under natural aging,respectively;AL and AB representA.sativaL. andA.nudaL. under artificial aging,respectively.The same as below
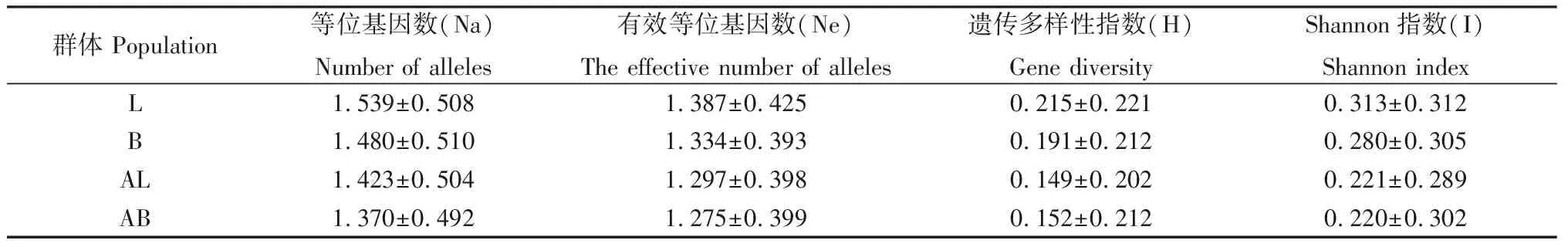
表3 人工老化与自然老化皮燕麦和莜麦的遗传参数分析Table 3 Genetic parameters analysis of A. sativa L. and A. nuda L. in artificial aging and natural aging treatments
3 讨论
3.1 自然老化与人工老化对皮燕麦和莜麦种子遗传完整性的影响
当前种质保存工作的核心是维持种质的遗传完整性,即维持种质在贮藏及繁殖更新过程中最低程度的遗传改变,保持群体的基因频率分布、等位基因频率分布的稳定及遗传结构的完整[12,16]。本研究对2012—2016年收获贮藏的皮燕麦和莜麦遗传完整性探究,醇溶蛋白图谱显示随着燕麦种子贮藏时间和人工老化时间的增加,电泳条带趋于模糊,并伴有条带消失,表明A-PAGE方法可以显示老化燕麦籽粒中醇溶蛋白的变化。人工老化使得燕麦种质醇溶蛋白条带不能完全分开且出现拖尾现象。尤其是人工老化96 h后皮燕麦和莜麦种子醇溶蛋白条带均极为模糊,说明此条件下燕麦种子老化程度过高,因此建议高温高湿人工老化燕麦种子条件应低于96 h。与测定的醇溶蛋白含量相结合,共同表明自然老化条件下皮燕麦和莜麦种子醇溶蛋白含量有明显下降,尤其是在贮藏5年后,下降趋势显著。谭富娟等[24]利用种子活力测定的方法发现长期贮存的燕麦种子生活力会逐渐降低,遗传完整性会遭受破坏。王小丽[26]对扁蓿豆(MedicagoruthenicaTrautv)种质资源遗传完整性的研究也有相似结论。本研究发现贮藏4年内的燕麦籽粒A-PAGE的条带数目变化并不十分明显,这可能是由于燕麦属于自交植物,杨苗苗等[9]指出裸燕麦种子老化处理研究适宜的样本量是50~70株,而本研究中30个取样群体数量相对较少;另外,同种燕麦种质中编码醇溶蛋白的基因相同,聚丙烯酰胺凝胶电泳与其他分子标记相比,反映的条带数较少,无法表现种质细微差异;但是A-PAGE方法操作简单,无需进行DNA提取和PCR操作,同样能检测出不同种质之间的多态性水平,结果稳定可靠,因此仍可用于燕麦种子劣变老化研究。
种子劣变老化遗传完整性研究还要结合遗传学等学科,对其遗传参数进行分析研究。与自然老化相比较,人工老化皮燕麦和莜麦种子的Ne,H,I,PPB等遗传参数均有下降。宿宇等[27]、王欣欣等[28]利用醇溶蛋白及分子标记的方法对老芒麦(ElymussibiricusL.)、扁蓿豆种子遗传完整性研究也有同样发现,即人工老化后种子的遗传多样性水平有所下降,进一步说明人工老化对燕麦种子遗传完整性的破坏更加显著。在种子老化过程中,种子活力逐渐降低,一些醇溶蛋白编码基因的DNA序列顺序改变或者丢失,对其遗传完整性维持产生不利影响,使得其遗传多样性指数逐渐降低,本研究中皮燕麦、莜麦的相似性系数逐渐降低,而且老化时间越长,其相似性系数越低。相关大豆[12]、老芒麦[28]、紫花苜蓿(MedicagosativaL.)[35]种质种子遗传完整性的研究结果均验证了这一点。此外,皮燕麦和莜麦各种老化处理的平均相似性系数为0.637,进一步说明皮燕麦与莜麦不同种质之间的遗传差异。
3.2 自然老化与人工老化对皮燕麦、莜麦种子发芽率的影响
发芽率测定进一步验证了劣变对燕麦种子活力及质量的影响[29]。本试验中随着种子贮藏年限的增加,皮燕麦和莜麦种子的发芽率均呈下降趋势,且人工老化较自然老化对种子发芽率的影响更加显著,发芽率变化趋势与PAGE醇溶蛋白结果相互应证。任守杰等[25]利用醇溶蛋白电泳技术,发现不同繁殖年份的20份小麦种质更新时较高的发芽率是维持异质性种质遗传完整性的关键因素。孔治有等[30]、王玉娇等[31]、Manuela等[32]同样发现小麦、大麦(HordeumvulgareL.)种子发芽率、发芽指数、活力指数均随着老化处理时间的延长而呈显著下降趋势。可见在种子贮藏过程中,种子发生老化而引起种子的质量发生劣变是不可避免的[33],最终影响种质资源的保存、开发及其利用[34]。
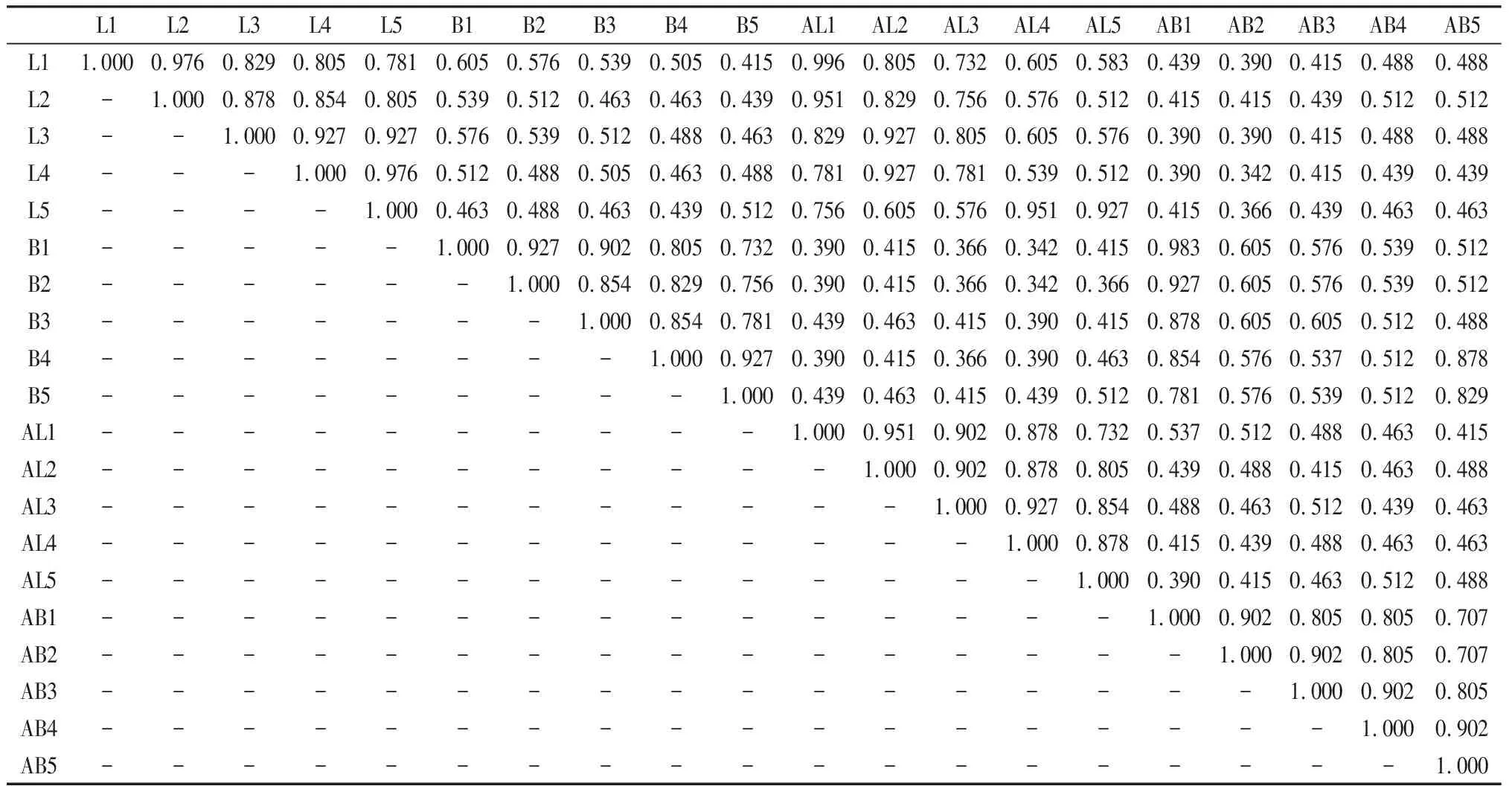
附表4 皮燕麦和莜麦种质在人工老化及自然老化不同处理下醇溶蛋白相似性系数Attached list 4 The similarity coefficient of gliadin under different treatments of artificial aging and natural aging oat germplasm
3.3 自然老化与人工老化对皮燕麦、莜麦不同种质的影响
自然老化和人工老化对于不同种质皮燕麦和莜麦种子的遗传完整性均有一定影响。而且莜麦的劣变程度要高于皮燕麦,其最佳贮藏年限要低于皮燕麦,这可能是由于两者具有不同的形态、性状表现[36]及遗传结构的差异,皮燕麦通常具有较为坚硬稃皮保护,而裸燕麦外稃质薄,收种时籽实与稃皮自然脱离,另外,不同种质籽粒中醇溶蛋白、谷蛋白等贮藏营养物质的差异也会导致劣变程度的不同。皮燕麦和莜麦不同种间的醇溶蛋白含量及A-PAGE遗传变异分析结果表现出一定差异,条带及组合方式完全受基因控制,醇溶蛋白具有高度异质性和复杂性,受环境影响很小[22]。种质遗传完整性还与种子老化、繁殖群体量、收获方式和繁殖地点等因素密切相关。因此,应详细了解应试种子的遗传背景,同时与形态学、生理生化、细胞学、DNA分子标记技术等结合起来,进行全面综合分析,才能准确的反映种子老化对其遗传完整性的影响。
4 结论
本研究利用A-PAGE对老化条件下燕麦遗传完整性进行探究,发现随着燕麦种子老化程度的加深,种子中醇溶蛋白含量及种子发芽率逐渐降低,A-PAGE方法显示老化燕麦籽粒中醇溶蛋白电泳条带明显减少和变弱,遗传多样性降低,遗传变异频率降低,遗传完整性在一定程度上被破坏。高温高湿人工老化对燕麦种子的影响比5年内自然老化更加明显。贮藏1~3年及人工老化0~48 h的皮燕麦和莜麦种子仍可保持较高的遗传多样性及发芽率,且各遗传参数差异不明显,所以,燕麦种子的适宜贮藏年限应保持在1~3年,而不宜超过5年。不同种质之间,莜麦的老化速度在人工老化和自然老化条件下均高于皮燕麦。

