预后营养指数评估小细胞肺癌患者预后的临床价值
薛晶雯,王又君,郭 静,张金洋,吕喜英
(1.承德医学院,河北承德 067000;2.承德医学院附属医院肿瘤科)
肺癌是全球癌症中发病率(占11.6%)和死亡率(占18.4%)最高的恶性肿瘤,据报道2018年全球约176万人死于肺癌[1]。小细胞肺癌(small cell lung cancer,SCLC)在肺癌中所占比例约为15%~20%,且SCLC具有倍增时间短、增殖指数高和早期播散等特点,预后较差。有文献报道,恶性肿瘤患者的预后与营养不良及免疫功能密切相关,其中恶性肿瘤患者营养不良的发生率可达40%~80%[2]。预后营养指数(prognostic nutritional index,PNI)最早应用于胃肠道肿瘤中,是预测手术风险的一个有效的预后指标[3],且可作为多种恶性肿瘤的预后影响因素,如胸膜间皮瘤、非小细胞肺癌等[4-5]。然而,目前关于PNI用于评价SCLC患者预后的研究较少。为此,本研究回顾性分析了承德医学院附属医院261例SCLC患者的临床资料,旨在探讨PNI评价SCLC患者预后的应用价值。
1 材料与方法
1.1 一般资料 选取2013年10月至2018年5月于承德医学院附属医院就诊,经组织病理学确诊的SCLC癌患者261例,其中男180例,女81例,年龄31~78(58±9.05)岁,中位年龄58岁。患者的病理诊断符合2004年WHO肺癌病理分类标准;临床分期基于退伍军人肺癌协会(Veterans Administration Lung Study Group,VALSG)[6]的标准,将SCLC分为局限期(limited disease,LD)81例、广泛期(extensive disease,ED)180例两组。
纳入标准:所有患者均经病理学确诊为SCLC:首次于我院确诊且未接受手术、放化疗及其它治疗;确诊后于我院住院治疗;所有患者均获得有效随访。排除标准:患者同时合并第二原发肿瘤;存在其它免疫系统及血液疾病;患者临床资料不全或随访过程中失访。
1.2 方法 通过电话随访及电子病历系统回顾性收集并整理患者的临床资料,包括:年龄、性别、吸烟指数、临床分期、PNI值、接受治疗情况、总生存时间(overall survival,OS)等。
PNI的计算方法:血清白蛋白(g/L)+5×淋巴细胞计数(×109/L)[7]。OS指患者首次确诊的日期至死亡或随访结束日期(2018年5月),以月份为单位。
1.3 统计分析 使用SPSS 23.0统计软件,P<0.05为差异有统计学意义。计量资料用表示,组间比较采用t检验和方差分析;计数资料用百分率表示,组间比较采用卡方检验。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,通过计算最大Youden指数确定PNI的最佳截断值。采用Kaplan Meier法绘制两组患者生存曲线;Cox比例风险模型进行单因素分析和多因素分析。
2 结果
2.1 ROC曲线 261例患者PNI值为46.99±6.54。以患者是否生存为结局指标,绘制PNI作为数值变量资料的ROC曲线,曲线下面积为0.668(图1)。Youden指数最大值为0.329,所对应的PNI为48.90,敏感度为68.0%,特异性64.9%。根据PNI的最佳截断值,将261例患者划分为108例高PNI组(41.38%),153例低PNI组(58.62%)。

图1 PNI值的ROC曲线
2.2 261例患者的临床资料 261例患者中,男180例(68.97%),女81例(31.03%);年龄31~78岁,中位年龄58岁;吸烟指数为0者98例(37.55%),<400年支者37例(14.18%),≥400年支者126例(48.28%);临床分期LD者81例(31.03%),ED者180例(68.97%)。根据SCLC NCCN临床实践指南,对所有纳入治疗患者根据主要治疗方案区分:化疗(87,33.33%),放化疗(141,54.02%),支持治疗(33,12.64%)。
2.3 PNI与SCLC患者临床病理特征的关系 PNI与SCLC患者的吸烟指数、临床分期无关(P>0.05);与患者年龄、性别、治疗方式有关(P<0.05):<58岁患者的PNI、女性患者的PNI分别明显高于≥58岁者和男性患者,化疗和放化疗的患者PNI明显高于支持疗法的患者。见表1:
表1 PNI与SCLC患者临床病理特征的关系(± s )
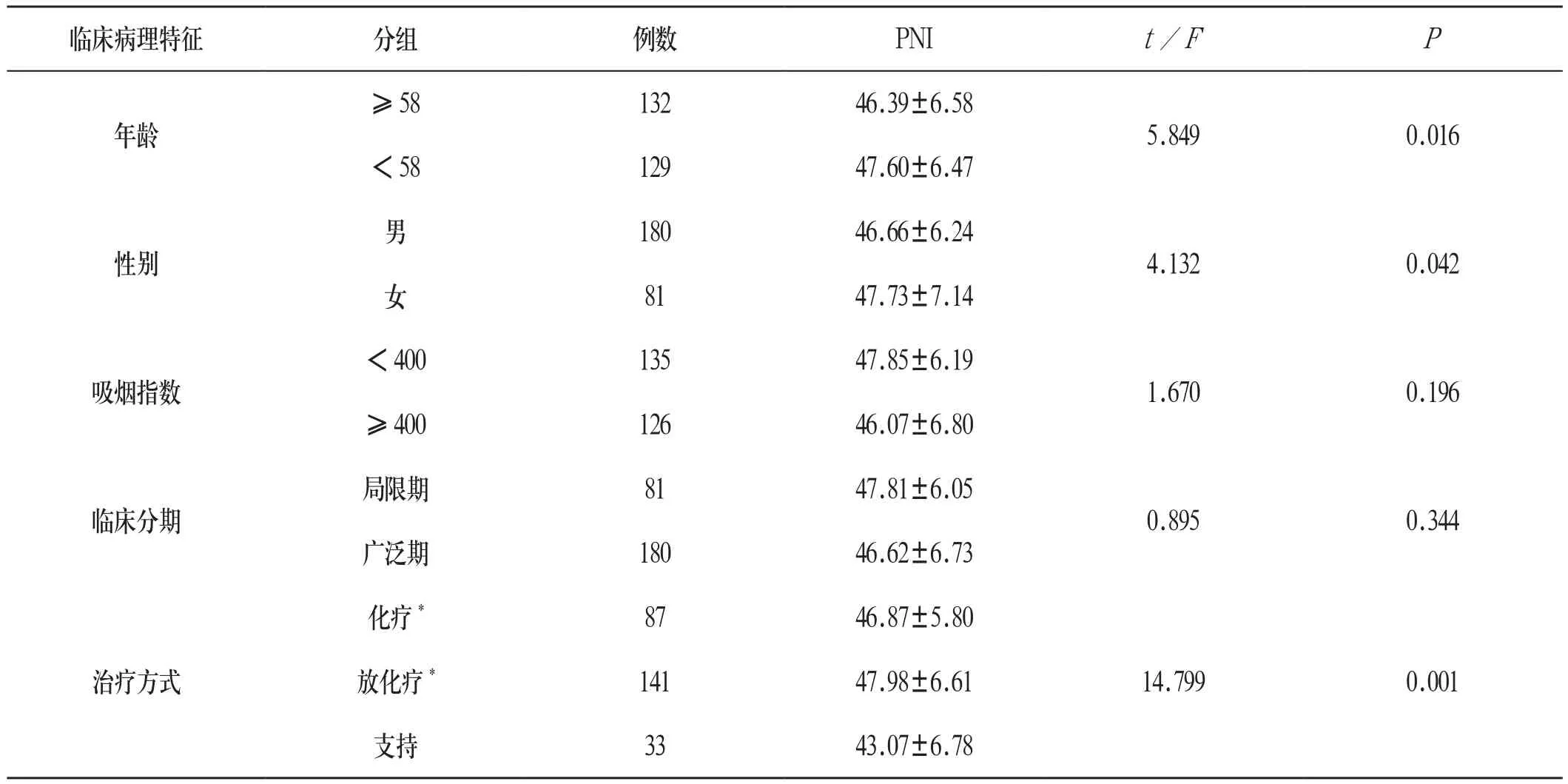
表1 PNI与SCLC患者临床病理特征的关系(± s )
与支持疗法比较:*P<0.05
临床病理特征 分组 例数 PNI t / F P年龄性别吸烟指数临床分期≥58 132 46.39±6.58 5.849 0.016<58 129 47.60±6.47男180 46.66±6.24 4.132 0.042女81 47.73±7.14<400 135 47.85±6.19 1.670 0.196≥400 126 46.07±6.80局限期 81 47.81±6.05 0.895 0.344广泛期 180 46.62±6.73化疗* 87 46.87±5.80放化疗* 141 47.98±6.61支持 33 43.07±6.78治疗方式14.799 0.001
2.4 PNI与SCLC患者预后的关系 全组261例患者中位生存时间为15.0个月(95% CI:17.46~21.26个月),高PNI组患者中位OS为26.0个月,低PNI组患者中位OS为13.0个月。将变量(性别、年龄、吸烟指数、临床分期,PNI值和治疗方法)纳入Cox回归模型,分析影响SCLC患者预后的因素。单因素分析结果显示,吸烟指数、临床分期、PNI值、治疗方式与SCLC患者中位OS有关(P<0.05)。见表2:
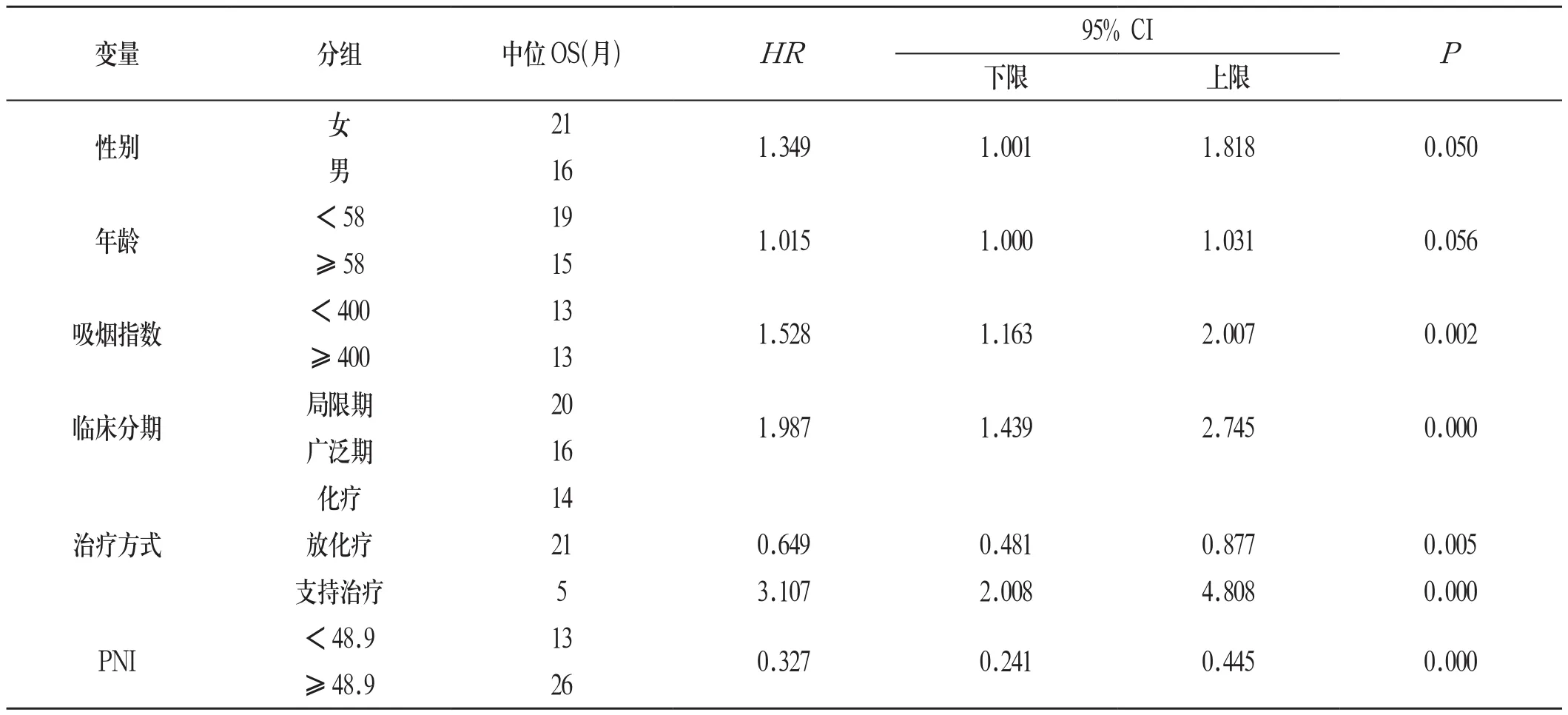
表2 SCLC患者预后影响因素的单因素分析
将单因素分析结果有意义的指标,吸烟指数、临床分期、PNI值、治疗方式及混杂因素(年龄、性别)作为协变量纳入Cox模型进行多因素分析,结果显示:吸烟指数、临床分期、PNI值、治疗方式是影响SCLC患者预后的独立危险因素。在治疗方式中,将化疗组作为对照组,与其它两组分别对比:化疗组死亡风险是放化疗组的0.370倍,支持治疗组的死亡风险是化疗组的1.291倍;根据PNI值分组中,高PNI组SCLC患者的死亡风险是低PNI组的0.360倍。见表3:
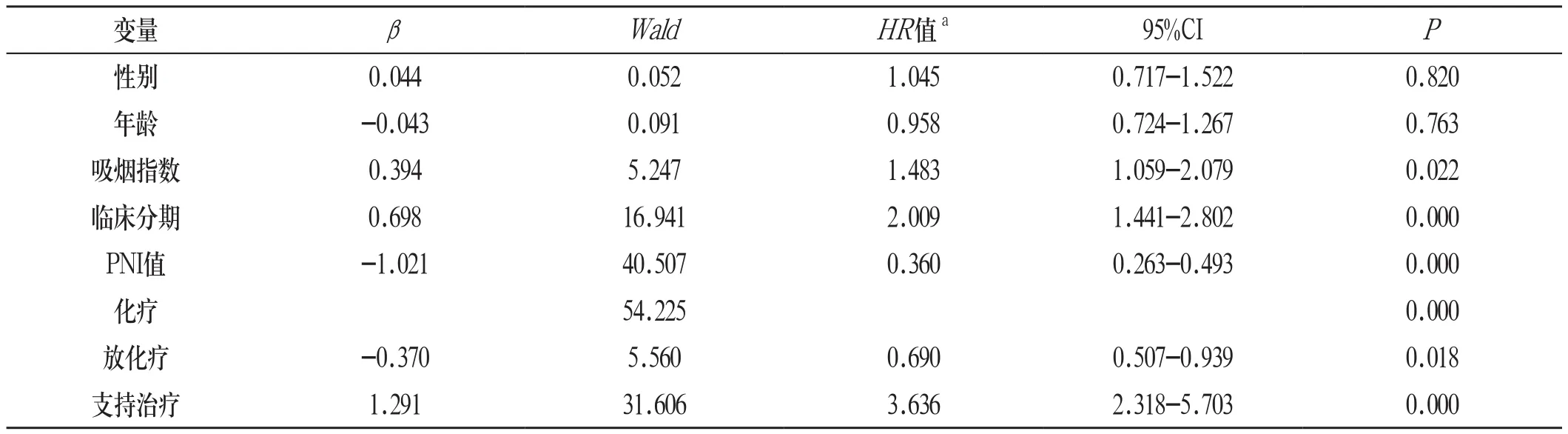
表3 SCLC患者预后影响因素的多因素分析
2.5 高PNI组和低PNI组SCLC患者的生存曲线及生存率比较 高PNI组和低PNI组患者1年生存率分别是80.55%(87/108)、48.36%(74/153),2年生存率分别为42.59%(46/108)、13.73%(21/153),两组SCLC患者1年生存率、2年生存率比较差异具有统计意义(P<0.05)。两组SCLC患者生存曲线见图2:

图2 不同PNI值SCLC患者的生存曲线
3 讨论
PNI值由外周血白蛋白和淋巴细胞计数计算所得。血清白蛋白是反应宿主炎症情况及营养状态的一项重要指标。淋巴细胞是肿瘤特异性免疫反应的重要成分,通过启动细胞毒性免疫反应和抑制癌细胞的增殖、侵袭和迁移等防御肿瘤。淋巴细胞减少通常提示癌症患者病情严重和预后不良[9]。一项大样本量的实验研究(n=8759)报道[10],PNI可用于评估肿瘤患者的预后。约有40%~80%的肿瘤患者由于肿瘤组织大量增殖导致营养需求增加、机体代谢率加快,从而发生营养不良,严重时甚至可导致肿瘤患者死亡[11]。因此,对肿瘤患者进行预后评估及营养干预,有助于提升患者的生活质量、延长患者生存时间,降低死亡率。
本研究以SCLC患者PNI值为变量,以随访截止日期患者是否生存为结局,绘制ROC曲线,结果显示曲线下面积为0.668;Youden指数最大时PNI值为48.90,该节点区别本组SCLC患者高、低PNI的敏感度为68.0%、特异性为64.9%,与既往研究结果基本一致[12]。
本研究还分析了261例SCLC患者PNI值评估SCLC患者预后的价值,单因素和多因素分析结果均提示PNI是评估SCLC患者预后的独立危险因素;且与低PNI组患者相比,高PNI组患者的死亡风险是低PNI组的0.360倍;同时,生存曲线及中位OS均提示高PNI值的SCLC患者比低PNI值的患者生存时间更长,提示高PNI值的SCLC患者预后更好。PNI最初用来评价接受胃肠道手术患者的免疫及营养状况,但PNI与SCLC患者预后的相关性鲜有报道。之前有研究报道,评估非小细胞肺癌(NSCLC)患者的潜在预后因素,公认的主要有KPS评分、临床分期、治疗方式,其它可能影响预后的因素有年龄、性别、吸烟指数等[13-14]。与此相似,本研究得出吸烟指数、临床分期、治疗方式及PNI值,是影响SCLC患者预后的独立危险因素。
综上所示,PNI值是评估SCLC患者预后的独立危险因素,因此,应该纳入常规的临床实践,以便于进行临床研究、营养补充及指导治疗时间。但其它非癌症情况,如自身免疫性和传染性疾病、血液系统恶性肿瘤和类固醇的使用等,可能会影响PNI值的准确性。本研究排除了上述患者,因此,“PNI是影响SCLC患者预后的独立危险因素”这一结论能否推广应用于所有SCLC患者还有待深入研究。

