丝胶对链脲佐菌素作用下大鼠INS-1细胞Bax表达的调控作用*
史 硕,王芳芳,葛 婷,阮鸿娇,陈志宏△,宋成军△
(1.承德医学院人体解剖学教研室,河北承德 067000;2.承德医学院附属医院)
1972年KERR等三位科学家首次提出了细胞凋亡(apoptosis)的概念[1]。凋亡是具有重要生物学意义及复杂分子生物学机制的生物学现象,用于多细胞生物去除不需要的或异常的细胞,在生物体进化、内环境稳定及多个系统的发育中发挥重要作用,亦与多种疾病的发生发展直接或间接相关,如肿瘤、自身免疫性疾病、1型和2型糖尿病等[2]。Bcl-2蛋白家族在众多凋亡调控基因中最受重视,Bax是其第二类亚家族成员,可对抗Bcl-2等抑制凋亡基因的作用,促进细胞凋亡[3]。胰岛β细胞凋亡与糖尿病发病相关的理论,为糖尿病的治疗拓展了一条从基因水平防治糖尿病的新思路。为此,本研究观察了彩色蚕茧水提物—丝胶对大鼠胰岛素瘤细胞(insulinoma cells,INS-1细胞)Bax表达的调控作用,以探讨丝胶是否通过抑制胰岛β细胞凋亡发挥抗糖尿病作用。
1 材料与方法
1.1 实验材料 丝胶,由承德医学院蚕业研究所提供彩色蚕茧,按照文献[4]的方法制备丝胶。大鼠INS-1细胞,购自赛百慷(上海)生物技术股份有限公司。链脲佐菌素(STZ),美国Sigma公司;四季青胎牛血清,浙江天杭生物科技股份有限公司;BCA蛋白定量试剂盒,北京索莱宝生物有限公司;兔抗Bax多克隆一抗,艾博抗(上海)贸易有限公司;山羊抗兔IgG二抗,美国KPL公司;Super ECL Plus超敏发光液,北京普利莱基因技术公司;Trizol,北京茂建联科技有限公司;PCR引物,宝生物工程(大连)有限公司。
1.2 INS-1细胞的培养和分组 INS-1细胞培养在RPMI-1640培养基中(含10%胎牛血清和50μmol/L的β-巯基乙醇),在37℃、5% CO2培养箱培养,取对数生长期细胞进行实验。INS-1细胞随机分为3组:正常对照组、STZ处理组、丝胶保护组。正常对照组细胞,不给予任何药物处理;STZ处理组细胞,给予由完全培养基配制的STZ溶液(10mmol/L)培养24h;丝胶保护组细胞,给予同时含STZ和丝胶的溶液培养24h,STZ的终浓度同STZ处理组细胞,丝胶的终浓度为300μg/ml。
1.3 INS-1细胞活力的检测 采用CCK-8法。消化和重悬状态良好的INS-1细胞,以1×105个/ml的密度接种于96孔板(每孔100μl),每组设6个复孔。细胞贴壁培养48h后给予不同的药物处理,继续培养24h取出96孔板,弃掉原来的培养基后使用PBS清洗,每孔加入含10% CCK8溶液的无胎牛血清培养基100μl,在37℃培养箱中孵育2h后,于波长450nm处使用酶标仪读取吸光度(A)值[5]。以正常组A值为对照,按照干预组A值/正常组A值×100%计算INS-1细胞的活力。
1.4 INS-1细胞Bax表达的检测
1.4.1 Bax蛋白:采用蛋白印迹法。细胞培养结束后,提取INS-1细胞的总蛋白,并使用BCA蛋白定量试剂盒定量蛋白浓度。取所提取蛋白上样进行SDS-PAGE凝胶电泳(胶浓度15%),然后将蛋白转至PVDF膜上;5%脱脂奶粉封闭过夜,Bax(1:500)、β-actin一抗(1:1000)室温2h,二抗(1:5000稀释)室温2h,Super ECL Plus超敏发光液显影后扫描条带。使用Quantity One-v 4.6.2软件,分析Bax条带与β-actin条带的灰度比值,作为Bax的表达量。
1.4.2 Bax mRNA:采用实时荧光定量PCR法。细胞培养结束后,提取INS-1细胞的总RNA,检测RNA的纯度和浓度,鉴定RNA的完整性后反转录成cDNA。以cDNA为模板,利用荧光定量PCR法扩增Bax和GAPDH片段,每个指标重复3次,所得数据采用2-△△Ct法进行分析计算。Bax引物序列(5’-3’,196bp),F:AGACACCTGAGCTGACCTTGGA,R:TTGAAGTTGCCATCAGCAAACA;GAPDH引物序列(5’-3’,143bp)F:GGCACAGTCAAGGCTGAGAATG,R:ATGGTGGTGAAGACGCCAGTA。
1.5 统计分析 所有计量数据以(±s)表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。应用SPSS 21.0统计学软件,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组INS-1细胞的活力 STZ处理组INS-1细胞的活力较正常对照组明显降低(P<0.05),丝胶保护组INS-1细胞的活力较STZ处理组明显升高(P<0.05)。见图1:

图1 各组INS-1细胞的活力
2.2 各组INS-1细胞Bax的表达情况 STZ处理组INS-1细胞Bax蛋白和mRNA的表达水平较正常对照组明显升高(P<0.05),丝胶保护组INS-1细胞Bax蛋白和mRNA的表达水平较STZ处理组明显降低(P<0.05)。见附表、图2-3。
附表 各组INS-1细胞Bax蛋白和mRNA的表达(± s )

附表 各组INS-1细胞Bax蛋白和mRNA的表达(± s )
与正常对照组比较:aP<0.05;与STZ处理组比较:bP<0.05
组别 Bax蛋白 Bax mRNA正常对照组 0.893±0.015 1.000±0.000 STZ处理组 1.029±0.008a 1.792±0.087a丝胶保护组 0.896±0.010b 1.233±0.068b
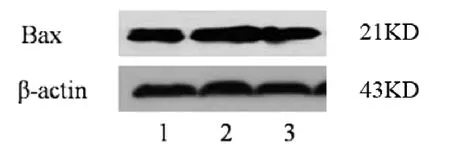
图2 各组INS-1细胞Bax蛋白表达情况

图3 实时荧光定量PCR法Bax的扩增曲线和溶解曲线
3 讨论
糖尿病是由不同病因与发病机理引起的,一组以高血糖为特征的代谢性疾病,糖尿病时高血糖长期存在,可导致各种组织器官,特别是眼、肾、心脏、血管、神经的慢性损害、功能障碍。糖尿病确切的病因目前尚未清楚,研究者们通过多方面综合研究认为与以下因素有关,遗传因素、病毒感染、自身免疫、胰岛素抵抗、饮食习惯、肥胖等[6]。
研究发现,在糖尿病的早期阶段就已经出现胰岛β细胞凋亡和胰岛体积的缩小,血糖升高、游离脂肪酸增多、胰岛淀粉样物质沉积及炎症因子等均参与了胰岛β细胞的凋亡过程[7]。细胞凋亡受到多种基因的调控,表现为凋亡相关信号通路的启动和凋亡相关基因的表达[8];线粒体在所有类型凋亡的执行过程中均发挥重要作用,是多种促凋亡信号因子的共同靶点。在多种凋亡调控基因中,Bcl-2家族成员可通过作用于线粒体调节凋亡相关蛋白的释放,从而决定细胞存活或凋亡[3]。Bax是Bcl-2家族第二亚家族的重要成员,均含有BH1-BH3结构域。当细胞发生凋亡时,Bax通过作用于线粒体使Cyt-C进入胞质并与细胞凋亡诱导因子结合,启动caspase相关的凋亡级联反应[9];另外,Bax还可以对抗Bcl-2的抗凋亡作用,引起细胞凋亡。并且,Bcl-2家族中的Bcl-2和Bax还可以直接调控胰岛β细胞凋亡[3]。
临床上传统以西药降低血糖治疗糖尿病,但西药的毒副作用,促使人们探寻疗效佳、毒副作用少的天然物质。与西医药相比,在糖尿病脏腑、气血、经络病变的治疗中,中医的整体辨证及灵活的配伍组方具有明显优势[10]。中医认为,应采用阴阳五行的理论科学认识糖尿病。糖尿病的起病脏腑在脾,脾为湿润之土,被肺胃燥火所烤,失去了润泽,因此导致脾功能降低,使脾分泌的胰岛素相对不足。因此,糖尿病的治疗原则是生精清热、润燥养阴等。蚕茧为家蚕蛾的茧壳,具有滋阴润燥、生精止渴的作用,主治肠风便血、淋痛尿血、消渴饮引等,且民间亦有蚕茧泡水辅助降糖的用法[4,11]。
本研究观察了丝胶对STZ致损伤INS-1细胞细胞活力和Bax表达的影响,以期探寻丝胶降血糖的作用机制。结果显示,STZ处理组INS-1细胞的活力明显低于正常对照组、Bax蛋白和mRNA表达明显高于正常对照组,提示使用STZ成功建立了INS-1细胞损伤模型,并且促凋亡因子Bax可能参与了STZ致INS-1损伤的过程。同时本研究发现,丝胶保护组INS-1细胞的活力明显高于STZ处理组、Bax蛋白和mRNA表达明显低于STZ处理组,说明丝胶可对抗STZ对INS-1细胞的损伤、提高INS-1细胞的活力,而这种保护作用可能与丝胶降低Bax的表达进而减少INS-1细胞凋亡有关。
综上所述,丝胶对STZ致损伤INS-1细胞具有保护作用,其机制可能与丝胶下调Bax的表达有关,但丝胶是否通过下调Bax的表达减少INS-1细胞凋亡,以及丝胶是否还具有调控其它凋亡相关因子的作用,需要深入研究探讨。

