FGF1通过抑制内质网应激和自噬途径保护对乙酰氨基酚诱导的小鼠肝损伤
张谢 宋毓飞 张学松 王小芳 吴俊男 陈熠媛 陈硕崴
对乙酰氨基酚(APAP)是世界上最流行和安全的止痛药之一,然而如过量使用会导致严重的肝损伤,甚至急性肝衰竭[1-2]。正常情况下,APAP在经消化吸收后通过与葡萄糖醛酸结合被排出体外,但当机体摄入过量的APAP后,会产生毒性代谢物N-乙酰-对苯醌亚胺(NAPQI),可引起急性的、严重的肝细胞损伤[1-4]。成纤维细胞生长因子1(FGF1)又名酸性成纤维细胞生长因子(aFGF),是庞大的生长因子家族中一员,在胚胎发育、血管生长、创伤愈合等过程中发挥重要作用[5-6],目前已作为促进烧伤创面愈合的药物上市,但在肝损伤方面有何作用无详细报道。本研究通过建立APAP诱导的小鼠肝损伤模型,探究FGF1对APAP引起肝损伤的保护作用及相应机制,为开发治疗药物性肝损伤的新药提供理论依据和参考。
1 材料和方法
1.1 材料
1.1.1 动物 雄性C57BL/6小鼠30只,SPF级,体重18~22g,8周龄,由温州医科大学动物实验中心提供[合格证号:SCXK(浙)2015-0001]。在温州医科大学动物实验中心分笼饲养。
1.1.2 主要试剂 FGF1由温州医科大学药学院提供;对乙酰氨基酚片(国药准字:H22022435)、葡萄糖调节蛋白 78(GRP78)、蛋白二硫键异构酶(PDI)、Beclin1 抗体购自美国Abcam公司;C/EBP同源蛋白(CHOP)、X-框结合蛋白 1(XBP-1)、微管相关蛋白 1 轻链 3(LC3)、3-磷酸甘油醛脱氢酶(GAPDH)抗体均购自美国Santa Cruz公司;激活转录因子6(ATF6)、含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase3)、自噬基因相关蛋白7(ATG7)、自噬基因相关蛋白5(ATG5)抗体均购自美国Bioworld公司;丙氨酸转氨酶(ALT)试剂盒购自南京建城生物工程研究所。
1.1.3 主要仪器 荧光倒置显微镜(日本Nikon公司,Ti-U型);高速冷冻离心机(美国Thermo Fisher公司,micro21R型);超纯水(美国Millipore公司,Direct-Q3型),凝胶成像系统(美国Bio-rad公司,chemidoc XRS+型)等。
1.2 方法
1.2.1 动物分组及模型制备 将30只小鼠按随机数字表法分为APAP+FGF1处理组、APAP组及正常对照组3组,每组10只。APAP+FGF1组:腹腔注射APAP 500mg/kg 0.5h后,腹腔注射FGF1 1.0mg/kg;APAP组:腹腔注射APAP 500mg/kg;正常对照组:给予同等剂量PBS作为对照。所有小鼠在给予APAP 24h后均经颈椎脱位法处死。造模24h后小鼠血浆ALT水平显著升高,表示造模成功。
1.2.2 ALT水平检测 采用ELISA法。3组小鼠给药后24h眼眶采血,3 000r/min离心10min,取血浆,按照试剂盒说明书进行检测。
1.2.3 病理检查 处死小鼠后,取各组小鼠肝组织约4g,4%多聚甲醛溶液固定,石蜡包埋,5μm切片,作HE染色,显微镜下观察肝组织病变情况。
1.2.4 Western bolt法检测内质网应激及自噬信号通路相关蛋白的表达 BCA法测定肝组织总蛋白浓度,蛋白变性后行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,湿转法到聚偏氟乙烯(PVDF)膜上,加入3%牛血浆白蛋白(BSA)封闭液,室温下孵育 1h,加入 GRP78、ATF6、PDI、XBP-1、Caspase3、CHOP、ATG7、Beclin1、ATG5、LC-3、GAPDH 一抗(1∶1 000),4℃封闭过夜,弃一抗,TBST 洗3遍;加入1∶10 000的二抗,室温孵育2h后,弃二抗,TBST洗涤3遍,化学发光显色剂显色,曝光,观测GRP78、ATF6、PDI、XBP-1、Caspase-3和 CHOP 的表达量。1.2.5 免疫荧光染色法检测肝组织内质网应激及自噬信号通路相关蛋白的表达 处死小鼠后,取各组小鼠肝组织约8g,4%多聚甲醛溶液固定,石蜡包埋,5μm切片,0.1%柠檬酸钠缓冲液进行抗原修复,5%BSA封闭,加入 GRP78,ATG7,LC-3 一抗(1∶200),4℃过夜;加入二抗(1∶500),37℃孵育 1h,PBS 洗涤 3 次,4′,6-二脒基-2-苯基吲哚(DAPI)染核7min,抗荧光淬灭剂封片,显微镜下观察,再将观察到的目的蛋白荧光图和染核图片进行整合(Merge)。
1.3 统计学处理 采用GraphPad 5.0统计软件。计量资料用表示,组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组小鼠血浆ALT水平比较 ELISA结果显示,APAP+FGF1组 ALT 水平为(29.33±5.05)U/L,APAP 组为(48.00±10.93)U/L,正常对照组为(35.60±4.39)U/L,与正常对照组比较,APAP组ALT水平增加,而APAP+FGF1组ALT水平下降,差异均有统计学意义(均P<0.05)。
2.2 3组小鼠肝组织HE染色结果比较 在APAP注射后24h,与正常对照组比较,APAP组出现明显的片状和点状的肝细胞坏死,且肝索内出血较为显著,而APAP+FGF1组肝细胞损伤程度减轻,见图1(见插页)。
2.3 3组小鼠肝组织内质网应激信号通路相关蛋白检测结果比较 Western blot法结果显示,与正常对照组比较,APAP 组 GRP78、ATF6、PDI、XBP-1、Caspase-3 和CHOP表达量均增高,而APAP+FGF1组上述蛋白又降低,差异均有统计学意义(均P<0.05),见图2、表1。免疫荧光法结果显示,与正常对照组比较,APAP组GRP78表达量显著增高,而APAP+FGF1组GRP78又明显下降,见图3(见插页)。

图2 3组小鼠肝组织内质网应激信号通路相关蛋白的电泳图
2.4 3组小鼠肝组织自噬信号通路相关蛋白检测结果比较 Western blot法结果显示,与正常对照组比较,APAP 组 ATG7、Beclin-1、ATG5、LC-3Ⅰ/Ⅱ表达量均明显增高,而APAP+FGF1组的均明显降低,差异均有统计学意义(均P<0.01),见图4、表2。免疫荧光法结果显示,与正常对照组比较,APAP组ATG7、LC-3表达量均增高,而APAP+FGF1组的均降低,比较差异均有统计学意义(均P<0.05),见图 5(见插页)。
3 讨论
近年来,APAP引起的急性肝衰竭成为发达国家中急性肝衰竭导致死亡的最常见因素,由此引起了严重的公共健康及安全问题[7-8]。90%~95%的APAP在肝脏代谢,其主要与葡萄醛酸、硫酸及半胱氨酸结合,在24h内以原型、葡萄醛酸、硫酸及半胱氨酸结合的形式从肾脏排泄[1]。但小部分APAP在肝细胞内由细胞色素P450(CYP450)代谢转化为NAPQI,NAPQI与亲核性物质结合并由此进入细胞核内,引发肝细胞毒性[1-4,9]。研究显示,APAP引起急性肝损伤的病理生理过程主要是由代谢产物被激活、谷胱甘肽消耗及蛋白质的结合造成的[10]。过量或长期服用APAP可引起肝细胞损伤、淤胆型肝炎,严重者可引起肝性昏迷甚至死亡。部分原因是由于APAP与肝细胞内线粒体功能降低、自由基代谢产物增多及氧化应激的密切关系[11],同时固有免疫反应和炎性应答在APAP诱发的急性肝损伤也发挥重要作用[12]。然而目前APAP引起肝细胞损伤具体机制尚不明确。
有研究表明内质网应激和未折叠蛋白反应(UPR)的激活是APAP激活的肝毒性反应级联反应中的晚期事件,ATF6通过上调CHOP在APAP诱导的肝脂肪变性发病机制中起到关键作用[13]。在内质网应激条件下XBP1被需要肌醇的酶-1(IRE1)的核糖核酸酶剪接,诱导内质网伴侣GRP78和PDI的表达水平增加[14],并上调Caspase 3活性,诱导肝损伤。内质网应激可以通过激活UPR信号通路从而激活细胞自噬[15],自噬也是对抗危险刺激的细胞防御机制[16]。然而,当内质网应激太强或时间过长时,UPR将过度激活自噬,促进细胞死亡并导致身体损伤[17]。Beclin1等上游因子参与自噬起始和成核,ATG5、ATG7和LC3等下游因子促进自噬膜伸长和闭合[18]。LC3是自噬体膜上的标记蛋白。在异烟肼诱导斑马鱼肝损伤的模型中,异烟肼可以增强内质网应激信号通路相关蛋白(GRP78、ATF6、Perk、IRE1、XBP1S、GRP94和 CHOP)和自噬相关蛋白(Beclin 1、LC3、ATG3和ATG12)的水平上升,提示内质网应激与自噬及肝损密切相关[19]。
FGF1是FGFs家族成员之一,对来源于中胚层及神经外胚层的细胞具有促分裂作用。人类FGF1是位于人体第4号染色体上的单拷贝基因,由2个内含子和3个外显子组成,蛋白由154个氨基酸残基组成,等电点为5~7个,通过与受体结合、启动信号转导机制诱导多种细胞的分化、增殖[20]。由于它具有营养和保护神经元、促进损伤修复、诱导缺血区血管形成等多个方面的作用而成为众多学者研究的热点。aFGF主要通过与成纤维细胞生长因子受体-1(FGFR-1)结合,启动丝裂原活化蛋白激酶(MAPK)信号通路,刺激成纤维细胞、血管内皮细胞和神经细胞的生长[21]。aFGF与FGFR-2结合仅起保持MAPK通路活性的作用[22],同时aFGF也可与FGFR-4(神经元高亲和受体)结合,通过甲素核蛋白体基因的转录,以促进细胞分裂增殖;同时还通过细胞内蛋白和总RNA的合成表达,促进神经元突起生长[23]。aFGF与FGFR结合后启动的MAPK途径是调节各种细胞趋化应答、分化、分裂的重要途径,是细胞增殖、分化等信息传递途径的交集点和共同通路。
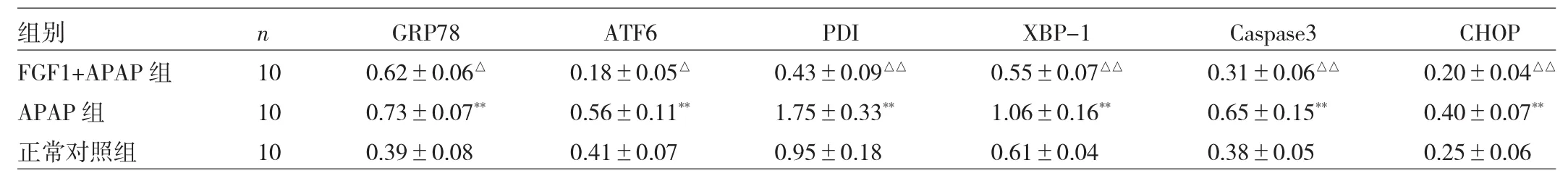
表1 3组小鼠肝组织内质网应激信号通路相关蛋白检测结果比较

表2 3组小鼠肝组织自噬信号通路相关蛋白检测结果比较

图4 3组小鼠肝组织自噬信号通路相关蛋白的电泳图
目前,国内外针对FGF1的研究主要集中在创伤修复、调节血糖、调节代谢及通过与受体结合启动MAPK信号通路从而刺激细胞的分裂及促进细胞生长、增殖、分化同时进行信息传递,而关于其在肝损伤尤其是药物性肝损伤方面的研究较少。只有少量的研究显示FGF1 KO小鼠的肝组织再生能力明显延缓[24],APAP会诱导FGF1表达降低[25]。此外,在各种非酒精性脂肪性肝病小鼠模型中,重组FGF1可有效改善肝脏炎症和损伤[26]。FGF1还能促进肝源性干细胞的分化和成熟[27],提示其在各种肝病中的潜在治疗作用。而本研究结果同样显示,当生物体摄入过量的APAP时,其在机体内转化为毒性代谢产物,该毒性代谢产物进一步通过激发内质网应激和自噬引起肝细胞损伤,而FGF1通过抑制内质网应激和自噬达到对肝细胞的保护作用,说明FGF1有望成为治疗药物性肝损伤的一个新选择。

