环颈雉卵清蛋白酶抑制剂的分离及其活性的初步研究
张晶晶*,邓歆玥*,徐 烨,陶翊雯,王静文,韩曜平
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
1 引言
蛋白酶抑制剂是一类多肽或蛋白质,因其能与蛋白酶活性部位结合而抑制酶的催化活性,可作为蛋白酶的调控物. 蛋白酶抑制剂广泛分布于生物组织中,参与调节生物生命活动的酶反应活动[1-2]. 蛋白酶抑制剂是首先在动物血清中被发现的蛋白质[3]. 禽卵中的蛋白酶抑制剂成分最初在鸡卵清蛋白中被发现,具有抑制胰蛋白酶的活性[4].
前期研究表明,动物卵中蛋白酶抑制剂具有抗微生物感染的作用,并在卵胚胎发育过程及早期胚胎生长过程中起着调控酶反应的作用. 目前在鸟卵、两栖动物卵和爬行动物卵的卵黄和卵清中皆发现了不同类型的蛋白酶抑制剂[5-6]. 总体而言,目前对鸟卵中胰蛋白酶抑制剂的纯化研究还较少 ,而对环颈雉卵中蛋白酶抑制剂的纯化及性质研究在国内尚未见报道.
因此,本课题研究以环颈雉卵清为研究材料,拟利用层析分离手段和发色底物检测方法,对环颈雉卵清蛋白酶抑制剂活性及其理化性质进行研究,为其进一步研究和高效利用提供理论依据.
2 材料与方法
2.1 材料与仪器设备
实验材料:环颈雉卵购于本地农贸市场,质量为40~50 g;胰蛋白酶,发色底物(B-3133),购于美国西格玛(Sigma)公司;Sephadex G-50,Sephadex G-75交联葡聚糖凝胶,购于美国通用(Pharmacia)公司.
试验用主要仪器设备:pH仪,高速冷冻离心机,层析柱(2.6 cm×100 cm),循环水式真空泵,冷冻干燥机,紫外分光光度计.
2.2 方法
2.2.1 样品制备
环颈雉卵清洗后去壳收集卵清液,混合适量的PBS缓冲液,用研钵研磨匀浆,12 000 r/min,4 ℃ 离心30 min. 收集上清液,按照常规冻干方法制成冻干粉. 将冻干粉溶解于适量的0.1 mol/L磷酸氢盐缓冲溶液(PBS,pH 6.0)中,12 000 r/min,4 ℃离心30 min. 取上清液,置于EP管中作为活性检测及Sephadex G-50交联葡聚糖凝胶层析样品备用.
2.2.2 Sephadex G-50交联葡聚糖凝胶过滤
参照欧雪等[7]的方法,用0.1 mol/L磷酸氢盐缓冲溶液(PBS,pH6.0)洗脱平衡Sephadex G-50凝胶过滤柱(2.6 cm×100 cm). 将上清液放入已预处理好的柱中,用上述PBS液洗脱,流速0.35 mL/min. 洗脱液被分离出来后,在波长为280 nm处测量各洗脱液中蛋白的浓度,收集活性峰,冻干,置冰箱保存.
2.2.3 Sephadex G-75交联葡聚糖凝胶过滤
参照欧雪等[7]的方法:经G-50交联葡聚糖凝胶层析过滤后收集有活性的冻干粉,用0.1 mol/L(pH6.0)PBS缓冲液溶解,10 000 r/min离心20 min. 将上清液放入已预处理过的柱中,用上述PBS液洗脱,流速0.35 mL/min. 洗脱液被分离出来后,在波长为280 nm处测量各洗脱液中蛋白的浓度,合并各洗脱峰并检测各峰活性,将活性峰冻干备用.
2.2.4 SDS-PAGE及分子量测定
SDS-PAGE对照LaemmLi方法[8],制备两种pH不同的电泳胶,分离胶含量为10%, pH 8.8;浓缩胶含量为5%,pH 6.9. 在SDS-PAGE实验时,纯化样品用上样缓冲液(还原状态)染色,脱色时先用200 mL蒸馏水用微波炉高火煮沸3 min,后用考马斯亮蓝染液高火煮沸2 min,最后用500 mL蒸馏水煮沸25 min,脱色完成. 用标准分子量蛋白确定纯化的环颈雉卵清蛋白酶抑制剂的分子质量.
2.2.5 环颈雉卵清胰蛋白酶抑制活性检测及其抑制常数(Ki)的确定
测量蛋白酶抑制活性可参考文献[7],具体方法为:在50 mmol/L pH 7.6的Tris-HCl缓冲液中,将不同量分离纯化到的卵清蛋白酶抑制剂样品与胰蛋白酶保育15 min,然后放入30 μmol/L发色底物B-3133.于410 nm,每间隔50 s(共2 min)测量吸光度. 每次分离纯化结束后,都用胰蛋白酶与B-3133底物来测量酶抑制剂活性. 1单位酶活:每分钟放出的量;1单位抑制作用:每分钟量为1 nmol的对Trypsin的抑制.
环颈雉卵清蛋白酶抑制剂对Trypsin的抑制测量方法同上文. Trypsin与Tris-HCl缓冲液、不同浓度的卵蛋白酶抑制剂在室温下水浴,时间为1~24 h(每间隔4 h). 以空白蒸馏水的酶活为100%,算出剩余酶活.
纯化的环颈雉卵蛋白酶抑制剂有酶抑制剂的作用,使用Dixon的方法[6]测定其抑制常数. 方法为:在1 mL离心管中加入50 mmol/L Tris-HCl缓冲溶液与浓度为1 mmol/L的胰蛋白酶20 μL,分别加入不同量环颈雉卵蛋白酶抑制剂(已经纯化),于25 ℃下水浴15 min. 最后加入发色底物(B-3133)20 μL,用紫外分光光度计连续测2 min的吸光值,与对照组比较. 对照组加同体积不含环颈雉卵蛋白酶抑制剂的50 mmol/L Tris-HCl缓冲溶液. 用抑制常数(Ki)公式处理实验数据,公式为Ki=[I]/(V0/V1+1),式中[I]是环颈雉卵清胰蛋白酶抑制剂物质的量浓度,V0是对照组反应速度,V1是含抑制剂组的反应速度.
2.2.6 环颈雉卵清蛋白酶抑制剂的热稳定性及酸碱稳定性
参考Tzeng[9]等的方法检测分离纯化到的环颈雉卵清蛋白酶抑制剂的热稳定性及酸碱稳定性. 简述如下:检测热稳定性时分别在30,40,50,60,70,80,90,100 ℃的梯度中,将最终质量浓度40 nmol/L的纯化样品水浴10 min,再冷却(置于冰中),最后用胰蛋白酶测其抑制剂活性. 检测酸碱稳定性是将纯化后的样品与pH 2.0~5.0的50 mmol/L甘氨酸-HCl缓冲液、pH 6.0~8.0的50 mmol/L磷酸缓冲液、pH 9.0~10.0的50 mmol/L 甘氨酸-NaOH缓冲液、pH 10.0的 50 mmol/L磷酸-NaOH缓冲液等体积混合,形成20 nmol/L的待检测样品. 在25 ℃条件下静置10 min后检测其残留抑制剂活性,比较不同pH时抑制剂的活性,可得知环颈雉卵中蛋白酶抑制剂的酸碱稳定性.
3 结果与分析
3.1 环颈雉卵中蛋白酶抑制剂的分离纯化
环颈雉卵清样品经Sephadex G-50凝胶过滤层析图谱见图1,图1结果显示为1个峰. 用胰蛋白酶测定其抑制活性(底物为B-3133),结果显示为活性峰. 收集并冷冻干燥,获得的冻干粉用Sephadex G-75凝胶过滤,最终图2显示为2个峰. 分别用胰蛋白酶测定其抑制活性,第二个峰箭头所指为活性峰,收集并冷冻干燥备用.
3.2 SDS-PAGE电泳
由电泳结果可知(图3),使用SDS-PAGE电泳经二步凝胶过滤纯化的卵清蛋白酶抑制剂(lane 4)结果仅显示一条深色条带,其表观分子量约为40 kDa.
分离纯化环颈雉卵清蛋白酶抑制剂各步的SDSPAGE电泳分析中,Lane 1为卵清初样,Lane 2 和Lane 3为Sephadex G-50活性峰,Lane 4为Sephadex G-75活性峰,Lane 5为蛋白质分子量标准.
3.3 环颈雉卵清中蛋白酶抑制剂活性检测及抑制常数的确定
经二步凝胶过滤纯化的环颈雉卵清蛋白酶抑制剂检测结果见图4. 结果显示,该抑制剂能抑制胰蛋白酶水解底物的活性,其抑制胰蛋白酶的最低浓度为60.0 nmol/L(箭头所指). 当该抑制剂与胰蛋白酶保温0~24 h后,仍保持胰蛋白酶抑制剂活性(见图5),说明其对胰蛋白酶的抑制效果具有相当的稳定性.
用抑制常数(Ki)公式处理实验数据,经纯化后产品的常数为0.16 nmol/L.
在25 ℃的热水中,将各浓度纯化的环颈雉卵清蛋白酶抑制剂分别与等量胰蛋白酶水浴15 min,然后测定胰蛋白酶的剩余水解活性.
胰蛋白酶与反应体系缓冲溶液和纯化的环颈雉卵清蛋白酶抑制剂在25 ℃温育0~24 h,然后检测胰蛋白酶的剩余水解活性.
3.4 环颈雉卵清蛋白酶抑制剂的热稳定性和酸碱稳定性
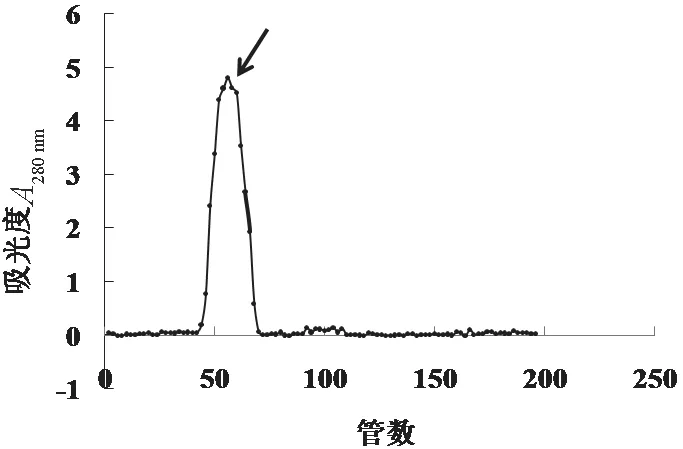
图1 环颈雉卵清经SephadexG50分离洗脱峰图

图2 经SephadexG-50凝胶过滤层析所得活性峰经SephadexG-75凝胶过滤分离洗脱图
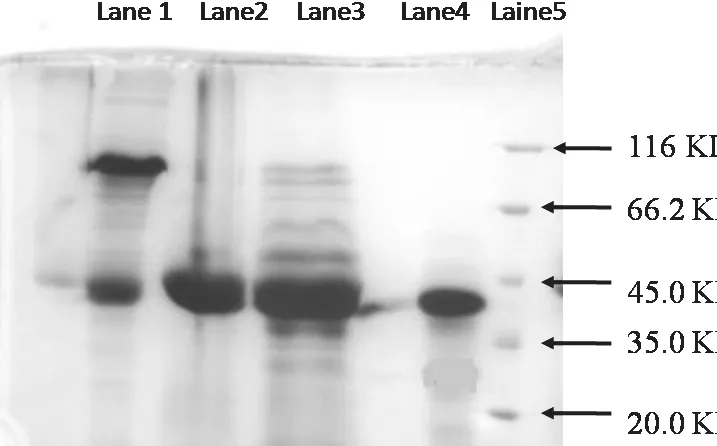
图3 分离纯化环颈雉卵清蛋白酶抑制剂各步的SDS-PAGE电泳分析

图4 纯化的环颈雉卵清蛋白酶抑制剂对胰蛋白酶的抑制剂活性
对纯化后的蛋白酶抑制剂进行基本特性的相关研究,结果表明(见图6、图7),当温度在30~80 ℃时,环颈雉卵清蛋白酶抑制剂的稳定性维持在高于85%的程度;但当温度高于80 ℃时,该蛋白酶抑制剂对特异性底物无水解活性. 环颈雉卵清蛋白酶抑制剂具有广泛的酸碱稳定性,当pH范围为2~10时,抑制剂活性可一直维持在高于90%的程度,体现了其良好的酸碱稳定性.
4 结论
本研究通过凝胶层析技术和发色底物检测方法,从环颈雉卵清中分离出一种蛋白酶抑制剂.对其进行热稳定性和酸碱稳定性的实验,结果显示在30~80 ℃范围内有较好的热稳定性;在pH 2~10的范围内具有良好的酸碱稳定性. 使用SDS-PAGE电泳经纯化的卵清蛋白酶抑制剂,结果显示为1条单一深色条带,表观分子量约为40 kDa.
目前,有关鸟卵中的抑制剂研究相对较少,仅见有少数家禽卵的抑制剂研究[10-11],且基本都属于半光氨酸蛋白酶抑制剂. 因此,本研究不仅首次报道了一种来源于环颈雉卵清中抑制剂分离纯化及性质的研究结果,而且为禽卵中的抑制剂增加了新的成员.
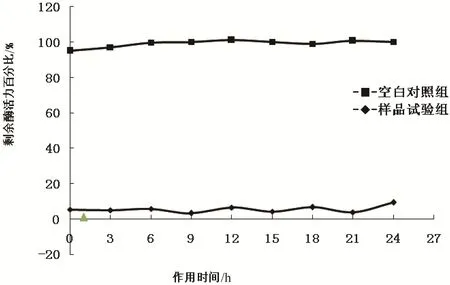
图5 纯化的环颈雉卵清蛋白酶抑制剂对胰蛋白酶抑制剂活性的时间稳定性
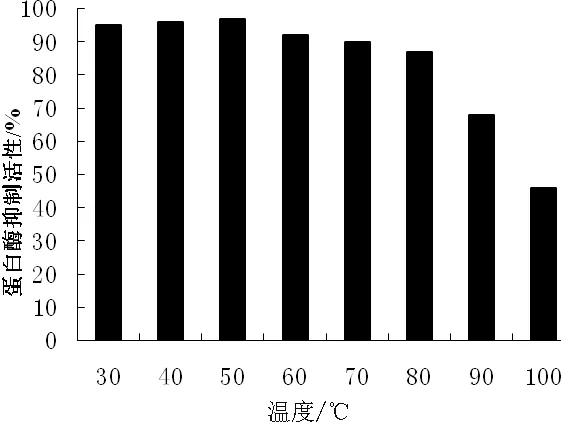
图6 温度对胰蛋白酶抑制活性的影响
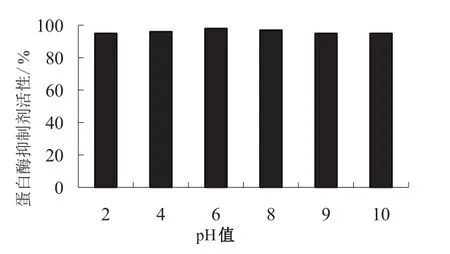
图7 pH对胰蛋白酶抑制活性的影响

