Wnt/β-catenin信号通路在Sfrp1抑制乳鼠心肌纤维化中的作用及机制
陶静,魏娴,马依彤
(1新疆维吾尔自治区人民医院,乌鲁木齐830001;2新疆医科大学第一附属医院)
心肌纤维化可导致心肌僵硬度增加、顺应性降低、心脏的收缩舒张功能受限,是独立的心血管疾病危险因素[1]。研究新的生物干预靶点以延缓或逆转疾病状态下的心肌重塑,可能为治疗心血管疾病提供新的切入点。Wnt/β-catenin信号通路涉及了机体的生长、发育以及细胞的增殖、凋亡等重要过程。近年研究发现,Wnt/β-catenin信号通路在心肌梗死后可被重新激活,参与调节心室重塑、心肌细胞凋亡、心肌纤维化等病理生理过程[2,3]。可溶性卷曲相关蛋白1(Sfrp1)对Wnt/β-catenin信号通路起负调控作用[4]。前期研究发现,Sfrp1过表达可高效抑制老龄小鼠Wnt/β-catenin通路活性,有效延缓老龄慢性心室重塑进程,进而降低老龄小鼠慢性心力衰竭的发生率和死亡率[5],然而抑制Wnt/β-catenin信号通路的活性能否有效延缓心肌纤维化尚不明确。2017年1月~2019年1月,本研究利用心肌成纤维细胞增殖模型,进一步明确Sfrp1过表达抑制Wnt/β-catenin信号通路活性抑制心肌纤维化的分子机制。
1 材料与方法
1.1 动物、试剂及仪器 日龄1~3 d的SD新生乳鼠8只,由新疆医科大学实验动物中心提供。DMEM培养基(高糖,Gibco,美国),胎牛血清(Gibco,美国),胰蛋白酶(Sigma,美国),转化生长因子-β1(TGF-β1,Sigma,美国),Ⅱ型胶原酶(Worthington,美国),抗兔β连环蛋白(β-catenin)、α平滑肌肌动蛋白(α-SMA)、GADPH多克隆抗体(CST,美国),抗兔蓬乱蛋白1(Dvl-1)多克隆抗体(Abcam,美国),Ⅰ型、Ⅲ型胶原ELIASA试剂盒(USCN,美国),Caspase-3、Caspase-7活性检测试剂盒(Promega,美国),MTT粉、DMSO(Sigma,美国)。dsAAV9-CMV-Sfrp1病毒构建包装纯化来自美国Virovek公司。恒温离心机(Thermo,美国),CO2培养箱(Thermo,美国),垂直流超净工作台(上海智城分析仪器制造有限公司,中国),倒置荧光显微镜(LEICA,德国)。
1.2 乳鼠心肌成纤维细胞原代培养 采用胰蛋白酶、Ⅱ型胶原酶依次消化法获取乳鼠心肌成纤维细胞,并用差速贴壁法进行纯化。分离培养具体方法如前期试验所述[6]。
1.3 细胞分组及干预方法 将细胞在恒定温度37 ℃、5%CO2、95%空气条件下的培养箱中培养,分为对照组、增殖模型组(TGF-β1组)、Sfrp1预处理组(TGF-β1+Sfrp1组)、激活剂实验组(TGF-β1+Sfrp1+Licl组)。对照组不加任何处理。TGF-β1组:心肌成纤维细胞换无血清DMEM培养液,加入TGF-β110 ng/mL刺激12 h,建立增殖模型。TGF-β1+Sfrp1组前期实验已经证实最佳转染复数为1×107(v.g/细胞),并于转染后5 d,目的基因表达达高峰[7,8],dsAAV9-Sfrp1病毒转染心肌成纤维细胞第5天,建立增殖模型,增殖模型建立方法同TGF-β1组。TGF-β1+Sfrp1+Licl组先将dsAAV9-Sfrp1转染心肌成纤维细胞,待孵育第4天+12 h时,将Wnt/β-catenin信号通路特异性激活剂Licl加入培养基,终浓度为20 mmol/L,同时建立增殖模型,方法同前。
1.4 Wnt/β-catenin信号通路蛋白β-catenin、Dvl-1表达检测 采用Western blotting法。收集各组细胞,经裂解提取总蛋白,BCA法测定蛋白浓度,加样总蛋白量40 μg,以上样缓冲液等体积稀释,4 ℃冰浴下SDS-PAGE电泳,4 ℃湿转到PVDF膜上,常规0.05%TBST洗膜,5%脱脂牛奶封闭1 h,孵育相应一抗、二抗,然后加入显色液,放入化学发光仪曝光。用Imagelab图像分析软件对Western blotting图片进行分析,以GADPH蛋白含量作为参照。
1.5 肌成纤维细胞分化标志蛋白α-SMA表达检测 采用Western blotting法。方法同上。
1.6 细胞增殖检测 采用MTT法。各组细胞加入MTT,确保其终浓度为5 mg/mL,37 ℃避光孵育4 h,加入150 μL DMSO,加入25 μL甘氨酸缓冲液。立即在490 nm处记录吸光度(OD)值。读板仪用空白组作为参照。
1.7 细胞周期检测 采用流式细胞术。收集各组细胞,加入预冷的70%~80%的乙醇,涡旋以混匀细胞,4 ℃避光过夜;分别用PBS、染色液清洗细胞去除所有的乙醇。加入500 μL PI综合染液,室温染色30 min后,上流式仪检测。
1.8 细胞上清液Ⅰ、Ⅲ型胶原含量检测 采用ELISA法。收集各组心肌成纤维细胞上清液,根据Ⅰ、Ⅲ型胶原ELISA试剂盒说明书按步骤进行操作。

2 结果
2.1 各组β-catenin、Dvl-1蛋白表达比较 与对照组相比,TGF-β1组β-catenin、Dvl-1蛋白表达均上调(P均<0.05);与TGF-β1组相比,TGF-β1+Sfrp1组β-catenin、Dvl-1蛋白表达均下调(P均<0.05);与TGF-β1+Sfrp1组相比,TGF-β1+Sfrp1+Licl组β-catenin、Dvl-1蛋白表达均上调(P均<0.05)。见图1、表1。

注:A为对照组;B为TGF-β1组;C为TGF-β1+Sfrp1组;D为TGF-β1+Sfrp1+Licl组。
图1各组β-catenin、Dvl-1蛋白表达情况(Western blotting法)
2.2 各组α-SMA蛋白表达比较 与对照组相比,TGF-β1组α-SMA蛋白表达升高(P<0.05);与TGF-β1组相比,TGF-β1+Sfrp1组α-SMA蛋白表达下调(P<0.05);与TGF-β1+Sfrp1组相比,TGF-β1+Sfrp1+Licl组α-SMA蛋白表达升高(P<0.05)。见图2、表1。

注:A为对照组;B为TGF-β1组;C为TGF-β1+Sfrp1组;D为TGF-β1+Sfrp1+Licl组。
图2 各组α-SMA蛋白表达情况(Western blotting法)
2.3 各组细胞增殖情况比较 与对照组相比,TGF-β1组OD值升高(P<0.05);与TGF-β1组相比,TGF-β1+Sfrp1组OD值降低(P<0.05);与TGF-β1+Sfrp1组相比,TGF-β1+Sfrp1+Licl组OD值升高(P<0.05)。见表1。
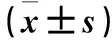
表1 各组β-catenin、Dvl-1、α-SMA蛋白表达
注:与对照组比较,*P<0.05;与TGF-β1组比较,﹟P<0.05;与TGF-β1+Sfrp1组比较,△P<0.05。
2.4 各组细胞周期比较 TGF-β1组G0/G1期、G2/M期细胞百分比均低于对照组,S期细胞百分比高于对照组(P均<0.05);TGF-β1+Sfrp1组G0/G1期、G2/M期细胞百分比均高于TGF-β1组,S期细胞百分比低于TGF-β1组(P均<0.05);TGF-β1+Sfrp1+Licl组G0/G1期、G2/M期细胞百分比均低于TGF-β1+Sfrp1组,S期细胞百分比均高于TGF-β1+Sfrp1组(P均<0.05)。见表2。
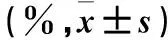
表2 各组细胞周期比较
注:与对照组比较,*P<0.05;与TGF-β1组比较,#P<0.05;与TGF-β1+Sfrp1组比较,△P<0.05。
2.5 各组细胞上清液Ⅰ、Ⅲ型胶原含量比较 与对照组相比,TGF-β1组中Ⅰ、Ⅲ型胶原蛋白含量均升高(P均<0.05);与TGF-β1组相比,TGF-β1+Sfrp1组中Ⅰ、Ⅲ型胶原蛋白含量均降低(P均<0.05);与TGF-β1+Sfrp1组相比,TGF-β1+Sfrp1+Licl组Ⅰ、Ⅲ型胶原含量均上升(P均<0.05)。见表3。
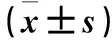
表3 各组细胞上清液Ⅰ、Ⅲ型胶原含量比较
注:与对照组比较,*P<0.05;与TGF-β1组比较,#P<0.05;与TGF-β1+Sfrp1组比较,△P<0.05。
3 讨论
心肌纤维化是心脏对各种刺激产生的适应性增生,是心肌重构的主要表现形式。心肌纤维化表现为心肌成纤维细胞增殖、胶原沉积、肌成纤维细胞表型转化等,均可增加心肌僵硬度,降低其顺应性,限制心脏的收缩功能和舒张功能,是多种心血管疾病共同的病理变化[9]。因此,寻找有效抑制心肌成纤维细胞的增殖、胶原分泌及肌成纤维细胞转化过程的药物,将可能有效延缓或阻滞心肌纤维化的发生发展。
目前在体外,关于Sfrp1对心肌梗死组织愈合过程的调控研究结果不一。Barandon等[10]研究表明,过表达Sfrp1的转基因小鼠可诱导GSK-3β的激活,逆转心肌梗死后缺血预处理的有益效应;另一方面,过表达Sfrp1的转基因小鼠可明显降低心肌梗死的面积,防止心脏破裂,改善心肌功能[11]。Salazar等[12]研究表明,在间充质干细胞条件培养基内,应用Sfrp1可显著性抑制肺成纤维细胞的增殖。本研究发现,与对照组相比,TGF-β1组β-catenin、Dvl-1蛋白表达均上调,提示TGF-β1刺激后,心肌成纤维细胞中Wnt/β-catenin信号通路成员β-catenin、Dvl-1表达明显升高,表明Wnt/β-catenin信号通路被激活,参与了心肌成纤维细胞过度增殖过程中。本研究发现,与TGF-β1组相比,TGF-β1+Sfrp1组β-catenin、Dvl-1蛋白表达均下调,提示Sfrp1过表达后β-catenin、Dvl-1表达下调;而与TGF-β1+Sfrp1组相比,TGF-β1+Sfrp1+Licl组β-catenin、Dvl-1蛋白表达均上调,提示当Licl重新激活Wnt/β-catenin信号通路后,β-catenin、Dvl-1表达再次上调,以上结果表明Sfrp1可有效地靶向抑制Wnt/β-catenin信号通路的活性。
最近的研究表明,Wnt/β-catenin信号通路成员在成纤维细胞内的过度表达可调节细胞的增殖、迁移和分化等功能。Hahn等[13]研究发现,β-catenin过表达可刺激新生大鼠心肌成纤维细胞的增殖、分化,诱导心肌细胞发生肥大反应。另外,还有研究表明,Wnt/β-catenin信号通路可能参与了内皮细胞及血管平滑肌细胞的增殖[14,15]。α-SMA的表达增强是肌成纤维细胞分化的标志。本研究发现,在TGF-β1刺激后,Wnt/β-catenin信号通路激活的同时心肌成纤维细胞过度增殖,胶原合成增多,成纤维细胞转化成肌成纤维细胞。而Sfrp1过表达可有效减轻心肌成纤维细胞的增殖,DNA合成降低,明显减少心肌成纤维细胞的S期百分率,升高G0/G1及G2/M期的百分率;在胶原合成方面,能抑制成纤维细胞胶原合成,使肌细胞外间质主要成分是Ⅰ、Ⅲ型胶原表达减弱;另外,Sfrp1还明显地降低了肌成纤维细胞标志性蛋白α-SMA表达,抑制成纤维细胞转化成肌成纤维细胞。当Licl同时作用,重新激活Wnt/β-catenin信号通路后,心肌成纤维细胞增殖,胶原合成能力,α-SMA表达均再次增强。表明Sfrp1过表达可能通过阻断Wnt/β-catenin信号通路活性,抑制心肌成纤维细胞的增殖、胶原合成及肌成纤维细胞的分化,从而缓解心肌纤维化的进展。
综上所述,Sfrp1可抑制心肌成纤维细胞Wnt/β-catenin信号通路活性,显著抑制心肌成纤维细胞的增殖、胶原合成和肌成纤维细胞的分化,有效缓解病理性心肌纤维化的进展。

