培元化瘀方对家兔慢性硬膜下血肿模型的干预作用及其作用机制研究
范小璇,梁格婷,赵晓平,王凯,李陇平,段海峰,方永军,侯文
慢性硬膜下血肿(chronic subdural hematoma,CSDH)是神经外科常见疾病之一,好发于老年人,其约占所有颅内血肿的10%,硬膜下血肿的25%[1]。目前,外科手术是临床治疗CSDH的首选,但CSDH患者术后复发风险较高,且部分临床症状不明显的患者不愿接受手术治疗,因此如何提高CSDH药物治疗效果成为临床亟待解决的问题之一。中医学理论认为,CSDH的主要病机是髓海空虚、瘀阻脑络,治当补肾益精填髓、化瘀通络,笔者根据其病机、治则采用经验方培元化瘀方治疗CSDH取得良好疗效,但其作用机制尚未明确。本实验于2018年3—9月完成,旨在探讨培元化瘀方对家兔CSDH模型的干预作用及其作用机制,现报道如下。
1 材料与方法
1.1 实验动物 清洁级健康新西兰家兔30只,由第四军医大学实验动物中心提供(动物合格证号:SCXK-军2012-0007),雌雄不限;月龄7~10个月,平均月龄(8.2±1.4)个月;体质量2.0~3.0g,平均体质量(2.5±0.5)kg。
1.2 造模方法 造模方法参照文献[2],具体如下:3%戊巴比妥(30 mg/kg)经耳缘静脉注射,麻醉成功后常规消毒、铺巾;以矢状缝右侧5 mm、冠状缝后方5 mm为中心,采用牙科钻磨开颅骨并形成3 mm×3 mm骨窗,充分暴露硬脑膜,确认无明显出血后采用尖刀在骨窗中央切开一小孔,将麻醉用硬膜外导管一端沿硬脑膜下腔平向颞部置入骨窗边缘约5 mm,置入过程中如遇阻力可略退并调整导管方向;经导管向颅内注水、冲洗,确认颅内无出血(注水无明显阻力、骨窗流出液体清亮)后采用小块明胶海绵填塞及骨蜡填塞、密封,缝合头皮后采用红霉素软膏涂抹创口;将麻醉用硬膜外导管另一端连接导管连接器并封管,并将导管固定在两耳根中间以防止导管脱落;分别于造模后第 3、6、9、12、15 天重复注血,造模后21天经颅脑CT扫描证实CSDH形成的家兔纳入实验。
1.3 分组及干预方法 造模过程中4只家兔死亡(其中1只死于麻醉过量,3只死于造模后注血阶段),颅脑CT扫描结果显示CSDH未形成的家兔5只,最终造模成功21只,造模成功率为80.8%。采用随机数字表法将造模成功的21只家兔分为模型组、低剂量组、高剂量组,每组7只。模型组家兔给予0.9%氯化钠溶液灌胃,15 ml/次,2次/d;低剂量组家兔给予培元化瘀方3.1 g/kg+0.9%氯化钠溶液稀释至15 ml后灌胃,2次/d;高剂量组家兔给予培元化瘀方6.2 g/kg+0.9%氯化钠溶液稀释至15 ml后灌胃,2次/d。三组家兔均连续灌胃7 d。
1.4 培元化瘀方的制备 培元化瘀方由黄芪30 g、当归15 g、(生)地黄12 g、(熟)地黄12 g、党参6 g、红花12 g、桃仁6 g、地龙6 g、黄精12 g、鹿角胶6 g、甘草6 g组成,统一由陕西中医药大学附属医院制剂中心煎制成1 g/ml溶液备用;根据“人和动物的体表面积计算法、不同种类动物之间药物剂量换算法”计算家兔培元化瘀方剂量,以人培元化瘀方剂量直接换算所得剂量为低剂量,2倍剂量为高剂量。
1.5 观察指标
1.5.1 Purty评分 采用Purty评分评估三组家兔灌胃前及灌胃后第1、3、5、7天神经功能缺损程度,该评分包括意识(计1~4分)、行为(计1~4分)、转头(计0~1分)、盘旋(计0~1分)及偏盲(计0~1分)5项,总分2~11分,其中2分表示无神经功能缺损,11分表示意识丧失或死亡,评分越高表明神经功能缺损程度越重[3]。
1.5.2 残余血肿量 三组家兔于最后1次灌胃次日采用3%戊巴比妥(30 mg/kg)经耳缘静脉注射,麻醉成功后切开头皮、暴露右侧颅骨,采用持针器咬除部分骨瓣并注意保持硬膜完整,采用微量进样器吸取硬膜下残余液体,即为残余血肿量。
1.5.3 病理学特征 剥离三组家兔血肿外膜及血肿同侧脑组织,常规甲醛固定、石蜡包埋及组织切片,采用HE染色法观察血肿外膜及血肿同侧脑组织形态学变化,并采用免疫组化染色法及IPP法分析血肿外膜血管内皮生长因子(vascular endothelial growth factor,VEGF)相对表达量;上述染色、镜下观察及VEGF的测定等均于西安交通大学医学部病理实验室完成。
1.6 统计学方法 采用SPSS 19.0统计软件进行数据分析,符合正态分布的资料以(±s)表示,重复测量数据采用双因素重复测量方差分析,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 Purty评分 时间与方法在Purty评分上存在交互作用(P<0.05);时间在Purty评分上主效应显著(P<0.05);方法在Purty评分上主效应显著(P<0.05)。灌胃后第7天低剂量组、高剂量组家兔Purty评分低于灌胃前,差异有统计学意义(P<0.05);灌胃后第7天高剂量组家兔Purty评分低于模型组、低剂量组,低剂量组家兔Purty评分低于模型组,差异有统计学意义(P<0.05,见表1)。
表1 三组家兔灌胃前及灌胃后不同时间点Purty评分比较(±s,分)Table 1 Comparison of Purty score in three groups of rabbits before intragastric administration and at different time points after intragastric administration
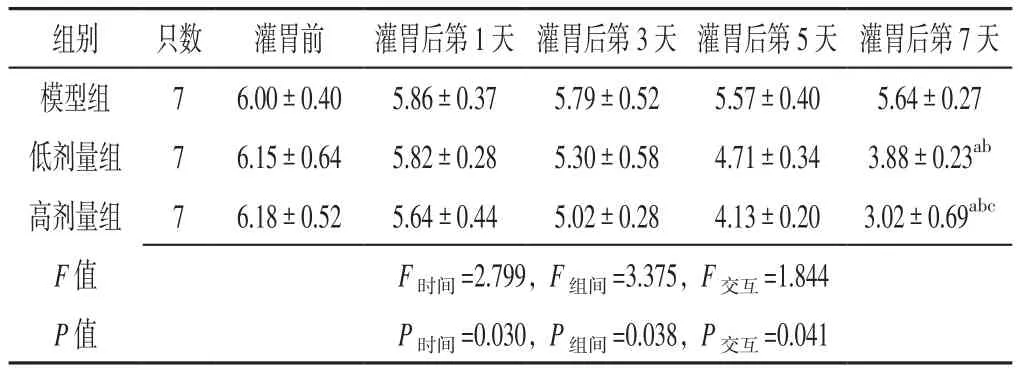
表1 三组家兔灌胃前及灌胃后不同时间点Purty评分比较(±s,分)Table 1 Comparison of Purty score in three groups of rabbits before intragastric administration and at different time points after intragastric administration
注:与灌胃前比较,aP<0.05;与模型组比较,bP<0.05;与低剂量组比较,cP<0.05
组别 只数 灌胃前 灌胃后第1天 灌胃后第3天 灌胃后第5天 灌胃后第7天模型组 7 6.00±0.40 5.86±0.37 5.79±0.52 5.57±0.40 5.64±0.27低剂量组 7 6.15±0.64 5.82±0.28 5.30±0.58 4.71±0.34 3.88±0.23ab高剂量组 7 6.18±0.52 5.64±0.44 5.02±0.28 4.13±0.20 3.02±0.69abc F值 F时间=2.799,F组间=3.375,F交互=1.844 P值 P时间=0.030,P组间=0.038,P交互=0.041
2.2 残余血肿量 高剂量组有1只家兔血肿完全吸收而未成功吸取出硬膜下残余液体。模型组、低剂量组、高剂量组家兔残余血肿量分别为(56.95±4.83)、(39.57±4.04)、(29.89±5.22)μl, 差 异 有 统 计 学 意 义(F=25.292,P<0.05);高剂量组家兔残余血肿量少于低剂量组、模型组,低剂量组家兔残余血肿量少于模型组,差异有统计学意义(P<0.05)。

图1 三组家兔血肿外膜病理学特征(HE染色,×400)Figure 1 Pathological features of hematoma adventitia in three groups of rabbits
2.3 病理学特征 (1)三组家兔血肿外膜均出现大量新生毛细血管、成纤维细胞、炎性细胞,且成纤维细胞活化明显,而与模型组相比,低剂量组、高剂量组家兔纤维组织趋于成熟、炎性反应较轻(见图1)。(2)模型组家兔血肿同侧脑组织内存活神经元数量少于低剂量组、高剂量组,而低剂量组与高剂量组家兔血肿同侧脑组织内存活神经元数量接近(见图2)。(3)三组家兔血肿外膜内皮细胞、纤维组织及浆细胞表面均见VEGF阳性表达(见图3)。模型组、低剂量组、高剂量组家兔血肿外膜VEGF相对表达量分别为(0.132±0.011)、(0.102±0.009)、(0.097±0.010),差异有统计学意义(F=15.887,P<0.05);模型组家兔血肿外膜VEGF相对表达量高于低剂量组、高剂量组,差异有统计学意义(P<0.05),而低剂量组与高剂量组家兔血肿外膜VEGF相对表达量比较,差异无统计学意义(P>0.05)。

图2 三组家兔血肿同侧脑组织病理学特征(HE染色,×400)Figure 2 Pathological features of ipsilateral brain tissue of hematoma in three groups of rabbits

图3 三组家兔血肿外膜VEGF表达情况(免疫组化染色,×400)Figure 3 Expression of VEGF in hematoma adventitia in the three groups of rabbits
3 讨论
目前,CSDH的治疗仍以钻孔引流术为主,但由于CSDH病变位置特殊且在老年人群高发,因此即使经及时、正规手术治疗,但整体治疗效果并不十分理想,术后复发率介于2.3%~33.0%[4]。近年来,“CSDH是一种炎性血管生成性疾病”的观点得到越来越多的认可,且研究证实CSDH复发患者VEGF水平及血肿外膜VEGF表达量与非复发患者相比明显升高[5-6]。研究表明,CSDH外膜质地较厚并含有丰富的纤维蛋白溶酶原及大量新生毛细血管,但这种新生毛细血管内皮细胞层薄弱、基膜不成熟、可反复出血与生成,进而刺激硬脑膜边缘细胞不断增生并促使新膜持续形成,最终形成恶性循环[7],而VEGF作为最强的促血管生成调控因子在CSDH患者血肿腔及外膜呈高表达亦证实了这一机制[8]。OSUKA 等[9]研究发现,VEGF可激活血肿外膜上有丝分裂原活化蛋白激酶信号通路,继而促进外膜血管生成,因此抑制血肿、血肿外膜血管再生及VEGF的表达是控制CSDH复发的有效途径。此外,CSDH在老年人群高发且多集中于66~74岁[10],>60岁老年人CSDH复发风险明显升高[11],而脑萎缩所致出血是导致老年人CSDH发生及复发的重要原因[12],因此老年人脑萎缩这一特点值得关注,且是治疗CSDH的关键问题之一。
中医学理论认为,CSDH属“头痛”范畴,而头部创伤是CSDH的主要诱因[13]。头部创伤,伤及脑络,络伤血溢,瘀血内停,阻滞脑络,而“肾生髓,脑为髓海”,脑为元神之府,肾中精气足则髓盈,上注于脑,可统帅调节全身精神活动。老年人由于肾中精气渐衰,无以灌注而致脑髓空虚、神无所归,头伤日久,耗气伤精,气机失调致气血运行失常,瘀阻于络,脑失所养,故头晕头痛,气机逆乱,元气亏虚,无源化生行血,不能布达四肢,气血瘀滞,血脉痹阻则肢体萎软偏废。国医大师任继学教授认为,髓由肾精所化,脊髓上行于脑,泌其津液润养脑髓[14],因此CSDH的主要病机是肾精亏虚、瘀阻脑络,为本虚标实之证,病位在脑且与肾密切相关,治当以补肾益髓,化瘀通络为法。笔者根据上述理论拟定培元化瘀方,方中黄芪益气补三焦,(熟)地黄补肾益髓,当归补血活血,三者共为君药,益气补肾活血;桃仁、红花破血祛瘀,黄精补精益髓,鹿角胶温补肝肾、益精养血,共为臣药,助(熟)地黄补肾,助党归化瘀;佐药党参益气行气,地龙通络祛瘀,(生)地黄佐制补肾之品燥热;甘草为使,调和诸药,共同发挥培元生精益髓、行气化瘀通络之功效。
本研究结果显示,灌胃后第7天高剂量组家兔Purty评分低于模型组、低剂量组,低剂量组家兔Purty评分低于模型组,表明培元化瘀方可有效减轻CSDH家兔神经功能缺损程度且呈剂量依赖性;高剂量组家兔残余血肿量少于低剂量组、模型组,低剂量组家兔残余血肿量少于模型组,表明培元化瘀方可有效促进CSDH家兔血肿吸收。本研究进一步通过镜下观察发现,与模型组相比,低剂量组、高剂量组家兔纤维组织趋于成熟、炎性反应较轻且血肿外膜VEGF相对表达量较低,与既往研究结果一致[5-6],从病理生理机制方面证实培元化瘀方能促进CSDH家兔血肿吸收,而降低血肿外膜VEGF表达、减少病理性血管形成(如减慢血肿外膜新生脆弱血管生成速度、减缓新生血管反复再出血)可能是培元化瘀方治疗CSDH的重要机制;但本研究未发现低剂量组与高剂量组家兔血肿外膜VEGF相对表达量存在差异,因此培元化瘀方通过抑制VEGF表达而治疗CSDH是否存在剂量依赖性仍需进一步深入研究。
需要指出的是,中医学所指“脑髓”的现代生物学基础是脑内神经元和神经营养因子,脑内神经营养因子减少、神经元大量萎缩或丢失则造成“髓海不足”[12,15],且已有研究证实“补肾”与“益脑髓”之间存有明显的生物学关系[16]。由于神经元凋亡及神经干细胞增殖、分化与肾精盛衰有关,而补肾中药能促进神经干细胞更新,因此补肾填精法可作为治疗中枢神经系统病变的重要原则。本研究结果显示,与模型组相比,低剂量组、高剂量组家兔血肿同侧脑组织内存活神经元数量较多,提示培元化瘀方可抑制CSDH家兔受压脑组织神经元坏死、凋亡,而这可能也是培元固本、益精填髓中药治疗CSDH的另一优势。
综上所述,培元化瘀方可有效减轻CSDH家兔神经功能缺损程度并促进血肿吸收,其作用机制可能与抑制血肿及血肿外膜炎性反应、VEGF的表达、受压脑组织神经元坏死及凋亡等有关;但本研究为家兔实验且样本量较小、关注点集中于血肿外膜血管新生方面,培元化瘀方对促进血肿外膜血管新生炎症的干预作用及中药组方多靶点干预机制等仍需进一步深入研究。
——蔡培元、林风眠在杭州 纸本水墨 林皖

