基于TiO2 NRs@ZnIn2S4NSs复合材料的谷胱甘肽光电化学传感器的构建与应用
唐小强 陈裕雲 罗燕妮 韦富存 杜方凯 谭学才
摘要:采用简便的两步水热原位生长法,以FTO为基底制备了二氧化钛纳米棒(TiO2nanorods,TiO2NRs)/硫铟锌纳米片(ZnIn2S4nanosheets,ZnIn2S4NSs)复合材料(TiO2NRs@ZnIn2S4NSs/FTO),并基于此构建了一种新型谷胱甘肽(GSH)光电化学传感器。分别采用扫描电镜(SEM)、X射线能谱仪(EDX)、X射线粉末衍射仪(XRD)和紫外-可见漫反射吸收光谱(UV-visDRS)对TiO2NRs@ZnIn2S4NSs/FTO复合材料的形貌、结构和性能进行了表征,通过电流-时间法(i-t)和电化学阻抗法(EIS)研究了PEC传感器的性能。结果表明,光电流大小与GSH浓度在1~130μmol/L范围内呈良好的线性关系,相关系数R=0.9919,检出限为0.1μmol/L(S/N=3)。此传感器具有较高的稳定性和良好的选择性及重现性,将其应用于市售的谷胱甘肽片和注射用还原型谷胱甘肽的检测,加标回收率为99%~110%。
关键词:二氧化钛纳米棒;硫铟锌纳米片;光电化学传感器;谷胱甘肽
1引言
谷胱甘肽(Glutathione,GSH)是由谷氨酸、半胱氨酸及甘氨酸三种氨基酸组成的一种三肽化合物,具有解毒、抗氧化、护肝、维持细胞稳态和增强免疫力等多种重要生理功能[1,2]。研究发现,帕金森综合症、阿尔茨海默氏症等疾病的发生与谷胱甘肽在人体中的含量变化有关[3~5]。因此,开发灵敏检测GSH含量的分析方法,具有十分重要的实际意义。目前,检测谷胱甘肽的分析方法主要有表面增强拉曼光谱法[6]、高效液相色谱法[7]、毛细管电泳法[8]、电化学分析法[9]、荧光光谱法[10]和比色法[11]等,尽管这些分析方法各有优点,但仍存在仪器设备昂贵、成本高或者样品前处理复杂、耗时长等不足。光电化学(Photoelectrochemical,PEC)传感器利用检测物与光电化学活性材料之间的相互作用产生的光电流变化和检测物浓度之间的关系实现定量分析[12]。与传统的光学和电化学方法相比,由于激发信号和检测信号完全分离,PEC传感器具有較低的背景信号和更高的灵敏度[13]。目前,大多数PEC传感器都是基于半导体材料构建,如TiO2[14,15]、CdS[16]和ZnO[17,18]等。其中,TiO2具有良好的光稳定性、价格低廉且安全无毒等特性,成为研究最成熟的光电活性材料之一。然而,TiO2禁带宽度较大(3.0~3.2eV),仅能吸收紫外光,且光生电子-空穴易发生复合,极大限制了其应用范围。ZnIn2S4是一种三元硫属化合物半导体材料,其带隙为2.34~2.55eV,对可见光具有良好的吸收且化学稳定性高[19,20]。将ZnIn2S4与TiO2复合构筑异质结构,可以增强对可见光的吸收,有效抑制光生电子-空穴的复合,从而提高材料光催化活性[21]。目前,基于TiO2NRs@ZnIn2S4NSs复合材料构建的PEC传感器鲜有报道。
本研究采用简单的两步水热反应,在FTO电极上原位生长ZnIn2S4NSs包覆TiO2NRs复合材料(TiO2NRs@ZnIn2S4NSs/FTO),利用TiO2NRs@ZnIn2S4NSs材料优异的光电化学性能,构建了一种检测谷胱甘肽的PEC传感器。基于GSH可被光生空穴氧化生成氧化型谷胱甘肽(Glutathionedisulfide,GSSG),降低光生电子-空穴对复合率,从而增大光电流的原理,实现了对GSH的灵敏检测。传感器制备及检测原理如图1所示。
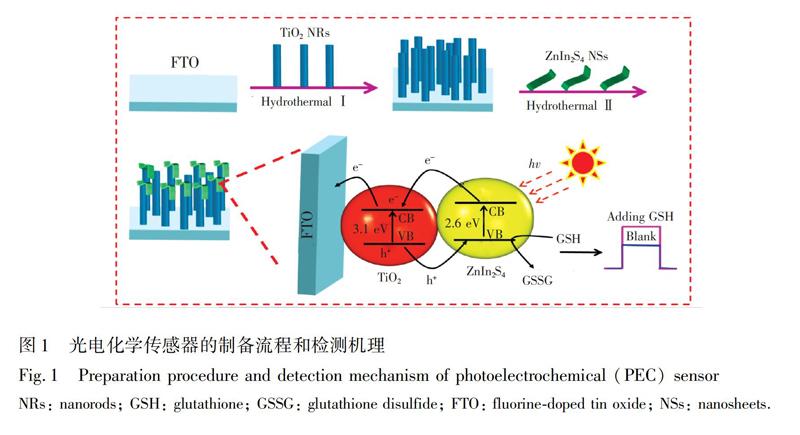
2实验部分
2.1仪器与试剂
CHI760D(上海辰华仪器有限公司);PEAC200A型光电化学反应仪(天津艾达恒晟科技发展有限公司);NovaNanoSEM场发射扫描电子显微镜(荷兰Philips公司);U-3900紫外-可见吸收光谱仪(日本HITACHI公司);FTO导电玻璃(华南湘城科技有限公司)。
钛酸四丁酯(C16H36O4Ti)、三氯化铟(InCl3·4H2O)、硫代乙酰胺(CH3CSNH2,TAA)、无水NaSO4等均为分析纯(上海麦克林生化科技有限公司)。谷胱甘肽片(0.1g,重庆药友制药有限责任公司);注射用还原型谷胱甘肽(0.6g,重庆药友制药有限责任公司)。实验用水为超纯水。
2.2修饰电极的制备
FTO电极(5×0.8cm)预处理:将FTO依次用丙酮、无水乙醇、超纯水超声清洗20min,待自然晾干后,100℃干燥2h。
参照文献\[22]的方法制备TiO2NRs:在100mL烧杯中加入30mL水和30mL浓HCl,混合搅拌5min后,加入1mL钛酸四丁酯,继续搅拌25min,然后将5mL混合溶液移至25mL聚四氟乙烯反应釜中,将洗净的FTO电极倚靠在反应釜内,150℃下反应4h。待其自然冷却后,依次用水和无水乙醇洗涤,室温下晾干,然后在空气气氛下450℃煅烧60min(升温速率5℃/min),即可制得TiO2NRs/FTO。
根据文献\[23,24]方法制备ZnIn2S4NSs:分别称取71.89mgZnSO4·7H2O、146.62mgInCl3·4H2O和75.13mgTAA溶于10mL水中,混合搅拌30min,移取5mL混合溶液至25mL聚四氟乙烯反应釜中,然后将上述制得的TiO2NRs/FTO放入反应釜中,150℃反应60min,待自然冷却后,依次用水和乙醇洗涤,60℃真空干燥12h,所得样品记为TiO2NRs@ZnIn2S4NSs/FTO。
2.3实验方法
采用三电极体系,以TiO2NRs@ZnIn2S4NSs/FTO为工作电极,Ag/AgCl电极为参比电极,Pt电极为辅助电极。以白光为激发光源,无水NaSO4溶液(pH=7.0,0.1mol/L)为电解液,在0V偏压下,采用电流-时间曲线法对GSH进行光电化学检测。
3结果与讨论
3.1光电材料的表征
由TiO2NRs的扫描电镜(SEM)图(图2A和2B)可见,在FTO电极表面水热原位生长的TiO2为棒状结构。由TiO2NRs@ZnIn2S4NSs的SEM图(图2C)可见,TiO2NRs@ZnIn2S4NSs是由许多纳米片相互交替分布而构成的片状结构,均匀负载在TiO2NRs表面上。由TiO2NRs@ZnIn2S4NSs复合材料的X射线能谱(EDX,图2D)可知,此复合材料中同时含有Ti、O、Zn、In和S等元素。

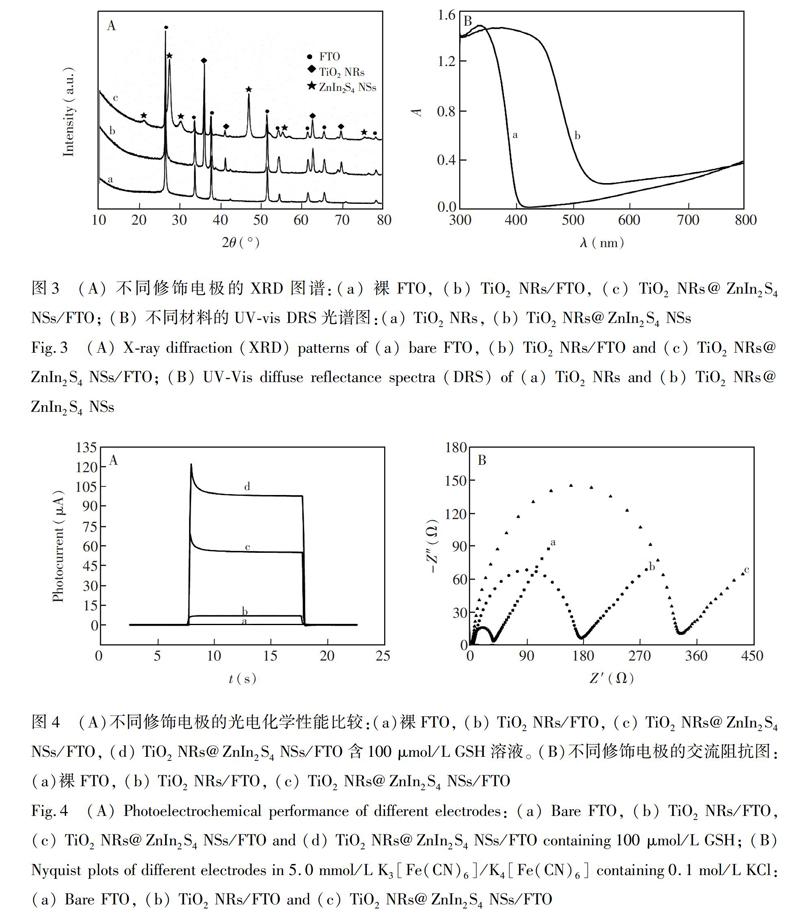
采用X射線衍射技术(XRD)对所制备样品作进一步表征。由不同修饰电极的XRD图谱(图3A)可见,与裸FTO电极(a线)相比,TiO2NRs/FTO在36.1°、41.3°、62.8°和69.8°处出现了4个明显的衍射峰(b线),分别对应于四方金红石相TiO2(JCPDS21-1276)的(101)、(111)、(002)和(112)面,说明所制备的TiO2NRs为金红石相[25]。对于TiO2NRs@ZnIn2S4NSs/FTO(c线),除了有源自FTO基底和TiO2NRs的衍射峰之外,还观察到了明显的、可归属于六方相结构ZnIn2S4衍射信号(JCPDS65-2023)[26]。上述结果表明,在FTO基底上已成功制备了ZnIn2S4NSs包覆TiO2NRs的复合材料。
由图3B可知,TiO2NRs光吸收波长位于﹤400nm的紫外光区,经ZnIn2S4NSs包覆后,光吸收波长范围红移至可见光区,说明TiO2NRs@ZnIn2S4NSs复合材料可提高对可见光的吸收和利用率。
3.2不同修饰电极的光电性能和交流阻抗表征
不同修饰电极在外加电位为0V条件下所产生的光电流曲线如图4A所示,裸FTO电极(曲线a)在光照射下几乎不产生光电流,而TiO2NRs/FTO(曲线b)和TiO2NRs@ZnIn2S4NSs/FTO(曲线c)分别产生约6.6μA和55.4μA的光电流,TiO2NRs@ZnIn2S4NRs/FTO生成的光电流比TiO2NRs/FTO提高了8.4倍。此结果表明,TiO2NRs和ZnIn2S4NSs复合形成的异质结构,有效增强了材料对可见光的吸收,显著提高了光电转换效率[27]。当加入GSH溶液时,TiO2NRs@ZnIn2S4NSs/FTO电极的光电流得到进一步提高(曲线d),这是由于可充当电子供体的GSH被Znln2S4NSs的光生空穴氧化,生成GSSH,促进了光生电子-空穴分离,降低了光生电子和空穴的复合量[28]。
电化学阻抗谱技术(EIS)是研究电极表面性质的一种有效方法,Nyquist阻抗谱图中,位于高频区的半圆直径大小相当于电子传递阻抗(Ret)。如图4B所示,裸FTO电极的阻抗值最小(Ret=35Ω,曲线a),说明\[Fe(CN)6]3Symbolm@@/4Symbolm@@在裸FTO电极界面上电子传递阻力较小;TiO2NRs/FTO电极的阻抗值明显增大(Ret=170Ω,曲线b),这可能是由于负载的TiO2NRs阻碍了探针\[Fe(CN)6]3Symbolm@@/4Symbolm@@在电极表面的电子转移所致;TiO2NRs@ZnIn2S4NSs/FTO的阻抗值最大(Ret=325Ω,c线),这是由于经ZnIn2S4NSs包覆,\[Fe(CN)6]3Symbolm@@/4Symbolm@@的电子转移阻力进一步地增大,导致其阻抗值继续增加。
3.3实验条件的优化
3.3.1水热反应条件对光电流值的影响考察了水热反应的时间和温度对ZnIn2S4NSs包覆TiO2NRs复合材料的光电化学性能的影响。在15~90min反应时间内,TiO2NRs@ZnIn2S4NSs/FTO的光电流值随着反应时间的延长而增大,反应时间为60min时,其光电流值达到最大值。在6个不同反应温度(110、130、150、170、190、210℃)中,150℃时TiO2NRs@ZnIn2S4NSs/FTO的光电流最大。因此,选取60min和150℃为水热反应的最佳时间和温度。
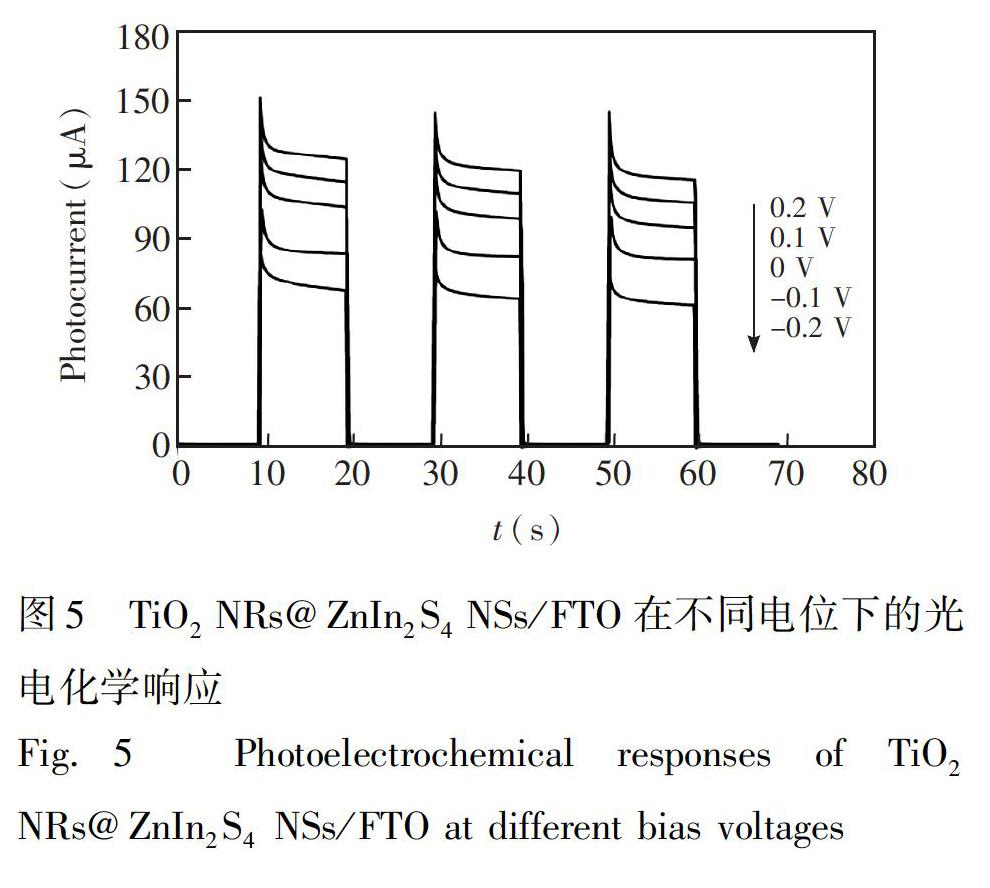
3.3.2工作电位对光电流值的影响如图5所示,在Symbolm@@0.2~+0.2V范围内,TiO2NRs@ZnIn2S4NSs/FTO光電流值随着电位的增加而增大,0V时光电流大小相当于+0.2V处产生光电流值的85%。但是,过高的正电位可能会将GSH氧化生成GSSG,影响测定结果。此外,低电位有利于消除共存于真实样品中的其它还原物质的干扰[29]。因此,综合考虑传感器的选择性和灵敏度,采用0V作为此PEC传感器的工作电位。
3.4光电化学传感器检测GSH的性能
图6A为此PEC传感器检测不同浓度的GSH的光电流响应图,图6B为TiO2NRs@ZnIn2S4NSs/FTO光电响应值与GSH浓度的线性关系曲线,二者在1~130μmol/L范围内呈良好的线性关系,线性方程为I(μA)=60.41+0.51C(μmol/L),相关系数为0.9919,检出限为0.1μmol/L(S/N=3)。与相关文献报道的检测GSH方法相比(表1),所构建的PEC传感器具有较低的检出限。
3.5电极的稳定性、重现性和选择性
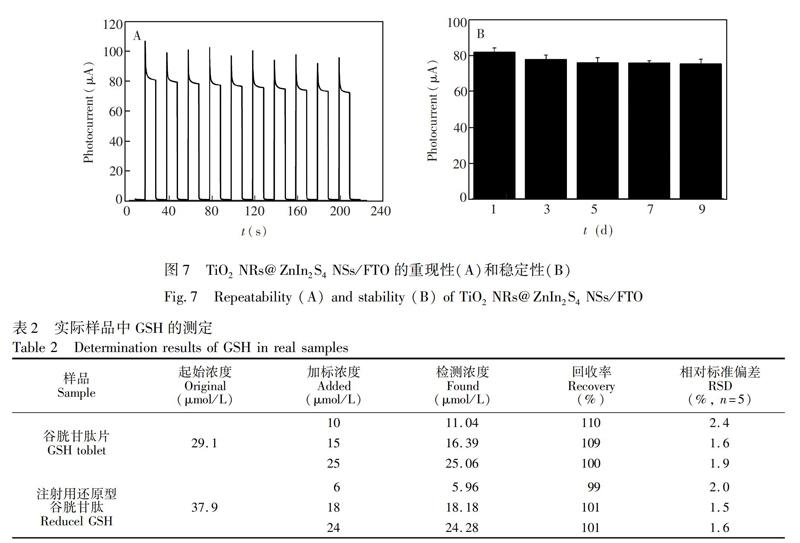
在相同的优化条件下,分别制备5根TiO2NRs@ZnIn2S4NSs/FTO电极,用于GSH溶液的测定,其光电流的相对标准偏差(RSD)为1.9%。采用同一根电极对50μmol/LGSH溶液连续测定10次(图7A),其光响应电流未见明显变化,RSD=3.4%。此外,将同一批制备好的工作电极于室温条件下封存,每隔一天取出,对50μmol/LGSH溶液进行光电流测试,9d后其光电流响应值降到初始值的93%(图7B)。上述结果说明此修饰电极具有良好的重现性和稳定性。

选择几种常见的氨基酸以及样品组分作为干扰成分,加入到60μmol/LGSH溶液中进行检测。在误差允许范围内,50倍的谷氨酸、赖氨酸、甘氨酸、亮氨酸、精氨酸,100倍的水杨酸、柠檬酸、葡萄糖、蔗糖、甘露醇、Zn2+、Mg2+、ClSymbolm@@、CO2Symbolm@@3、NOSymbolm@@3对测定没有影响,表明此传感器对GSH具有较好的选择性。
3.6实际样品分析
采用本方法测定市售的谷胱甘肽片和注射用还原型谷胱甘肽中的GSH,结果如表2所示,加标回收率分别为100%~110%和99%~101%,平行测定5次,样品相对标准偏差(RSD)均小于5%,说明本分析方法具有较好的准确度。
References
1MeisterA,AndersonME.Annu.Rev.Biochem.,1983,52:711-760
2FrancoR,PanayiotidisMI,CidlowskiJA.J.Biol.Chem.,2007,282(42):30452-30465
3RoedererM,StaalFJ,AndersonM,RabinR,RajuPA,HerzenbergLA,HerzenbergLA.Ann.N.Y.Acad.Sci.,1993,667:113-125
4SeshadriS,BeiserA,SelhubJ,JacquesPF,RosenbergIH,D'AgostinoRB,WilsonPWF,WolfPA.N.Engl.J.Med.,2002,346(7):476-483
5WuGY,FangYZ,YangS,LuptonJR,TurnerND.J.Nutr.,2004,134:489-492
6WangWK,ZhangLM,LiL,TianY.Anal.Chem.,2016,88(19):9518-9523
7JanesL,LisjakK,VanzoA.Anal.Chim.Acta,2010,674:239-242
8TsardakaEC,ZacharisCK,TzanavarasPD,ZotouA.J.Chromatogr.A.,2013,1300:204-208
9WangYH,JiangL,ChuL,LiuW,WuS,WuYH,HeXX,WangKM.Biosens.Bioelectron.,2017,87:459-465
10WangW,HouXS,LiX,ChenC,LuoXL.Anal.Chim.Acta,2018,998:45-51
11ChiMQ,ChenSH,ZhongMX,WangC,LuXF.Chem.Commun.,2018,54:5827-5830
12WANGGuang-Li,XUJing-Juan,CHENHong-Yuan.Sci.ChinaSer.B,2009,39(11):1336-1347
王光丽,徐静娟,陈洪渊.中国科学(B辑:化学),2009,39(11):1336-1347
13ZhaoWW,XuJJ,ChenHY.Chem.Soc.Rev.,2015,44(3):729-741
14LuoYN,MiY,TanXC,ChenQY,FengDF,AiCH.Anal.Methods,2019,11:375-380
15LiuSS,CaoHJ,WangXY,TuWW,DaiZZ.Nanoscale,2018,10:16474-16478
16CHENQuan-You,TANXue-Cai,DUFang-Kai,FENGDe-Fen,LUOYan-Ni,AIChen-Hao,WUYe-Yu,YANJun.ChineseJ.Anal.Chem.,2018,46(2):232-238
陳全友,谭学才,杜方凯,冯德芬,罗燕妮,艾晨昊,吴叶宇,严军.分析化学,2018,46(2):232-238
17ZhaoCZ,KongYY,LiuLC,WangXY.Electrochim.Acta,2018,273:10-16
18HEYan-Yan,GEJun-Ying,ZHAOChang-Zhi.Chem.J.Chin.Universities,2016,37(12):2144-2149
何艳艳,葛军营,赵常志.高等学校化学学报,2016,37(12):2144-2149
19FangF,ChenL,ChenYB,WuLM.J.Phys.Chem.C,2010,114(6):2393-2397
20WangJG,ChenYJ,ZhouW,TianGH,XiaoYT,FuHY,FuHG.J.Mater.Chem.A,2017,5:8451-8460
21YangG,ChenDM,DingH,FengJJ,ZhangJZ,ZhuYF,HamidS,BahnemannDW.Appl.Catal.B,2017,219:611-618
22LiuB,AydilES.J.Am.Chem.Soc.,2009,131(11):3985-3990
23PengSJ,ZhuPN,ThavasiV,MhaisalkarSG,RamakrishnaS.Nanoscale,2011,3:2602-2608
24LiuQ,LuH,ShiZW,WuFL,GuoJ,DengKM,LiL.ACSAppl.Mater.Interfaces,2014,6(19):17200-17207
25ChenHP,TangN,ChenM,ChenDH.NanoscaleRes.Lett.,2016,11:145-153
26ChenYJ,HuSW,LiuWJ,ChenXY,WuL,WangXX,LiuP,LiZH.DaltonTrans.,2011,40:2607-2613
27YinXH,ShengPT,ZhongFF,NguyenVM,CaiQY,GrimesC.NewJ.Chem.,2016,40:6675-6685
28TuWW,DongYT,LeiJP,JuHX.Anal.Chem.,2010,82(20):8711-8716
29ZhaoXM,ZhouSW,ShenQM,JiangLP,ZhuJJ.Analyst,2012,137:3697-3703
30LiuZE,CaiXH,LinXF,ZhengYJ,WuYT,ChenPP,WengSH,LinLQ,LinXH.Anal.Methods,2016,8:2366-2374
31AreiasMCC,ShimizuK,ComptonRG.Analyst,2016,141:2904-2910
32KangZ,YanXQ,WangYF,ZhaoYG,BaiZM,LiuYC,ZhaoK,CaoSY,ZhangY.NanoRes.,2016,9(2):344-352

