超声评价2型糖尿病患者心外膜脂肪厚度与内皮功能的相关性
周丽君,张宇虹,苏本利
(大连医科大学附属第二医院 1.超声科,2.内分泌科,辽宁 大连 116027)
作为一种发病率逐年升高的慢性病,糖尿病可引起心脏、血管等诸多严重并发症。其中血管内皮功能障碍是糖尿病患者发生血管并发症的最重要原因。内皮功能通常用血流介导的血管舒张功能来反映。有研究结果表明,2 型糖尿病(type 2 diabetes mellitus,T2DM)患者心外膜脂肪组织存在异常增厚,心外膜脂肪组织与T2DM 患者颈动脉粥样硬化关系密切[1]。然而,目前国内尚没有T2DM 患者心外膜脂肪组织与内皮功能障碍关系的研究报道。本研究旨在通过超声技术获得T2DM 患者的心外膜脂肪组织及血管舒张功能,并研究两者的关系。
1 资料与方法
1.1 一般资料
选取2017年12月—2018年9月大连医科大学附属第二医院收治的T2DM 患者120 例。其中,男性58 例,女性62 例;年龄34 ~76 岁,平均(58.79± 7.63)岁。患者均符合1999年世界卫生组织制定的T2DM 诊断标准[2]。根据T2DM 病程长短分为病程≤10年组和病程>10年组,均为60 例。病程≤ 10年组患者中男性27 例,女性33 例;年龄34 ~73 岁,平均(59.13±8.32)岁。病程>10年组患者中男性31例,女性29 例;年龄43 ~76 岁,平均(59.97±7.25)岁。另外,选取60 例健康志愿者作为对照组。其中,男性28 例,女性32 例;年龄38 ~68 岁,平均(57.31± 7.30)岁。排除高血压、冠状动脉粥样硬化性心脏病、心包积液、周围动脉疾病、大动脉炎、伴有临床症状的出血性和缺血性中风、急慢性肝肾衰竭、血液病、自身免疫性疾病、急慢性感染及糖尿病急性并发症患者。各组年龄、性别比较,差异无统计学意义 (P>0.05)。
1.2 仪器及方法
1.2.1 心外膜脂肪组织的超声测量 使用Vivid E9彩色超声诊断仪(美国GE 公司),M5S-D 探头,频率为1.5 ~4.5 MHz。测量方法:同步记录心电图,受检者左侧卧位,取胸骨旁左室长轴切面,以主动脉根部为基准,使超声波中线垂直于右心室游离壁和主动脉瓣环,测量右室游离壁心肌外层和脏层心包膜之间的低回声区,于舒张末期(即同步心电图R 波的峰值)测量,记录3 个心动周期,取平均值作为结果,所有操作由同一人完成[3]。见图1。
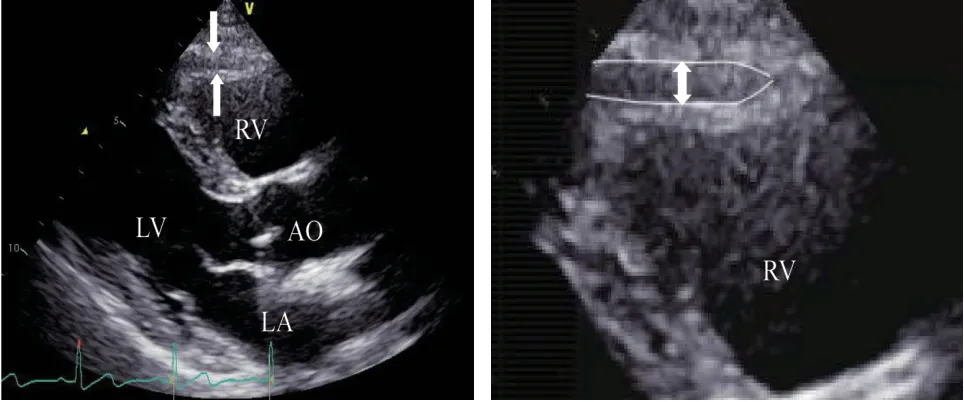
图1 心外膜脂肪组织超声图
1.2.2 内皮功能的测定 内皮功能采用血管舒张功能来评估,方法如下:研究对象在检测前应禁食8 ~12 h,在安静、温度适宜的房间内进行。此外,研究前4 ~6 h,研究对象应停止剧烈运动,不能摄入可能影响血管舒张功能的物质,如咖啡因、高脂肪食物及维生素C 等。使用Vivid E9 彩色超声诊断仪,探头频率为11 MHz。受试者取仰卧位,同步记录心电图,右上肢外展15,于右肘上2 ~10 cm 范围内获得肱动脉纵切面最清晰的图像,冻结图像并标记位置。测量静息时舒张末期(同步心电图R 波峰值)肱动脉内径为基础值(D0)。将血压计袖带置于右上臂,将袖带充气至收缩压以上至少50 mmHg 并保持5 min。在袖带放气之后的30 s ~2 min 连续记录肱动脉的纵切面图像,同一位置测量肱动脉舒张末期内径(D1)。内径测量为动脉前后壁内膜层与内膜层之间的距离。血管舒张功能计算方式为(D1-D0)/D0×100%。取3 次测量平均值作为结果,整个过程由同一人完成[4]。见图2。
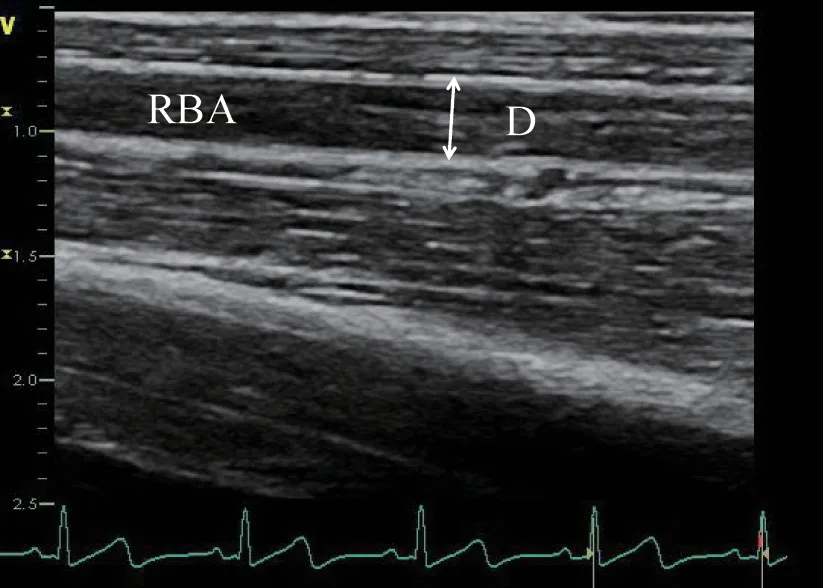
图2 肱动脉内径超声图
1.2.3 临床和实验室指标检测 研究对象均早晨穿单衣、空腹且赤脚状态下进行体重和身高的测量,计算BMI。将带尺经脐上0.5 ~1.0 cm 处或选腰部最粗处水平绕一周测量腰围。采集空腹静脉血,测量糖化血红蛋白(hemoglobin A1C,HbA1C)、总胆固醇(total cholesterol,TC)、甘油三酯(total glyceride,TG)、低密度脂蛋白(low density lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)、空腹血浆葡萄糖(fasting plasma glucose,FPG)、空腹胰岛素(fasting insulin,FINS)、C 肽及超敏C 反应蛋白(high sensitivity C-reactive protein,hs-CRP)。
1.3 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,进一步的两两比较用LSD-t检验;计数资料以构成比表示,比较用χ2检验;相关分析用Pearson 法,影响因素的分析采用多元线性逐步回归模型,P<0.05 为差异有统计学意义。
2 结果
2.1 各组一般资料比较
各组年龄、性别、BMI 及腰围比较,差异无统计学意义(P>0.05);病程≤10年组与病程>10年组TC、HDL、FPG、FINS、C 肽及hs-CRP 比较,差异无统计学意义(P>0.05)。病程≤10年组与病程>10年组糖尿病病程、HbA1C、TG 及LDL 比较,差异有统计学意义(P<0.05),病程>10年组均高于病程≤ 10年组。见表1。

表1 各组一般资料比较 (n =60)
2.2 各组心外膜脂肪组织厚度和血管舒张功能比较
对照组心外膜脂肪组织厚度和血管舒张功能分别为(2.77±0.36)mm 和(12.82±3.31)%,病程≤ 10年组分别为(3.56±0.82)mm 和(10.57±2.59)%,病程>10年组分别为(4.61±1.53)mm 和(7.50± 2.84)%。各组心外膜脂肪组织厚度比较,差异有统计学意义(F=12.220,P=0.000),病程≤10年组、病程>10年组均较对照组高;各组血管舒张功能比较,差异有统计学意义(F=12.462,P=0.000),病程≤10年组、病程>10年组均较对照组低。
2.3 血管舒张功能与各指标的相关性分析
血管舒张功能与年龄、糖尿病病程、HbA1C、TC、TG、LDL、心外膜脂肪组织厚度、C 肽及FPG呈负相关(r=-0.333、-0.743、-0.705、-0.443、-0.819、 -0.556、-0.761、-0.400 和-0.510,P=0.025、0.000、0.000、0.011、0.000、0.001、0.000、0.023 和 0.003)。
2.4 多元线性逐步回归分析
将年龄、BMI、腰围、糖尿病病程、HbA1C、TC、TG、LDL、HDL、心外膜脂肪组织、C 肽、FPG、FINS及hs-CRP 作为自变量,血管舒张功能作为因变量纳入模型,进行多元线性逐步回归分析(引入水准为0.05;剔除水准为0.10)。结果显示:TG、心外膜脂肪组织是血管舒张功能的独立影响因素(P<0.05)。见表2。

表2 多元线性逐步回归分析参数
3 讨论
心外膜脂肪组织是位于心肌与脏层心包之间的一种内脏脂肪组织,普遍存在于右心室游离壁、左室心尖部、房室沟、室间沟、冠状动脉和心房周围[5]。在肥胖和代谢性疾病等病理状态下,心外膜脂肪组织增厚且功能失调,炎症介质如白细胞介素-6、肿瘤坏死因子-α、内脂素等分泌增加,这些分子释放入血可引起全身炎症反应或局部作用于胰岛细胞、血管内皮等组织细胞,引起胰岛素抵抗、动脉粥样硬化等[6]。IACOBELLIS 等[7]最先使用超声心动图测量心外膜脂肪组织厚度,并证明其与MRI 所得结果具有相关性。一氧化氮NO 是维持血管完整性和舒张能力所必需的主要成分。血管内皮功能障碍主要指NO 合成释放减少,血管的舒张功能减退。内皮功能障碍是糖尿病血管病变的主要病理生理学基础[8]。肱动脉舒张功能可反映血管的内皮功能,并预测动脉粥样硬化和靶器官受累的程度。
本研究结果显示,与对照组比较,T2DM 患者心外膜脂肪组织厚度增加,且病程>10年组的心外膜脂肪组织厚度大于病程≤10年组。表明T2DM 患者的心外膜脂肪组织厚度增加,并且随着病程的延长而加重。T2DM 患者心外膜脂肪组织增加的可能机制有:①与机体脂质代谢有关的基因在T2DM 中存在缺失、错位和变异;②T2DM 患者中,调节身体脂肪分布的性激素如雄激素水平异常;③体力活动的减少以及摄入食物的增加可能导致T2DM 患者脂肪组织沉积[9]。
本研究同时显示,与对照组比较,T2DM 患者内皮功能减低,且病程>10年组的内皮功能低于病 程≤10年组。表明随着病程的延长,T2DM 患者内皮功能受损且程度加重。糖尿病发生血管内皮功能障碍与高血糖、高血脂、高血压及胰岛素抵抗等密切相关[10]。这些因素相互影响、叠加促进动脉粥样硬化的发生,最终导致糖尿病血管并发症。
本研究结果还显示,随着病程增加,心外膜脂肪组织厚度与血管舒张功能之间呈负相关,心外膜脂肪组织厚度是内皮功能的独立预测因子。心外膜脂肪组织厚度与内皮功能障碍之间的机制目前尚不明确,可能与心外膜脂肪组织分泌的炎症介质有关。心外膜脂肪组织释放的炎症介质通过影响NO 合成酶依赖性通路和降低氧化应激的调节作用从而降低内皮保护作用,损伤内皮功能[11]。此外,心外膜脂肪组织能将游离脂肪酸排入血流,扰乱血管内稳态和内皮功能[12]。本研究与国外学者ÇELIK等[13]的结果基本一致。但是,本研究对T2DM 患者采用病程进行分组,使研究结果更细化。
通过超声心动图评价心外膜脂肪组织耗时少,操作快,无辐射,且可以在常规的心脏超声检查中获得。但本研究也存在一些局限性:样本量相对较小;采用二维超声心动图测量心外膜脂肪组织,不能完全评价心外膜脂肪组织的总量。三维超声心动图更直观、准确地提供心外膜脂肪组织的信息,故有待进一步 研究。
综上所述,随着病程的增加,T2DM 患者的心外膜脂肪组织厚度增加、内皮功能受损加重,心外膜脂肪组织厚度与内皮功能呈负相关。应用超声技术可以无创、简便且准确地评价T2DM 患者心外膜脂肪组织厚度及与内皮功能的关系,为T2DM 患者血管并发症的预测提供新的参数。

