TCT联合免疫组织化学在NSCLC恶性胸腔积液诊断中的价值*
任美英,王翠峰,文荣,景学芬,付玉华
(内蒙古科技大学包头医学院第一附属医院 检验科,内蒙古 包头 014010)
胸腔积液是肺部等多种疾病的常见并发症,临床上40%胸腔积液由恶性肿瘤引起。非小细胞肺癌(non-small cell lung cancer,NSCLC)致恶性胸腔积液的病理诊断及其分型诊断难以明确,而胸腔积液细胞病理学检查是目前具有诊断意义的检查手段之一。
液基薄层细胞学检查(thinprep cytogy test,TCT)是近些年应用于细胞病理学诊断的一项新技术,TCT在宫颈和胸腔积液的细胞病理学检查中有非常大的诊断价值[1-2]。而免疫组织化学法对于肿瘤细胞的分型诊断具有重要意义,但两者联合应用于胸腔积液细胞病理学诊断及分型诊断的研究报道甚少。本研究拟探讨TCT 联合免疫组织化学进行良恶性胸腔积液的鉴别诊断及由NSCLC 致恶性胸腔积液分型诊断的临床应用价值。
1 资料与方法
1.1 一般资料
选取2014年3月—2017年3月于内蒙古科技大学包头医学院第一附属医院检验科细胞室收集的呼吸内科、肿瘤内科、肿瘤外科及胸外科等科室和外院送检的脱落细胞学胸腔积液标本703 例。应用TCT 初检,从诊断结果为可疑肿瘤细胞及肿瘤细胞的标本中选取281 例。患者最后经CT、磁共振及组织病理学确诊为NSCLC 致恶性胸腔积液标本137 例。其中,男性88 例,女性49 例;年龄30 ~85 岁;肺腺癌110 例、肺鳞癌25 例、肺腺鳞癌2 例。
1.2 主要试剂
TCT 试剂(湖北德立森科技有限公司),甲状腺转录因子1(thyroid transcription factor-1,TTF-1)、细胞角蛋白5/6(Cytokeratin 5/6,CK5/6)、细胞角蛋白7(Cytokeratin 7,CK7)及P63 免疫组织化学试剂均购于福州迈新生物技术有限公司。按说明书步骤进行实验操作。
1.3 方法
1.3.1 TCT 取2 管胸腔积液,每管10 ml,3 000 r/min 离心5 min,弃上清液,每管加入约10 ml 细胞清洗液,继续3 000 r/min 离心5 min,再弃上清液,在沉淀物中加入适量TCT 细胞保存液,置漩涡混合器上震荡1 min 混匀,用德立森液基细胞仪制成薄层细胞涂片,95%乙醇固定15 min,巴氏染色。
1.3.2 细胞蜡块的制作 取50 ml 胸腔积液,静止沉淀1 h 后,吸取底部液体至离心管中,加入10%甲醛5 ml,离心弃上清液,重复1 次上述步骤后,用滤纸包裹,脱水、浸蜡及包埋后行4μm 厚连续切片。
1.3.3 免疫组织化学 常规切片后,采用链霉素抗生物素蛋白-过氧化物酶法进行免疫细胞化学染色,以试剂盒中提供的对照作为阴阳性对照,二氨基联苯胺显色。在细胞核、细胞膜或细胞质中出现棕黄色颗粒的细胞为阳性细胞。由具有诊断资质的病理医师随机观察每张切片的5 个视野,每视野计数 100 个细胞。染色强度:0 分为无色,1 分为浅黄色或黄色,2 分为棕黄色。阳性细胞百分比:<10%计0 分,10%~50%计1 分,>50%计2 分,染色强度与阳性细胞百分比的乘积>2 为阳性,≤2 为阴性。
1.4 统计学方法
数据分析采用SPSS 17.0 统计软件。计数资料以率(%)表示,比较用χ2检验;绘制ROC 曲线,计算曲线下面积(area under the curve AUC),AUC>0.5为该指标有诊断价值,P<0.05 为差异有统计学 意义。
2 结果
2.1 TCT 初诊结果
镜下细胞排列呈腺腔样或桑葚样(见图1A、B),核异型性不明显,核染色较深,核仁明显,有时胞浆中出现黏液空泡。TCT 可初步诊断为可疑肿瘤细胞或肿瘤细胞。镜下细胞散在分布(见图1C),细胞体积大小不一,形态多样,细胞核大小不等,明显畸形,核染色深。TCT 初步诊断为可疑肿瘤细胞或肿瘤 细胞。
2.2 免疫组织化学染色结果
将TCT 筛查为可疑肿瘤细胞或肿瘤细胞的胸腔积液,进一步做石蜡包埋切片,并进行免疫细胞化学染色。CK5/6、CK7 阳性颗粒定位于细胞质和细胞膜,TTF-1、P63 蛋白阳性颗粒定位于细胞核。见图2。
2.3 恶性胸腔积液中各免疫组织化学标志物的阳性表达率比较
肺鳞癌和肺腺癌致恶性胸腔积液标本中CK5/6、P63、TTF-1 及CK7 的阳性表达率比较,经χ2检验,差异有统计学意义(P<0.05)。见表1。
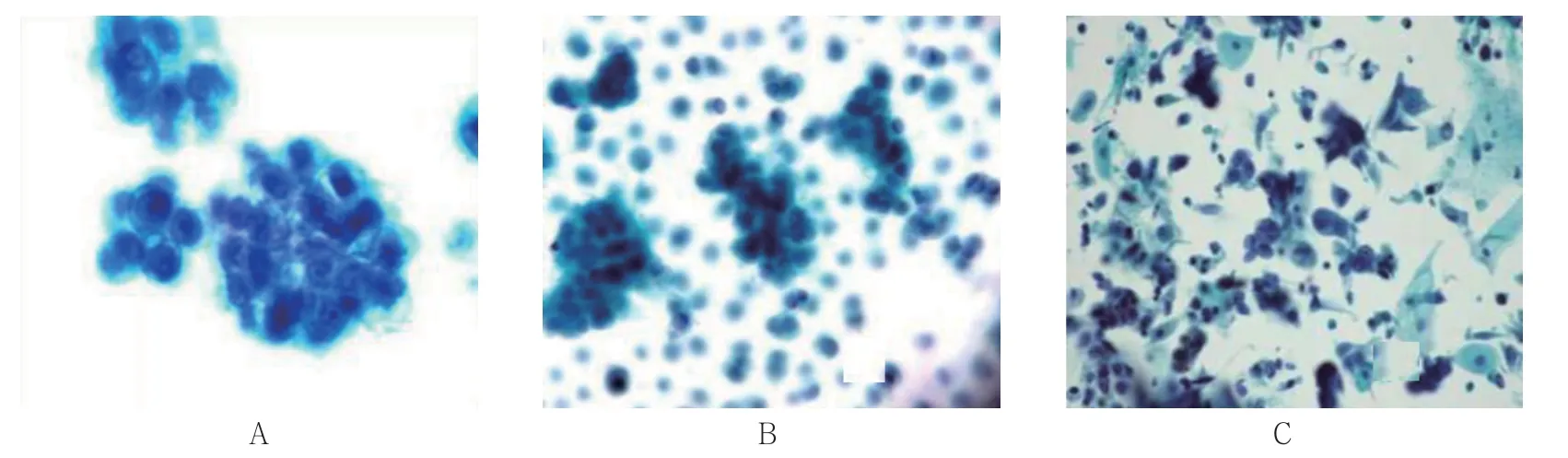
图1 TCT 初诊的肿瘤细胞 (巴氏染色)
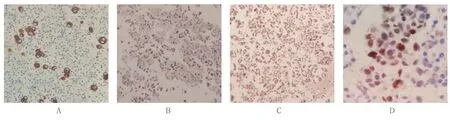
图2 免疫组织化学染色结果
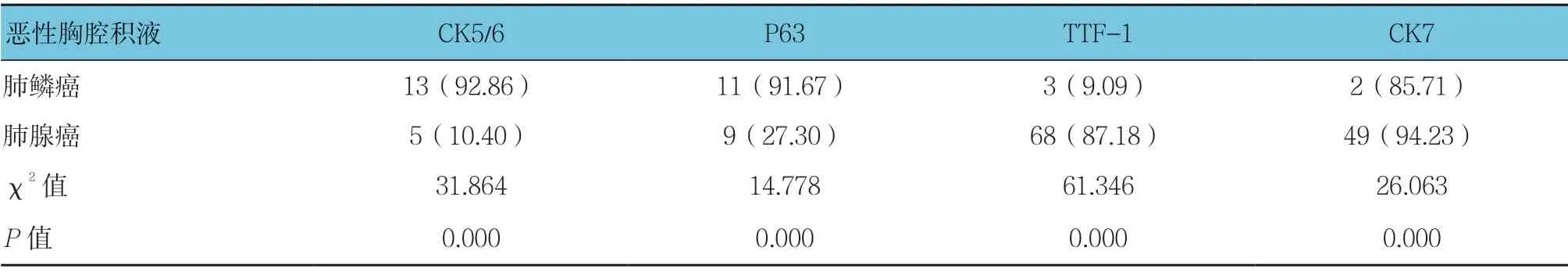
表1 恶性胸腔积液中各免疫组织化学标志物的阳性表达率比较 例(%)
2.4 各免疫组织化学标志物在恶性胸腔积液中的鉴别诊断
在肺鳞癌和腺癌所致恶性胸腔积液的鉴别诊断中,CK5/6 敏感性、特异性较高,分别为92.86%和89.58%;P63 敏感性较高而特异性一般,分别为91.67%和72.73%;TTF-1 敏感性、特异性较高,分别为87.18%和90.63%;CK7 敏感性较高而特异性一般,分别为94.23%和75.00%。见表2。
2.5 各免疫组织化学标志物的ROC 曲线及曲线下面积
CK5/6、P63 诊断肺鳞癌所致恶性胸腔积液的ROC 曲线下面积分别为0.805 和0.755;TTF-1、CK7诊断肺腺癌所致恶性胸腔积液的ROC 曲线下面积分别为0.821 和0.774。见图3。
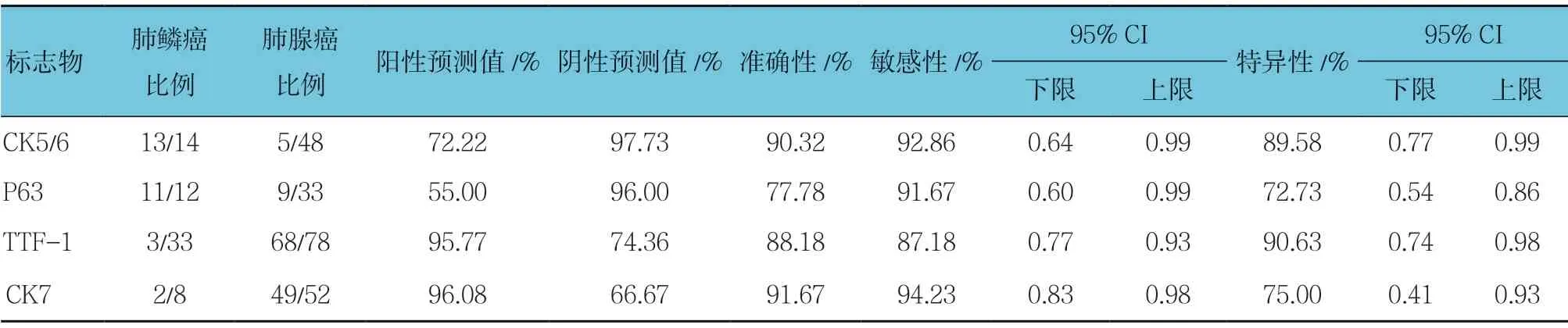
表2 各免疫组织化学标志物在恶性胸腔积液中的鉴别诊断参数
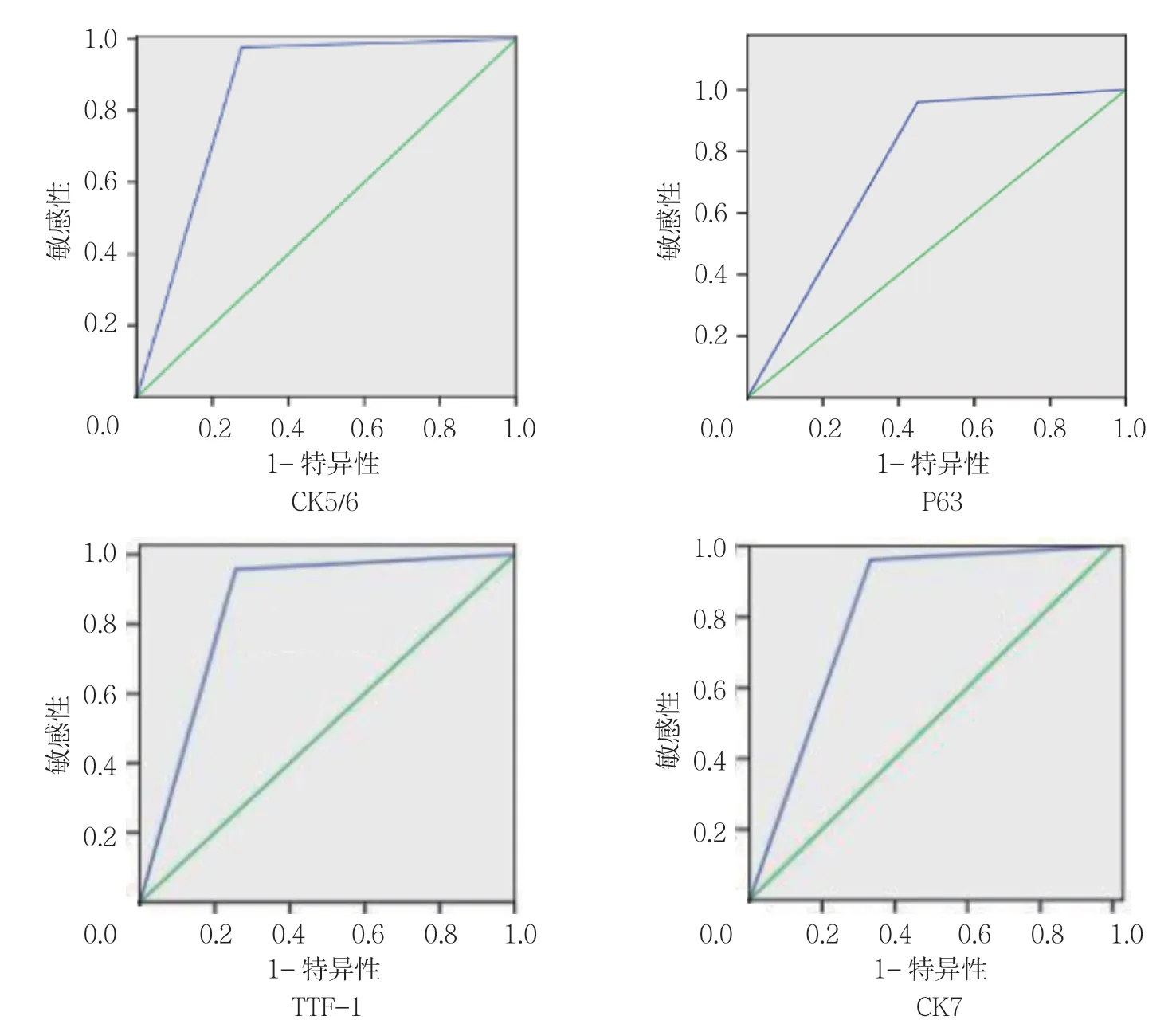
图3 各免疫组织化学标志物诊断恶性胸水的ROC 曲线
3 讨论
随着恶性肿瘤发病率的不断升高,临床上伴有恶性胸腔积液的患者也在逐渐增多。NSCLC 是产生恶性胸腔积液的主要原因,NSCLC 的愈后差,5年生存率只有13%,早期发现并明确诊断十分重要。目前,恶性胸腔积液的诊断与鉴别诊断是临床和细胞学共同面临的难题,虽然组织病理学检查是金标准,但并不是所有患者都能接受这种有创检查,所以手术或穿刺活检并不适合所有伴有胸腔积液的癌症患者。对于恶性胸腔积液,细胞病理学检查显得尤为重要,尤其是年老体弱无法获得活检组织的患者。刘芳等[3]研究显示,浆膜腔积液细胞形态学联合免疫组化染色,补充和发展了细胞病理学对疾病的准确诊断,提高肿瘤细胞的检出率。钱红等[4]指出CTC 联合胸水细胞沉渣石蜡切片及免疫组织化学,既可提高确诊率,也可减少不必要的检查,具有很高的临床应用价值。
TCT 是目前国际领先的脱落细胞检查新技术。胸腔积液利用TCT 制片,把细胞集中到直径为2 cm 范围内,涂片背景干净,红细胞被破坏掉,细胞分布均匀,结构特别清晰。TCT 优化了标本制作,提高了制片质量,改善了观察效果;细胞结构清晰,三维立体感突出,易于识别,明确诊断。根据TCT 检查结果,可初步筛选出恶性和可疑恶性的胸腔积液标本,但对由NSCLC致胸腔积液进行分型诊断,还需进一步做免疫组织化学染色。
CK5/6 主要表达鳞状上皮的基底细胞,P63 表达于复层上皮细胞及多个器官的基底层细胞中,可用于肺鳞癌和肺腺癌的鉴别诊断。本研究显示CK5/6和P63 在肺鳞癌致恶性胸水中呈高表达,而在肺腺癌致胸水中呈低表达,与MUKHOPADHYAY 等[5]的研究结果一致;CK5/6 和P63 诊断肺鳞癌致恶性胸水有较高的敏感性和特异性,与其他学者报道P63 独立诊断肺鳞癌的敏感性为90%~100%,特异性为68%~96%相符[6-8];且CK5/6 和P63 的AUC 为0.805和0.755,进一步证明CK5/6 和P63 可以作为肺鳞癌致恶性胸水的生物标志物。
TTF-1 在原发性肺恶性肿瘤中主要表达于肺腺癌,在其他组织类型的肺癌中表达较少甚至不表达,CK7 多在卵巢、肺及乳腺的上皮细胞质中表达,主要标记于腺上皮和移行上皮,在鳞状上皮不表达。本研究结果显示,TTF-1 和CK7 在肺腺癌所致的恶性胸水中呈高表达,而在肺鳞癌所致的胸腔积液中呈低表达;TTF-1 和CK7 诊断肺腺癌所致的恶性胸腔积液的敏感性、特异性较高,且AUC 较高,进一步说明TTF-1和CK7 诊断肺腺癌致恶性胸腔积液的价值较高,说明TTF-1 和CK7 可以作为肺腺癌致恶性胸腔积液的生物标志物,这与余何等[9]的结果相符。
综上所述,在恶性胸腔积液中,运用TCT 联合免疫组织化学染色检测,对于良恶性胸腔积液的鉴别诊断及NSCLC 致恶性积液的分型诊断,具有较好临床应用价值,这与邹萍等[10]研究显示TCT 联合细胞免疫组织化学能够准确判断肿瘤病理学分型的结论相一致,值得在临床细胞病理学诊断工作中推广应用。

