胆汁及胆囊黏膜中骨桥蛋白、瘦素、内脂素及脂联素的表达及意义
邹旺生,陈健,张宏
(1.铜陵市人民医院 急诊外科,安徽 铜陵 244000;2.贵州医科大学附属医院 肝胆外科,贵州 贵阳 550004)
胆囊结石是胆道系统中一种常见的良性疾病,综合发病率约为10%[1]。其中最常见的类型为胆固醇结石,约占90%[2-3]。胆固醇结石的形成可能与胆汁胆固醇过饱和,胆固醇结晶成核时间,胆囊运动减弱,基因和环境等因素共同作用有关[4]。目前国内外对结石形成与发展所处的内环境(胆汁)及胆囊黏膜的研究相对缺乏。本研究旨在通过检测胆汁及胆囊黏膜中瘦素、内脂素、脂联素及骨桥蛋白(Osteopontin,OPN)等指标或表达差异,为临床胆固醇结石的进一步防治提供潜在可能。
1 资料与方法
1.1 一般资料
选取2017年1月—2018年12月在贵州医科大学附属医院肝胆外科行腹腔镜胆囊切除术的74 例患者作为观察组,术后均证实为胆固醇结石。其中,男性21 例,女性53 例。另选取30 例手术切除胆囊的非胆囊结石患者作为对照组。其中,男性9 例,女性21 例;根据胆囊是否有息肉将对照组分为对照息肉组和对照正常组,分别为22 和8 例。对照组患者术前均无胆囊结石病史,术中确认胆囊无结石、结晶及胆汁淤积、肿瘤侵袭等。
1.2 材料与试剂
1.2.1 标本采集 记录患者年龄、身高、体重,计算BMI。所有患者胆囊切除后迅速从胆囊中抽取胆汁5 ~10 ml,然后剖开胆囊采集结石。在胆囊床对侧的胆囊壁内(远离电刀分离面),用剪刀沿黏膜下行锐性剥离,取胆囊壁全层约4 cm2置于10%甲醛中留作病理染色使用。胆汁置于-80℃保存,胆石经磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗、烘干后室温存储。
1.2.2 试剂 Western blotting 一抗(美国Abcam 公司),酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(美国Rapidbio 公司),氧化酶法试剂盒(南京建成生物工程研究所)
1.2.3 仪器与设备 分光光度计、离心机(德国Eppendorf 公司),37℃水浴锅、95℃金属浴锅(北京田园奥瑞生物科技有限公司),胶片曝光机SRX-101A(日本Konica Minolta 公司)
1.3 方法
1.3.1 胆汁成分测定 胆汁3 000 r/min 离心10 min 取上清,检测瘦素、内脂素、脂联素、胆固醇、磷脂及总胆汁酸等。按ELISA 试剂盒说明书操作,用Excel 软件绘制出的标准品线性回归曲线(曲线经校正为直线),按曲线方程计算各样本浓度值。胆汁中胆固醇按总胆固醇的检测(氧化酶法)试剂盒说明书操作。
1.3.2 胆固醇饱和指数(cholesterol saturation index,CSI)测定 利用胆汁中胆固醇浓度、磷脂和总胆汁酸浓度计算出胆汁总脂浓度和磷脂百分比并通过查Carey 表算出CSI[5]。
1.3.3 苏木精-伊红(hematoxylin-eosin,HE)染色 常规石蜡包埋和切片:从10%甲醛固定标本中剪取部分胆囊全层组织,按冲洗→梯度脱水→透明→浸蜡→包埋→切片→贴片烘片流程操作。切片厚度5μm。HE 染色:切片置于60℃温箱烤片熔蜡30 min,分置二甲苯Ⅰ、Ⅱ脱蜡各5 min,无水、95%、85%及75%酒精梯度脱水,苏木精染色5 min,流水冲洗。0.5%盐酸酒精分化20 s,自来水洗2 min,梯度酒精脱水,0.5%伊红染色3 min,蒸馏水速洗。梯度酒精脱水,二甲苯透明,中性树胶封固。
1.3.4 免疫组织化学染色 为进一步观察差异表达基因OPN 在胆囊黏膜的表达部位,对胆囊组织进行免疫组织化学染色,用PBS 代替一抗作内参对照。石蜡切片二甲苯Ⅰ、Ⅱ及Ⅲ脱蜡各10 min,无水酒精、90%酒精、80%及70%酒精梯度脱水各2 min。PBS漂洗2 min/次,共3 次,浸入枸橼酸盐缓冲液中煮沸(微波抗原修复),高火2 min,再维持10 min,取出自然冷却后PBS 漂洗2 min/次,共3 次。过氧化氢H2O2和甲醇按1 ∶9 比例孵育5 ~10 min(去除内源性过氧化物酶)。切片加2 滴5%胎牛血清白蛋白封闭液封闭。室温放置20 min 后,轻轻甩去封闭液,不洗,加入抗体稀释液1 ∶200 稀释的一抗40μl,置于湿盒中。4℃冰箱孵育过夜。PBS 漂洗5 min/次,共3 次,加二抗40μl,室温孵育1 h。PBS 漂洗5 min/次,共3 次。二氨基苯联胺显色,室温下镜下观察3 ~10 min。阳性产物呈棕黄色,观察到阳性产物后立即终止反应。苏木精衬染细胞核,盐酸酒精水洗蓝化,80%、90%及无水酒精梯度酒精脱水,二甲苯透明5 min,干燥后用中性树脂封片,镜下观察。所有图片采用Image pro plus 6.0 软件行光密度(optical density,OD)值 分析。
1.3.5 Western blotting ①黏膜组织匀浆及样品制备:将组织放入10 ml离心管,加入细胞裂解液1 ml(pH 8.0 的1 mmol/L Tris-HCl 50μl,5 mmol/L NaC1 30μl;NP-40 10μl,0.5 mmol/L EDTA 4μ1,0.5 mmol/L 去氧胆酸钠10μl,100 mmmol/L PMSF 10μl,2 mg/ml Leupeptin 5μl,2 mg/ml Aprotinin 2.5μl,0.5 mmol/L 焦磷酸钠l0μl,10% SDS l0μl,三蒸水定容至1.0 ml),充分匀浆,4℃、12 000 r/min 离心10 min,去上清分装成20μl/管。分光光度计测浓度,加入三蒸水使每管浓度为25μg/ml,再加入等体积的Sample Buffer(10% SDS 2.0 ml,甘油1.0 ml,pH 6.8 的0.5 mol Tris-HC1 1.6 ml,β- 巯 基 乙 醇0.5 ml,Western blotting protein ladders 10μl,三蒸水定容至10 m1)混匀备用。使用前90℃煮沸10 min,短暂离心,按25μg/孔蛋白上样。②电泳:垂直电泳槽中加入分离胶(三蒸水4 ml,30% Acrylamide 3.3 ml,pH 8.8 的1.5 mmol/L Tris-HCl 2.5 ml,10% SDS 1OOμl,10% APS 100 μl,最后加入10% TEMED 10μl 占下3/4),用注射器注入浓缩胶(三蒸水1.4 ml,30% Acrylamide 0.4 ml,pH 6.8 的0.5 mmol/L Tris-HCl 0.63 ml,10% SDS 50μl,10% APS 12μl,10% TEMED 5μ1),插上梳子,室温聚合1 h。待胶完全聚合后取下梳子,每样上2 块平行胶,蛋白上样70μl/孔;上样完毕后电泳槽中加入电泳缓冲液(25 mmol/L Tris 3.03 g,192 mmol/L 甘氨酸14.42 g,pH 8.0 的0.1% SDS l g),电泳先以80 V 电压进行,待Protein Ladders 入分离胶后将电压改为120 V 恒定电压进行,电泳至Protein Ladders到底边处停止电泳,取出凝胶。③转膜:电泳完毕将胶取下做好标记,按塑料孔板(黑)-海绵-滤纸-电泳凝胶-PVDF 膜-滤纸-海绵-塑料孔板(白)的顺序做好三明治,放于电转膜液中(甘氨酸11.26 g,Tris 2.42 g,20%甲醇500 ml,pH 8.0)转膜,400 mA 恒流电转移1.5 h。④抗体孵育:取下电转移的PVDF 膜,1×TBST 洗膜3 次,10 min/次,置于5% BSA 中常温封闭1 h。加入1 ∶1 000 稀释的一抗,4℃恒温孵育过夜,取出PVDF 膜用1×TBST 洗膜3 次,10 min/次,加入1 ∶5 000 稀释的相应二抗,37℃恒温孵育1 h,1×TBST 洗膜3 次,10 min/次。 ⑤显影:取WestPico Chemiluminescent Substrate ECL试剂A、B 液各1 ml 混匀,每张PVDF 膜用1 ml A、B 混合液浸润约5 min 后放入暗盒固定,在暗室以胶片覆盖后关上暗盒20 s ~5 min,取出胶片后放入显影洗片机中显影,取出胶片观察结果。Western blotting 图片采用Image J 软件进行条带灰度值数据 处理。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件,计量资料以均数±标准差(±s)表示,比较用t检验或单因素方差分析,方差不齐时改用H检验,进一步两两比较用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
两组患者男女性构成比、年龄、BMI 比较,差异无统计学意义(P>0.05)。见表1。
2.2 两组患者胆汁成分比较
两组患者胆固醇、磷脂、总胆汁酸、胆固醇百分比、总脂及CSI 比较,差异有统计学意义(P<0.05),观察组胆固醇、胆固醇百分比、总脂及CSI 高于对照组,观察组磷脂、总胆汁酸低于对照组。见 表2。

表1 两组患者一般资料比较
表2 两组患者胆汁成分比较 (±s)

表2 两组患者胆汁成分比较 (±s)
组别 n 胆固醇/ (mmol/L) 磷脂/(mmol/L) 总胆汁酸/(mmol/L) 百分比/% 磷脂百分比/% 总胆汁酸 百分比/% 总脂/(g/dl) CSI 胆固醇 观察组 74 18.87±1.64 37.42±5.45 119.07±11.20 10.16±0.60 21.17±0.76 68.8±1.25 16.93±1.49 1.72±0.37对照组 30 10.55±1.03 59.77±6.03 176.53±14.23 4.05±0.22 24.21±1.07 71.80±1.14 11.76±1.16 0.95±0.15 t 值 10.273 24.511 56.581 5.311 7.870 30.435 8.122 2.290 P 值 0.005 0.041 0.033 0.028 0.093 0.115 0.012 0.006
2.3 两组患者胆汁中瘦素、内脂素及脂联素 比较
两组患者胆汁中瘦素、内脂素及脂联素比较,差异有统计学意义(P<0.05),观察组胆汁中瘦素、内脂素高于对照组,观察组胆汁中脂联素低于对照组。见表3。
表3 两组患者胆汁中瘦素、内脂素及脂联素比较 (±s)
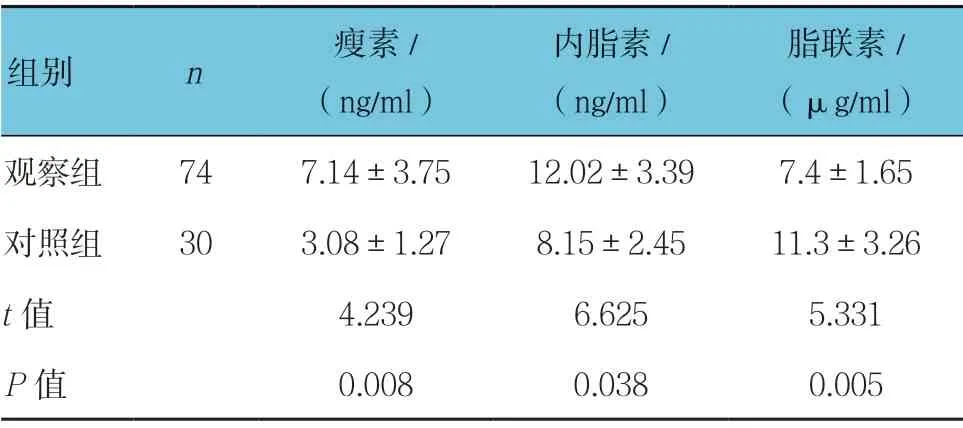
表3 两组患者胆汁中瘦素、内脂素及脂联素比较 (±s)
脂联素/ (μg/ml)观察组 74 7.14±3.75 12.02±3.39 7.4±1.65对照组 30 3.08±1.27 8.15±2.45 11.3±3.26 t 值 4.239 6.625 5.331 P 值 0.008 0.038 0.005组别 n 瘦素/ (ng/ml)内脂素/ (ng/ml)
2.4 各组胆囊黏膜HE 染色结果
观察组胆固醇结石患者近3 个月无急性发作史,胆囊黏膜呈慢性胆囊炎表现,没有黏膜萎缩,囊壁增厚不明显。镜下见黏膜有增生,单核细胞浸润。部分黏膜下可见泡沫细胞,表明有胆固醇沉积。少数黏膜内可见淋巴结以及杯状细胞,提示肠化。对照息肉组患者与对照正常组患者镜下见胆囊黏膜炎症细胞浸润较轻。见图1。
2.5 各组胆囊黏膜中OPN 的表达
免疫组织化学结果显示,观察组患者胆囊黏膜OPN 主要表达在胆囊黏膜上皮细胞的顶端膜上,部分胞浆内也可看到表达的颗粒。对照息肉组患者胆囊黏膜中较少表达,对照正常组患者胆囊黏膜中无表达。见图2。
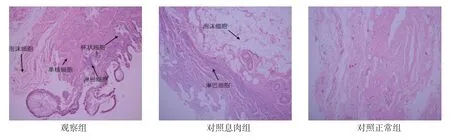
图1 各组胆囊黏膜 (HE 染色×200)
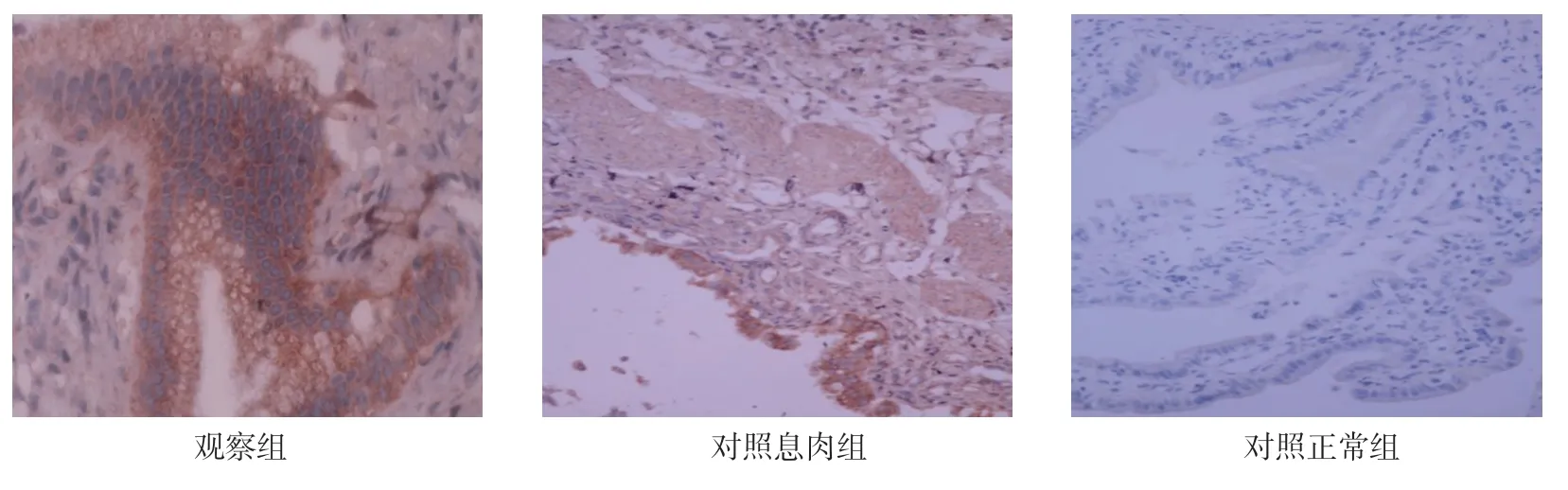
图2 各组胆囊黏膜中OPN 的表达 (×200)
2.6 各组OPN 的OD 值比较
观察组OPN 的OD 值为(0.27±0.04),对照息肉组为(0.11±0.06),对照正常组为(0.03±0.01),经单因素方差分析,差异有统计学意义(F=3.876,P=0.020),但方差齐性levene 检验结果P=0.012,提示方差不齐,故改用非参数检验H 检验,差异有统计学意义(Z=12.283,P=0.029);进一步两两比较,观察组与对照息肉组比较,差异有统计学意义(χ2=0.246,P=0.012);观察组与对照正常组比较,差异有统计学意义(χ2=0.092,P=0.003);对照息肉组与对照正常组比较,差异有统计学意义(χ2=0.179,P=0.035)。见图3。
2.7 各组OPN 蛋白相对表达量比较
Western blotting 结果显示,观察组OPN 蛋白相对表达量为(0.88±0.13),对照息肉组为(0.33±0.07),对照正常组为(0.08±0.05)经单因素方差分析,差异有统计学意义(F=5.374,P=0.039),但方差齐性levene 检验结果P=0.025,提示方差不齐,故改用非参数检验H检验,差异有统计学意义(Z=29.845,P=0.017);进一步两两比较,观察组与对照息肉组比较,差异有统计学意义(χ2=0.133,P=0.027);观察组与对照正常组比较,差异有统计学意义(χ2=0.034,P=0.008);对照息肉组与对照正常组比较,差异有统计学意义(χ2=0.291,P=0.015)。见图4、5。

图4 各组OPN 蛋白的表达
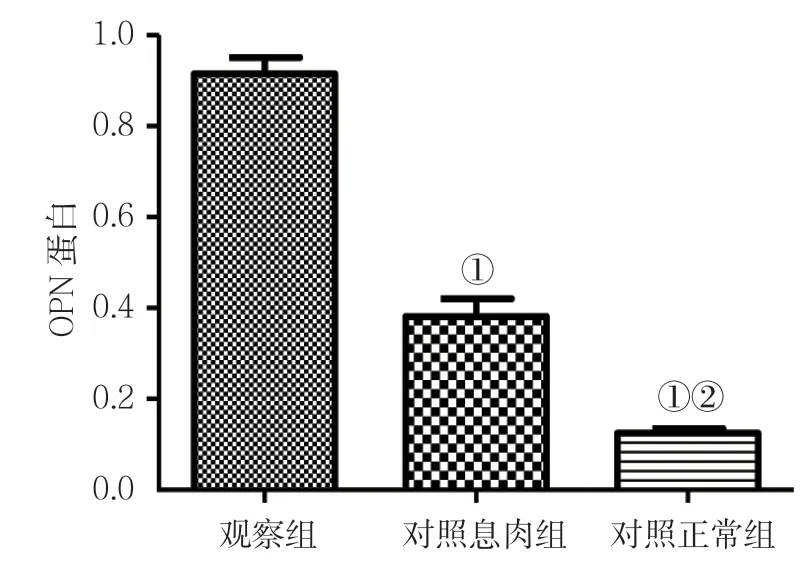
图5 各组OPN 蛋白相对表达量比较 (±s)
3 讨论
瘦素由人体脂肪细胞分泌,它可以通过调节脂质代谢,影响胆囊收缩功能,并通过调节胆汁蛋白成分等机制促进胆固醇结石的形成[6]。脂联素由人体脂肪组织合成,具有Adipo1(R1)、Adipo2(R2)两种受体,R1 多在骨骼肌表达,而R2 主要在肝脏表达。胰岛素可抑制胆盐合成限速酶7α 羟化酶,使胆汁酸减少分泌,同时也使胆汁中钙离子升高,黏多糖增多,打破了胆汁抗成核及促成核因子的动态平衡[7-8]。目前有研究认为胆固醇结石患者体内脂联素的水平较低,这在一定程度上降低了胰岛素的敏感性并使胰岛素抵抗增加,胰岛素的水平相对增高。胰岛素与脂联素的关系密切,两者协同作用,共同参与了胆固醇结石的形成[9]。内脂素可通过下调THP-1 源性巨噬细胞的人源脂类外向转运蛋白ABCA1 的表达,减少细胞内游离胆固醇外流,同时使乙酰辅酶A 乙酰转移酶1 表达增高,增加了细胞内胆固醇的合成,促进了泡沫细胞的形成[10-11]。脂肪细胞中的胆固醇负荷增加,可使脂肪细胞分泌内脂素增加,其机制可能与脂肪细胞的内质网应激增强有关[12]。这也为内脂素导致胆固醇性结石形成的机制研究提供了新的理论依据。而笔者实验中观察组相对于对照组,胆汁中的瘦素、内脂素水平升高,脂联素降低,基本与以上理论相吻合。
水溶性极差的胆固醇在胆汁中主要以胆固醇、胆盐及磷脂混合的微胶粒相形式存在[13]。有研究通过检测胆囊结石患者的胆汁发现,胆盐和磷脂可以影响胆固醇在胆汁中的溶解度,它们之间存在热力学平衡。结石患者的胆汁中胆固醇出现热力学失衡,更易过饱和析出产生结晶,最终导致胆囊结石的形成[14]。笔者的实验结果中,观察组相对于对照组,胆汁中的胆固醇浓度,CSI 升高,总胆汁酸和磷脂的浓度降低,由此推测胆汁中胆盐减少,形成的微胶粒绝对不足,影响了胆固醇的溶解度,同时由于胆固醇浓度增高,形成的微胶粒相对不足,影响了其在胆汁中的溶解度,两种原因共同导致胆固醇呈过饱和状态并析出结晶形成结石。
OPN 可以通过调节胆汁代谢,改变胆汁的稳态,导致胆固醇结石的发生。其机制是肝脏内的OPN降低了肝脏中胆汁酸合成代谢的限速酶CYP7A1的表达,并增加了与胆固醇形成相关的基因SHP、ATP8B1、SR-B1及SREBP-2的表达,导致胆汁酸合成减少,胆固醇合成增加,加速了胆汁的成核作用。有研究报道,OPN 的缺乏可抑制肠道胆固醇转运关键蛋白NPC1L1,而NPC1L1与胆固醇在肠道的吸收密切相关,NPC1L1 在肠道的表达减少可以导致胆固醇在肠道的吸收下降,间接使胆汁中胆固醇的含量降低,从而减少胆固醇结石的形成[15]。本实验中,观察组胆囊黏膜中OPN 的表达高于对照组,可能与以上机制 有关。

