黄瓜灰霉病的生防木霉菌株筛选
(长江大学生命科学学院,湖北 荆州 434025;中国农科院农业资源与农业区划研究所,北京 100081)
郭玉杰,吕恒,牛永春,邓晖
(中国农科院农业资源与农业区划研究所,北京 100081)
师迎春
(北京市植物保护站,北京 100029)
余知和
(长江大学生命科学学院,湖北 荆州 434025)
黄瓜(Cucumissativus)是我国的主要蔬菜作物之一,栽培面积已达125.3万公顷,占全国蔬菜面积的10%左右,产量一直居世界首位[1]。灰霉病是一种由灰葡萄孢菌(Botrytiscinerea)侵染所引起的常见植物真菌病害。灰葡萄孢菌寄主范围广,可侵染包括黄瓜在内的200余种蔬菜、花卉和果树等植物[2]。研究表明,灰霉病原菌分生孢子在适宜的湿度、温度条件下容易快速萌发,在宿主植株残叶、残枝或其他抵抗力衰弱的表皮、器官等部位直接穿透植株表皮侵入宿主植株,可导致寄主植株枯萎、幼苗烂根、插枝腐烂和茎秆坏疽等症状发生[3, 4]。灰葡萄孢菌通过气流、水分以及人为农事操作等方式传播蔓延,植物生长发育期内发病的农作物花瓣、叶片和果实上产生的病原菌分生孢子落在健康植物的叶片、茎蔓和果实上也可引起重复感染发病[5]。灰霉病发生严重降低农作物的产量和品质,造成农作物减产达30%以上,在农作物果实期,灰霉病发生导致的危害更大,严重影响农作物产量及农业的总体产值[6]。
目前,黄瓜生产上缺少有效的抗病品种,黄瓜灰霉病防治主要依赖化学手段。随着用药次数增多、药剂用量增大,病原菌的抗药群体逐渐增加,灰霉病防治效果逐年下降。大量使用化学农药也造成果实农药残留和环境污染等严重问题。因此,寻找新的防治途径以克服农药残留和病原菌的抗药性问题,已成为黄瓜种植生产上的当务之急[7]。近年来,关于植物病害生物防治国内外已有许多报道,但对于叶部和果实病害生物防治的报道仅限于少数几种病害,主要是由于叶部和果实生物防治菌防效更易受环境因素影响。该研究旨在筛选对黄瓜灰霉病有高效拮抗作用的真菌菌株,从而为黄瓜灰霉病的生物防治奠定基础。
1 材料与方法
1.1 供试菌株
黄瓜灰霉病菌(灰葡萄孢)菌株ACCC36042由中国农业微生物菌种保藏管理中心提供,用于平板对峙试验;灰葡萄孢菌株ACCC 36042-2-3由黄瓜灰霉病菌ACCC36042接种黄瓜发病后再分离获得,用于非挥发性物质抑病试验和黄瓜叶片、果实的抑病功能试验。247个木霉(Trichodermaspp.)菌株由中国农科院农业资源与农业区划研究所牛永春研究员课题组前期从北京郊区食用菌菌棒分离并保藏。
1.2 供试黄瓜
叶片接种试验用津研2号黄瓜品种;果实接种试验所用黄瓜从北京市当地市场购买。
1.3 木霉菌株与黄瓜灰霉病菌对峙试验
分别于25℃活化培养供试黄瓜灰霉病菌菌株ACCC36042与分离保藏的247个木霉菌株3~7d,用打孔器取菌落边缘直径5mm菌饼。在直径9cm的PDA平板距两侧边缘15mm的位置对称接种供试病原真菌和木霉菌饼,对照设置单点接种(CK1)和两点接种病原真菌(CK2)2种对照,每个处理重复3次。培养皿置于25℃黑暗培养3d后调查病原菌落半径,计算拮抗指数(Antagonism Index, AI)[8]。
每组平板对峙试验时,当CK2两点接种病原真菌的菌落接近接触时进行调查,且处理组病原真菌指向木霉真菌的菌落半径数值小于CK2平板上相应位置上病原真菌的菌落半径数值时,视为此菌株有初步的抑菌效果。连续30d观察木霉与病原真菌的相互作用,将拮抗现象划分为4种互作类型:覆盖(A),木霉菌落覆盖病原真菌菌落;被覆盖(B),病原真菌菌落覆盖木霉菌落;僵持(C),木霉和病原真菌的菌落接触时生长均受阻;抑菌带(D),在相互作用区域形成透明的条带[9, 10]。
1.4 木霉菌株与黄瓜灰霉病菌的非挥发性物质抑菌试验
将玻璃纸剪成9cm直径培养皿底能够平铺的大小,放入密闭容器中加入无菌水121℃灭菌30min,隔1d灭菌1次,共灭菌3次。取活化的木霉菌落边缘直径5mm菌饼接种于已灭菌玻璃纸覆盖的9cm直径的PDA平板中央,对照在平板中央接种直径5mm的圆形PDA培养基,待菌落接近长满平板时同时移除对照和处理平板上的玻璃纸和接种物;然后在处理和对照平板中央接种已活化培养2d的直径5mm的黄瓜灰霉病菌ACCC 36042-2-3的菌饼,培养3d后调查黄瓜灰霉病菌的菌落生长情况。每个处理重复3个平板,采用十字交叉法测量并记录对照和处理灰葡萄孢的菌落直径,计算抑菌率[11]。
1.5 木霉菌株孢子悬液制备
制备方法参照文献[12]。将木霉菌株培养5~10个平板,取5~10mL无菌水加入每个平板中,用刮铲轻轻刮取平板上的木霉孢子经过2层纱布过滤至150mL已灭菌三角瓶中得到原液,用原液配制108孢子/mL的孢子悬浮液100mL,其中加入吐温80使其终浓度为0.1%。
1.6 离体黄瓜叶片和果实的抑病试验
供试津研2号黄瓜种子用4%次氯酸钠溶液消毒3min后用无菌水清洗3次,放入垫有2层滤纸的玻璃培养皿,置25℃培养箱中催芽。待胚根长至0.5cm左右时,将种子播于500mL纸杯内,基质为育苗基质+自然土(体积比2∶1)。每钵定苗1株,20~25℃温室内育苗。待幼苗长至真叶期时用剪刀剪取带叶柄的叶片,放入无菌的内有湿润滤纸的玻璃培养皿内,接种病原真菌后24h在叶片上喷洒木霉孢子液,黄瓜灰霉病原菌接种采用不刺伤贴菌柄方法[13]。
将市场购买的黄瓜果实用无菌脱脂棉擦拭表面后晾干,在自然朝上的位置用黑色记号笔画6mm左右圆圈。用喷雾器均匀喷洒含0.1%吐温80的108孢子/mL的木霉孢子悬浮液于黄瓜果实上[14],然后将脱脂棉放入含有0.1%吐温80的108孢子/mL的木霉孢子液中浸湿,放在黄瓜果实上标记黑色圆圈处,用保鲜膜包住,24h后揭掉保鲜膜,自然风干后,在标记黑色圆圈处接种黄瓜灰霉病原菌饼,每株木霉在每根黄瓜上3个不同位置放置病原菌饼,黄瓜灰霉病菌接种采用不刺伤贴菌柄的方法[13]。
1.7 基因组DNA提取
将待鉴定菌株接种到直径6cm的PDA平板25℃培养3d,待菌落长满整个培养皿,用无菌钥勺刮取菌丝转移至2mL离心管,然后用磁珠纯化系统提取菌株基因组DNA。具体的研磨、水浴、离心、抽提等步骤参考文献[15]。
1.8 PCR扩增与序列分析
研究发现,rDNA ITS序列片段分辨率较低[16],蛋白编码基因TEF1-α和RPB2等能充分揭示木霉属内种间关系[17, 18]。
以提取的基因组DNA为模板,分别选取引物对ITS4(5’-TCCTCCGCTTATTGATATGC-3’)与ITS5(5’-GGAAGTAAAAGTCGTAACAAGG-3’)[19],TEF1-728F(5’-CATCGAGAAGTTCGAGAAGG-3’)与TEF1LLErev(5’-AACTTGCAGGCAATGTGG-3’)[20],fRPB2-5f[5’-GA(T/C)GA(T/C)(A/C)G(A/T)GATCA(T/C)TT(T/C)GG-3’]和fRPB2-7cR[5’-CCCAT(A/G)GCTTG(T/C)TT(A/G)CCCAT-3’]扩增ITS、TEF1-α和RPB2基因片段[21]。PCR反应体系和反应程序如表1和表2所示。

表1 PCR反应体系组成(50μL)
PCR扩增产物经1%琼脂糖凝胶电泳(100V,20min)、染色检测,送交三博测序公司进行序列测定。本研究先进行rDNA ITS序列比对和分析,将木霉菌株鉴定到相近的组(clade)[22];对于有功能的木霉菌株采用PAUP v4.0b10软件构建TEF1-α和RPB2基因序列系统发育树[23]。
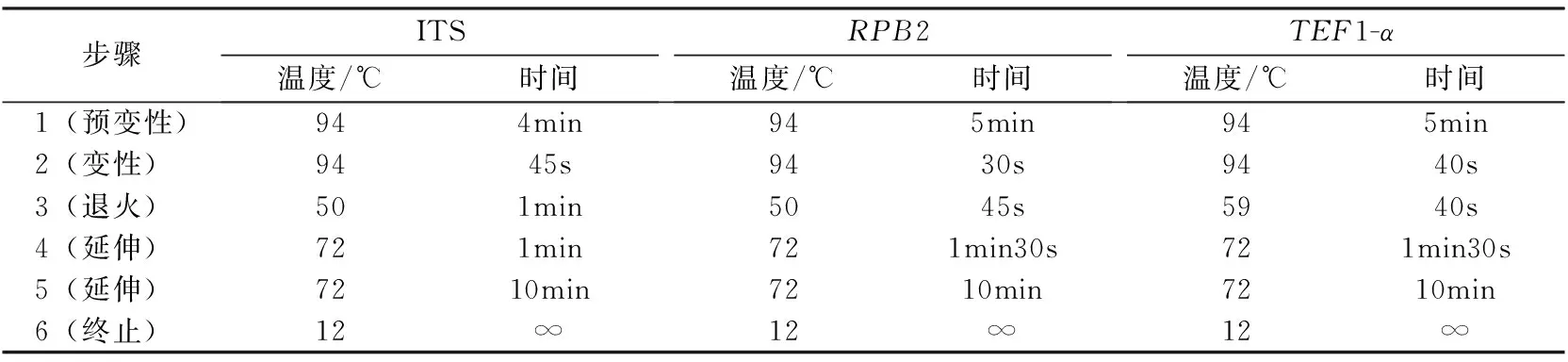
表2 PCR反应程序
注:步骤2~4循环次数ITS为35次,RPB2为36次,TEF1-α为40次;“∞”表示任意时间。
2 结果与分析
2.1 拮抗菌株的筛选
供试的247株木霉与灰葡萄孢菌株经两点对峙培养,结果表明,拮抗指数≥30%的木霉菌株有217株,拮抗指数小于30%的木霉菌株有30株,其中69株木霉的拮抗指数大于80%。拮抗木霉与病原真菌的相互作用类型主要是覆盖病原菌,少部分拮抗菌株与灰霉菌对峙培养中产生明显的抑菌带(见图1)。
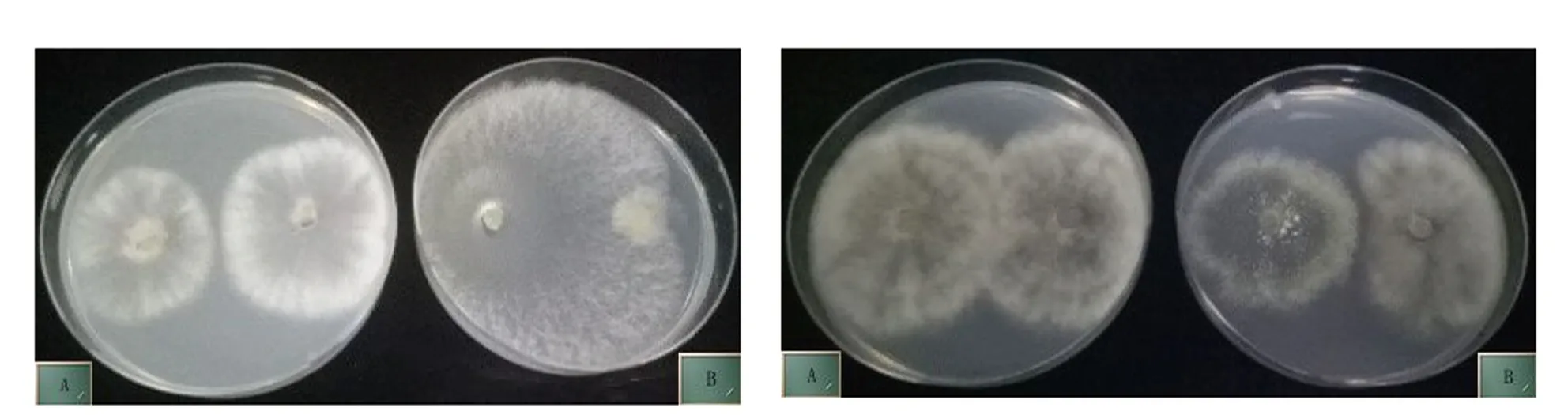
左图:A培养皿接种灰葡萄孢菌;B培养皿左侧接种灰葡萄孢菌,右侧接种M13033-1,示木霉菌株覆盖病原菌;右图:A培养皿接种灰葡萄孢菌;B培养皿左侧接种灰葡萄孢菌,右侧接种M13033-1,示木霉菌株与病原菌对峙培养中产生明显的抑菌带。图1 木霉菌株M13033-1与灰葡萄孢菌对峙培养情形
2.2 拮抗菌株的非挥发性物质的筛选
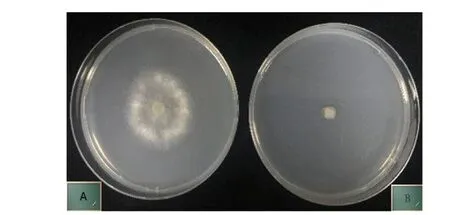
注:A为对照,接种灰霉病菌;B为接种木霉菌株M12004 3d后揭开玻璃纸再接种灰霉病菌。 图2 木霉菌株M12004非挥发性物质的抑菌效果

注:A为对照,接种灰霉病菌;B为先喷洒M13033-1 木霉孢子悬浮液再接种灰霉病菌。 图3 木霉菌株M13033-1对黄瓜离体叶片的抑病效果
从对峙培养抑菌率80%以上的69株木霉菌株中选择29株经过玻璃纸非挥发性物质验证试验筛选,其抑菌率小于30%的有2株,抑菌率大于30%小于50%的木霉菌株有5株,大于50%小于80%的木霉菌株有10株,大于80%的木霉菌株有12株。在大于80%的木霉菌株中,部分木霉菌株抑菌率可达100%。进一步研究发现,两点对峙培养抑菌效果好的木霉菌株,在非挥发性物质抑菌试验中的抑菌效果表现一致。其中,接种木霉菌株M12004在3d后揭开玻璃纸再接种灰霉菌饼,平板上灰霉菌几乎不长,说明木霉产生的非挥发性物质抑制了灰霉病菌的生长(见图2);接种木霉菌株M13033-1在3d后揭开玻璃纸再接种灰霉菌饼,因木霉菌落生长快,从边缘向中心完全覆盖了灰霉病菌的菌落,平板上的灰霉菌落直径比对照接种PDA培养基后再接种灰霉病菌的菌落明显小,菌株M13033-1产生的非挥发性物质也抑制了灰霉病菌的生长。
2.3 黄瓜离体叶片的抑病效果
在对峙培养和非挥发性物质抑菌试验基础上,选择9株木霉菌株与灰霉病原继续进行离体黄瓜叶片测试,结果表明,菌株M13033-1的黄瓜离体叶片抑菌效果明显(见图3),抑菌率达60%以上。

注:上黄瓜为对照,接种灰霉病菌后第5天;下黄瓜为先喷M13033-1 木霉孢子液再接种灰霉病菌后第5天。 图4 菌株M13033-1处理黄瓜果实5d后发病情况
2.4 黄瓜离体果实的抑病效果
将黄瓜离体叶片验证的抑菌效果好且稳定的木霉菌株M13033-1进一步进行离体果实试验,结果显示菌株M13033-1的抑菌效果明显(见图4),抑菌率达80%以上。
2.5 拮抗菌株的分子鉴定
木霉菌株M13033-1的rDNA ITS 序列在GenBank中比对结果属于木霉属哈茨组(harzianum clade)。菌株M13033-1和木霉属哈茨组相近种的模式菌株共8株,以TrichodermaaggressivumCBS100525为外群,使用PAUP v4.0b10软件分别基于RPB2和TEF1-α基因序列构建了系统发育树。基于RPB2基因序列构建的系统发育树得到的3棵MP树拓扑结构相似(参数如下:tree length=132、consistency index=0.818、homoplasy index=0.182、retention index=0.747、rescaled consistency index=0.611),图5为其中一棵系统树。图6为基于TEF1-α基因序列构建的系统发育树得到的一棵MP树(参数如下:tree length=164、consistency index=0.829、homoplasy index=0.171、retention index=0.731、rescaled consistency index=0.606)。
系统发育树中菌株M13033-1与Trichodermaafroharzianum以100%的支持率聚类在一起,结果表明M13033-1为Trichodermaafroharzianum(非洲哈慈木霉)(图5、图6)。
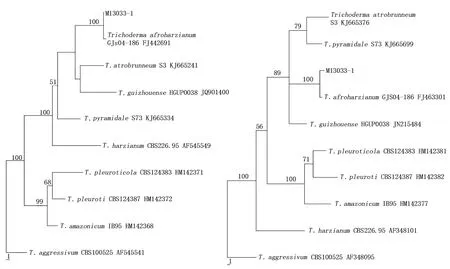
图5 基于RPB2基因构建的木霉属部分种的系统发育树 图6 基于TEF1-α基因构建的木霉属部分种的系统发育树
3 讨论与结论
目前用于灰霉病的生防微生物至少有20余种,其中,以木霉为主要研究对象,对10余种水果、蔬菜上发生的灰霉病害有防治作用,且防治效果不尽相同[24, 25]。这些研究结果表明,生防真菌能够有效侵染灰霉病病原菌的菌丝,使得灰葡萄孢菌生长受阻,灰霉病病情得到抑制。同时,生防真菌可能通过改变蛋白质、可溶性糖类和维生素等物质来增强植物抗病性。另外,有报道寡雄腐霉(Pythiumoligandrum)、缠器腐霉(Pythiumperiplcum)及螺卷毛壳(Chaetomiumcochliodes)等能够寄生于病原菌,引起寄主细胞大范围裂解,从而对灰霉病有防治作用[26, 27]。
经过长期研究论证,利用木霉实现对病害的控制,其机理可分为抗生作用、溶菌作用、重寄生作用、诱导抗性作用和竞争作用[26, 28, 29]。木霉菌株在防治植物真菌性病害的方面具有显著的应用潜力,不仅能够有效控制植物诸多真菌病害的蔓延,而且实现了对生态系统稳定性方面的保持,同时也能够有效提高农作物的品质,对农业的可持续发展战略具有重要意义[9]。
木霉菌在防治枯萎病方面具有显著效果,利用生防木霉菌防治植物真菌性病害正在受到行业专家的广泛关注。高苇[30]在食用菌栽培的土壤中发现了1株绿色木霉菌株TH4能够增强黄瓜对植株由尖孢镰刀菌的侵染导致的枯萎病病原菌的抑制作用,从而使得枯萎病的发生减少,并且该绿色木霉菌株在黄瓜生产中具有一定的系统抗性。纪明山等[31]研究发现了1株绿色木霉菌株TR-8对尖孢镰刀菌具有重寄生作用,且发现其代谢物对尖孢镰刀菌孢子的防治效果可达到75.06%。木霉菌株对病原真菌的作用机制多种多样。因此,筛选出优质的能够有效提高对病原真菌防治效果的木霉菌株,对于枯萎病的生物防治将会有非常重要的研究意义。
该研究筛选的木霉菌株M13033-1生长速度快,对灰霉菌菌丝有较强的重寄生能力,能在短时间内迅速覆盖灰霉菌的菌落,在离体黄瓜叶片和果实上喷施,对黄瓜灰霉病抑病率可达60%~80%,可作为防治黄瓜灰霉病的候选生物防治菌株,但其应用效果还有待于通过盆栽及田间试验来进一步验证,并通过改进发酵条件及增加生物防治因子等措施来提高防治效果。

