射频消融甲状腺较大良性结节的并发症分析
王兵 隋洋 孙医学
甲状腺结节是临床常见的甲状腺疾病,尤其是对于甲状腺较大结节,患者会有颈部压迫感、吞咽困难等临床症状。外科手术切除虽是治疗甲状腺结节的主要方法,但因手术有创、颈部留下疤痕、影响美观等问题,无疑给患者特别是年轻女性患者带来一定心理影响。射频消融术(radiofrequency ablation,RFA)是一种微创治疗技术,它具有安全、有效等优点,近年来对甲状腺肿瘤的应用越来越多,并且取得了较好的疗效[1-5]。但鉴于甲状腺体积较小,周围组织结构复杂,毗邻喉返神经、颈总动脉、气管、食管等重要组织结构,甲状腺结节的大小和部位决定了射频消融术的操作难度,从而影响预后[6-7]。本研究对36 例甲状腺较大良性结节患者进行超声引导下射频消融(RFA)治疗,通过分析并总结其并发症的发生原因、及演变情况,旨在探讨减少或避免并发症的有效措施。
1 资料与方法
1.1 一般资料
2015 年10 月—2017 年2 月间对36 例甲状腺较大结节患者进行射频消融治疗,其中男11 例,女25 例,年龄19~63 岁,平均(42.5±10.2)岁。单发30 例,2 个病灶6 例,共42 枚结节。术前详细向患者讲解治疗方法、治疗过程及可能出现的并发症,并签署知情同意书。本研究经本院伦理委员会审核通过。
纳入标准:(1)术前穿刺活检均为良性病变;(2)术前患者有颈部压迫感;(3)结节径线2.5~6.0 cm,平均(3.58±1.40);(4)术前甲状腺功能正常;(5)术前凝血功能正常。
排除标准:(1)术前穿刺活检为恶性病变;(2)结节最大径线<2.5 cm;(3)严重凝血机制障碍及心肺疾病。
1.2 仪器与方法
使用仪器:本组在RFA 治疗过程中采用Philips IU22 彩色超声诊断仪,并配用L9-3 型高频线阵探头,频率4~9 MHz。RFA术中及术后超声造影,采用意大利SonoVue(Bracco,Italy)造影剂,使用前向瓶内注入5 mL 生理盐水,充分振荡混匀后,经患者左前臂浅静脉团注1.5 mL 造影剂,再尾随5 mL 生理盐水冲管。本研究采用奥林巴斯公司生产的 Celon AG 型射频仪器进行RFA 治疗,功率设为5 W,配用18G×10 cm 单针双极式射频针,消融范围长度为10 mm,直径5 mm,呈椭圆形。
射频消融方法:消融治疗操作由2 名医师共同完成。消融首先行彩超检查观察结节的大小和部位,依据多切面扫查情况制定个体消融方案。患者仰卧平躺,头后仰,颈部抬高充分暴露出来。常规消毒铺巾,使用2%利多卡因局麻后,小尖刀破皮,按照超声定位的最佳穿刺点,在超声引导下将射频电极插入至目标病灶内。根据结节位置不同,选择在甲状腺纵切面从上极向下极或从下极向上极穿刺进针,或在甲状腺横切面从内侧(颈中线)向外侧或从外侧向内侧进针。对较大结节,RFA 过程中采用连续移动法[8](即按照由远而近、由深至浅、先下极后上极的顺序,连续移动射频针对结节进行多点、多针边缘重叠消融)。为避免甲状腺周边重要组织机构如喉返神经、颈动脉、食管、气管等受热损伤,笔者采用“液体隔离带法”,即对距离颈部重要组织结构小于5 mm 的甲状腺结节消融前,先注射生理盐水,令甲状腺被膜与周边重要组织结构隔离开,形成液体隔离带(如图1),然后再对病灶进行RFA 治疗。当RFA 产生的气化区完全覆盖并超过病灶边缘5 mm 时,消融结束。治疗结束后关闭电源,局部按压止血,送病房留观,静卧2 h。
1.3 观察指标
记录所有患者RFA 治疗前及治疗后出现的各种症状,主要包括颈部疼痛、放射性疼痛、声音减低、声音嘶哑等,同时记录并发症的发生、发展及好转时间。
1.4 统计学方法
采用SPSS 17.0 软件进行统计学分析,本组计数资料采用卡方检验或Fisher 精确概率法;计量资料以均数标准差()表示,采用t检验,P<0.05 为差异具有统计学意义。
2 结果
本组36 例患者均完成了超声引导下射频消融治疗,共42 枚甲状腺较大结节均消融完全。RFA 术中及术后并发症的发生率,见表1。结果显示,术后出现颈部疼痛的发生率最高,与其他并发症比较,差异有统计学意义(χ2=3.915,P<0.05)。
颈部疼痛:本组所有患者均有不同程度的颈部疼痛感,绝大多数可忍受疼痛直到RFA 治疗结束;7 例(7/36,19.4%)不可忍受疼痛者,笔者采取在甲状腺腹侧被膜与颈前肌群之间注射适量2%利多卡因,疼痛即刻缓解。
出血2 例,发生率为5.6%。术后超声检查显示针道附近有少量出血。出血可能由射频消融后针道损伤皮下毛细血管网引起,笔者采取即刻中止治疗,并及时按压后出血停止,一般可自愈。
放射性牙痛3 例,发生率为8.3%;放射性耳根痛1 例,发生率为2.8%;放射性肩背痛1 例,发生率为2.8%。这类疼痛均无需特殊处理,持续3~5 d 疼痛可自行缓解。
术后即刻出现声音减低2 例,发生率为5.6%,通常可保守治疗。本组术后出现声音减低患者均未经特殊处理,观察2 h 后声音自行恢复正常。
喉返神经损伤1 例,发生率为2.8%,此患者术后即出现发音困难、声音嘶哑等症状,电子喉镜诊断为左侧喉返神经受损,经鼠神经生长因子等药物治疗1 个月后,患者声音好转
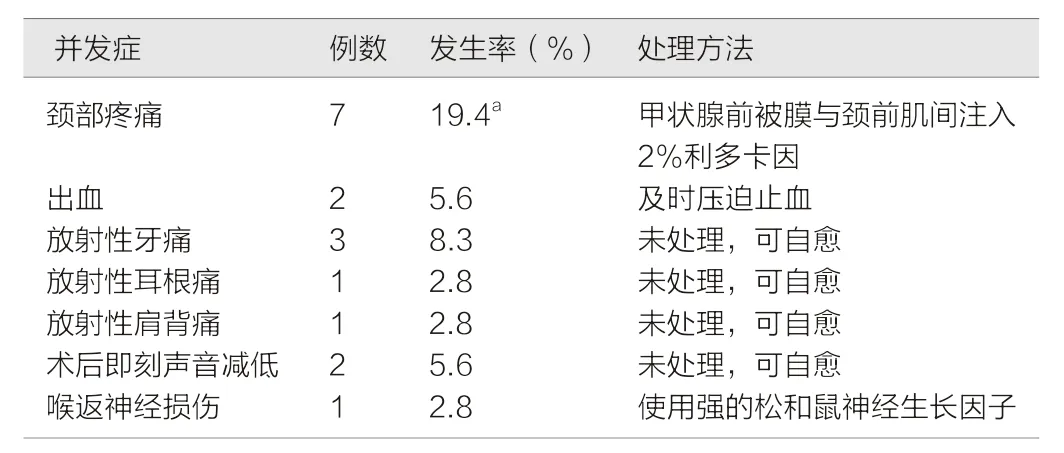
表1 36 例甲状腺良性较大结节患者RFA 术中及术后并发症发生率比较
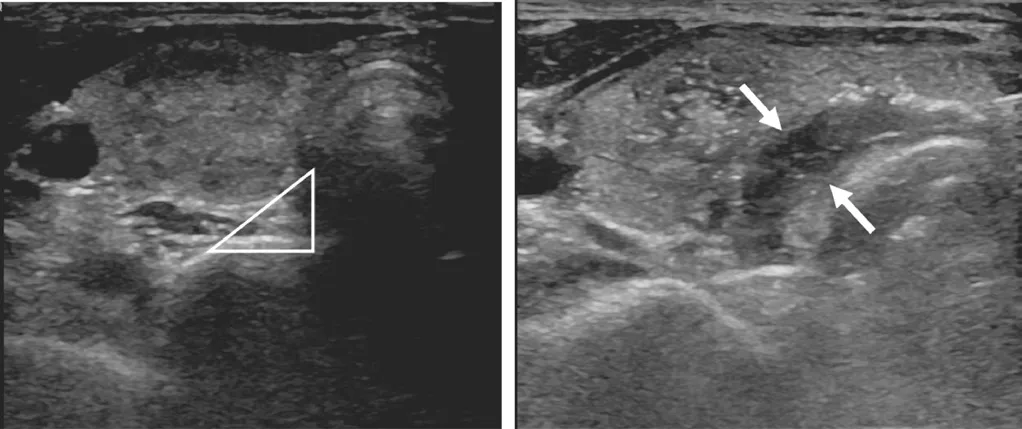
图1 液体隔离带
3 讨论
随着各种环境因素、饮食因素的变化,甲状腺结节目前在临床十分常见。治疗甲状腺结节的方法也逐渐从有创向微创方式转化,这无疑给广大患者尤其是年轻女性患者带来了福音。手术切除曾是治疗甲状腺结节的主要方法,但由于甲状腺恶性肿瘤的发病率不到1%,所以手术切除的绝大多数是良性肿瘤。随着医学技术的快速发展,寻找安全、有效、微创的甲状腺肿瘤治疗方法一直是临床医生追寻的目标。超声引导射频消融术(RFA)作为一种原位灭活肿瘤的热消融技术成为当代倍受关注的微创治疗方法[9-11]。目前RFA 在甲状腺肿瘤方面的应用越来越受关注,但是随着RFA 治疗甲状腺病例的增多,以及甲状腺及其周边组织结构的复杂性,其并发症也随之出现。喉返神经损伤是RFA 治疗甲状腺良性结节及复发性甲状腺癌严重并发症之一,有文献报道其发生率在1.02%~2.4%之间[12-13],其主要原因是热损伤所致。而且,研究者用RFA 治疗邻近甲状腺背侧被膜的较大结节时,为了消融完全,需采用多层面重叠消融方法,但因多切面消融时产生的气化区范围较大而造成结节显示不良,尤其是紧贴甲状腺背侧被膜的部分结节轮廓和边界显示不清,进一步增加了操作者的治疗难度和操作风险。因此如何安全、有效的用RFA 治疗甲状腺较大结节且避免喉返神经损伤是消融时必须解决的关键技术问题。
射频消融甲状腺结节过程中,采取“液体隔离带法”,即在喉返神经所在的危险三角区与甲状腺背侧被膜之间注入生理盐水,不仅能保护喉返神经,还可使超声对紧贴甲状腺背侧被膜的甲状腺结节的显示得以改善;同时还需注意超声检查的手法技巧[14]。本研究结果显示,喉返神经损伤是RFA 治疗甲状腺结节时最严重的并发症。本组术后出现声音减低、发音困难1 例,后经电子喉镜诊断为左侧喉返神经损伤,原因可能与操作方法及临床经验有关:在消融紧贴左侧喉返神经的甲状腺较大结节时,为避免损伤周围结构,在RFA 前先注入生理盐水,但因病灶较大,消融时间较长,以及消融过程中受较大结节的挤压,使组织间隙的生理盐水流失就快,没有形成大于5 mm 宽度的隔离带,从而使热能透过甲状腺被膜损伤邻近的喉返神经。为预防此类并发症的发生,术者在RFA 较大结节,采取先消融病灶的相对安全部分,对于位置比较危险的部分,先在危险三角区与周围重要组织之间注射生理盐水,形成5~10 mm 宽度的“液体隔离带”后再对病灶进行RFA 治疗,可有效预防喉返神经损伤。
疼痛是最常见的并发症,疼痛的原因可能是射频消融时间过长,电极针产生的高温损伤颈部表浅部位的神经引起。本组RFA治疗中绝大多数患者可忍受疼痛,无需处理,直至消融结束;但少数患者无法忍受疼痛,需及时中止治疗或采用“液体隔离带法”。本组7 例(7/36,19.4%)患者颈部疼痛难忍,研究者采取在甲状腺腹侧被膜与颈前肌群之间注射适量2%利多卡因溶液后,疼痛即刻缓解。放射性牙痛、放射性耳根痛及放射性肩背痛,均无需特殊处理,持续3~5 d 疼痛自行缓解。因此,RFA 治疗近甲状腺被膜的结节时,患者颈部疼痛感较强;治疗甲状腺上极的结节时,患者除有颈部疼痛感,还伴有放射性耳根痛、放射性牙齿痛等。为有效预防及缓解疼痛,建议在RFA 位于甲状腺上极或紧贴甲状腺被膜的结节时,应先在甲状腺被膜与颈前肌群之间注入适量2%利多卡因溶液,形成隔离带,然后再进行RFA 治疗,可有效缓解疼痛,提高治疗效果。
出血常发生在术中及术后短时间内,主要是因电极针刺破皮下毛细血管网引起。少量出血可通过及时按压止血。本组2 例发生甲状腺周围出血,可能是因为甲状腺体积小,射频电极进针时损伤颈部皮下毛细血管网引起皮下血管破裂出血。因此,操作者应该注意进针路径,采取先用射频电极阻断皮下血管,再将电极针插入至目标结节内,可减少或避免出血的发生。
综上所述,鉴于甲状腺位置表浅、体积小、周围结构复杂,超声引导下射频消融甲状腺较大结节具有一定难度,临床医生应全面了解可能发生的并发症,长期积累经验,把握“液体隔离带”的注入时机及注入量,可有效预防及避免并发症的发生,以获得较好的治疗效果。

