基于生物信息学和质谱技术的阿胶特异性肽段筛选与鉴定△
王芳,范雨,叶茂,曹秀君,童芯锌,彭成,国锦琳
成都中医药大学 中药资源系统研究与开发利用重点实验室 中药材标准化重点实验室,四川 成都 611137
阿胶(Asini Corii Colla)为马科动物驴EquusasinusL.的干燥皮或鲜皮经煎煮和浓缩制成的固体胶,具有优良的滋补作用。《中华人民共和国药典》(以下简称《中国药典》)明确规定生产阿胶的原料是驴皮[1]。由于阿胶在市场上经常供不应求,以其他动物皮加工成伪阿胶的现象层出不穷,主要以廉价的猪皮、牛皮作为皮源,甚至用重金属超标的废旧皮革制成的明胶掺假,服用后有明显不良反应,因此亟需建立阿胶质量控制方法。
不同皮源胶原蛋白同源性高,氨基酸组成及含量极为相近,具有相似的化学性质,常用方法如:氨基酸组分含量分析、十二烷基硫酸钠-聚丙烯凝胶电泳(SDS-PAGE)法及色谱法等均缺乏专属性、针对性,难以对不同皮源胶原蛋白进行有效鉴别[2]。阿胶在加工过程中脱氧核糖核酸(DNA)降解破坏严重,因此DNA分子鉴定方法难以有效鉴别阿胶[3]。近年来,双向凝胶电泳技术(2-DE)与液相色谱-质谱联用技术(LC-MS)识别特征多肽逐渐成为胶类中药材鉴定的主流方法[2]。Aina等[4]采用2-DE技术初步检测出10个猪皮胶特异蛋白斑点,2-DE技术对蛋白制备要求高,条件考察繁琐。而LC-MS技术由于其快速、精准及全面分离分析的特点,已广泛用于蛋白组学研究,成为对多肽组分、结构及残基修饰进行分析的主流技术[5]。2009年,Zhang等[6]利用胰酶酶解猪和牛明胶,通过LC-MS检测出可区分猪和牛明胶的特征肽并给出氨基酸序列,建立了LC-MS技术识别特征肽鉴别猪牛明胶的新方法。2012年,Cheng等[7]通过超高压液相色谱-串联四级杆飞行时间质谱技术(UPLC-QTOF)首次系统性检测5种皮胶原(驴皮胶、猪皮胶、牛皮胶、龟壳胶及鹿角胶)特征肽对5类皮胶原进行专属性鉴别,但比对特征肽序列发现牛皮胶特征肽序列与驴皮胶并无差异,可能是样品前处理导致结果不太理想。《中国药典》中采用LC-MS法,以质荷比(m/z)539.8离子对阿胶进行鉴定,但未给特征肽序列[1],特异性不能最终确定,但仍能表明LC-MS技术已用于建立胶类药材质量控制规范。2015年,Chen等[8]采用超高效液相色谱串联三重四极杆质谱法建立了特异快速检测中成药鹿角胶中掺伪驴皮和牛皮成分专属性特征离子峰方法,但未确定特征肽序列。综上所述,当前鉴定方法存在一些共有的局限:1)皮胶原成分复杂,除了主要成分胶原蛋白外,还含有血清蛋白、毛发等杂质,这些杂质会干扰以胶原蛋白为对象的鉴定方法,另外,胶原蛋白分子量大、结构稳定及难溶等特点也会影响实验稳定性、准确性,但此环节常被忽略;2)基于酶解后基质的复杂性,直接从总离子流图(TIC)中寻找特征性肽段,针对性不强,效率不高;3)找出了特征离子,还需进一步的鉴定特征肽序列以验证实验结果准确性,繁琐耗时。
因此,本研究首次通过生物信息技术模拟酶解过程以全面准确地预测驴皮、猪皮及牛皮的特征肽并获得相应的序列及分子量信息,对样品前处理和酶解条件进行全面考察优化,获得稳定、大量、连续的小分子肽段,采用UPLC/Q-TOF-MS进行高效分离分析,验证理论筛选出的特征肽段,从而建立稳定、灵敏、可量化及专属性高的阿胶鉴定和质量控制方法。
1 实验部分
1.1 材料与仪器
1.1.1 材料 随机收集不同企业不同批号的阿胶以及不同市场销售的驴皮、牛皮和猪皮样品,样品信息见表1,均经过成都中医药大学国锦琳教授鉴定,留样保存于成都中医药大学中药材标准化教育部重点实验室。

表1 样品信息
1.1.2 试剂 牛血清蛋白(BSA)、丙烯酰胺、甘氨酸、Tris碱、N,N′-甲叉丙烯酰胺、二硫苏糖醇(DTT)、碘乙酰胺、N,N,N′,N′-四甲基乙二胺(TEMED)、十二烷基硫酸钠(SDS)均购自Bio-Rad公司;考马斯亮蓝R-250与G-250、过硫酸铵(APS)、β-巯基乙醇和溴酚蓝指示剂均购自鹏程生物科技有限公司;极低分子量标准蛋白质Marker、低分子量标准蛋白质Marker购自北京Solarbio;胰蛋白酶Trypsin 1:250(CAS:9002-07-7,Amersco)。
乙腈、甲醇为色谱纯,均购自Thermofisher公司;碳酸氢铵、磷酸二氢钠、磷酸氢二钠、磷酸、三氯甲烷、环己烷、二氯甲烷、乙醇、丙酮、冰乙酸、甲酸、丙三醇和三氯乙酸均为分析纯,购自成都科龙化工试剂厂。
1.1.3 仪器 肽柱-C18色谱柱(2.1 mm×100 mm,2.7 μm,Agilent);L-8900型全自动氨基酸分析仪(日立高新技术公司);UMAX PowerLook 2100XL凝胶扫描成像系统(Bio-Rad);MINI-PROTEAN 165-8000小型垂直电泳仪(Bio-Rad);DHG-9035A型电热恒温鼓风干燥箱(上海岛韩实业公司);BP211D 型十万分之一分析天平(德国Sartorius);UV-1800 PC型紫外分光光度计(上海美谱达仪器有限公司);Agilent 1200SL-6210A高效液相串联飞行时间质谱仪(Agilent);DP-D501普通型冷冻干燥机(无锡德普仪器制造有限公司)。KQ5200E型超声波清洗器(昆山市超声仪器有限公司);FE-20K型pH计(上海美谱达仪器有限公司);电子恒温水浴锅(北京中兴伟业仪器有限公司);Allegra TM X-22R型低温高速离心机(美国Beckman Coulter)。
1.2 生物信息技术模拟酶解
通过查询National Center for Biotechnology Information蛋白质数据库(NCBI),采用生物信息学软件ExPaSy PeptideCutter模拟酶解寻找酶切位点,比对驴皮、牛皮和猪皮的I型胶原蛋白α1链氨基酸序列,找出其差异。再利用软件ExPASy PeptideMass模拟胰酶酶解结果,筛查驴皮特异性肽段[9]。
1.3 样品处理
所有皮部样品均按照《中国药典》方法进行处理,具体做法是:先取一定量的样品,浸泡于水中并除毛切块,再次洗净后水煮过滤,将过滤液浓缩至浓稠糊状,最后冷却使其凝固,切成片并干燥,制成坚固的胶状,打粉过六号药典筛后4 ℃保存。
本研究摸索超声法、加热法及碾磨法对样品进行溶解处理。称取1 g样品粉末,加入40 mL 1% NH4HCO3溶液置于50 mL锥形瓶中,密封后用超声处理20 min;密封后放入水浴锅中以60 ℃加热30 min溶解后取出样品溶液;称取1 g阿胶样品粉末于研钵中碾磨,加入40 mL1% NH4HCO3溶液研磨至溶解;将3种方法处理后的溶解样品分别按8000 r·min-1离心20 min,Bradford法[10]测定蛋白含量。采用环己烷-三氯甲烷和环己烷-二氯甲烷萃取系统对样品进行处理[11-12]。再通过三氯乙酸-丙酮法、过滤法和超滤法进行纯化[13]。在参考方法上稍有改动:过滤法,将溶解后的样品用0.45 μm微孔滤膜过滤除菌,置4 ℃保存待用;超滤法,将萃取后的样品置于10 kDa的超滤管中3000 r·min-1离心30 min后将小分子杂质除去。通过SDS-PAGE电泳法对样品处理效果进行评定,分离胶质量分数为6%,浓缩胶质量分数为4%,上样量为20 μL,其余蛋白样品-20 ℃保存备用。
1.4 生物酶解
将上述蛋白样品进行胰酶酶解(1% NH4HCO3配制成1 mg·mL-1胰酶溶液,酶活250 U·mg-1)。为保证样品中胶原蛋白被完全酶解为小肽,本研究从酶解的时间、温度、酶量、pH值4个方面进行考察条件[9],设置如表2所示。
将酶解液放入超滤管中3000 r·min-1离心50 min,收集滤液,三羟甲基甲基甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Tricine-SDS-PAGE)进行分析[9]。
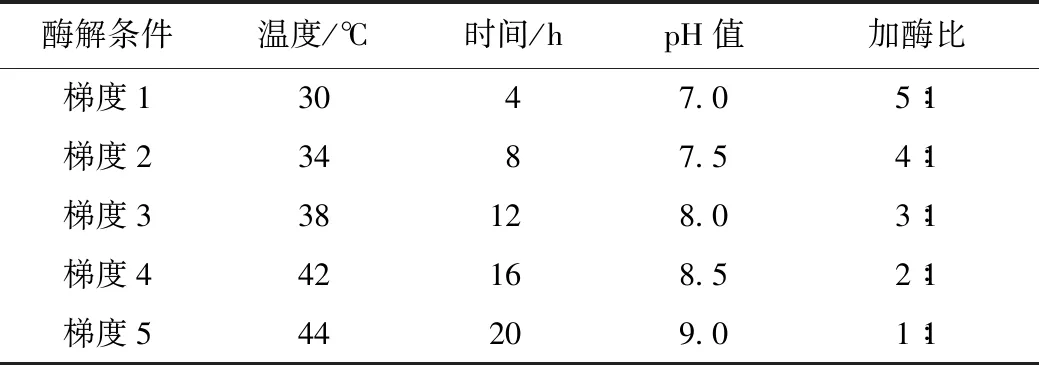
表2 酶解条件
1.5 UPLC/Q-TOF-MS分析
色谱柱为Agilent肽柱-C18色谱柱(2.1 mm×100 mm,2.7 μm);选用0.1%甲酸水溶液作为流动相A,选用乙腈作为流动相B。梯度0~5 min,5%B;5~8 min,5%~10%B;8~32 min,10%~20%B;32~38 min,20%~95%B;38~38.1 min,95%~5%B;流速0.30 mL·min-1;柱温30 ℃;进样量1.0 μL。
氮气流量为10 L·min-1,毛细管电压为4.0 kV,喷雾压力为40 Psi,碎裂电压设为150 V,雾化气温度350 ℃,在正离子模式下检测。
2 结果与讨论
2.1 I型胶原蛋白模拟酶切的生物信息分析
I型胶原蛋白α1链氨基酸序列在NCBI、Swiss-prot上查得,其序列号为:猪皮Ovisaries(XP_013836466)、驴皮Equusasinus(GI:221665286)、牛皮Bostaurus(GI:77404252)。通过DNAMAN 6.0软件进行同源比对,上述序列相似性95.56%。可以看出,不同种类的动物皮,尽管I型胶原蛋白α1链序列非常相似,但是所查到的3种皮类的氨基酸序列存在差异,这为后续试验提供了理论基础。除此之外,序列的比对结果表明,4种胶原蛋白特异氨基酸(羟脯氨酸、脯氨酸、甘氨酸和丙氨酸)的组成与含量没有显著差别,这提示了传统区分阿胶的真伪的方法是具有不足之处的。
据Peptide Cutter生物信息学软件模拟酶解过程,显示出胶原蛋白能被胰酶酶解为相对较多的小分子片段,因此选择胰酶酶切。然后经过软件系统ExPASy PeptideMass模拟酶切得到的肽段序列,与后续特异性肽片段互相印证。表3显示的是通过3种皮类I型胶原蛋白α1链模拟酶切结果,酶解肽段分子量在0.6~2.5 kDa范围内,对比筛选出13个牛皮、12个驴皮及12个猪皮源特异肽段,酶解肽段具有较高的连续性和匹配度,为质谱识别特征多肽提供基础,也为后期实验奠定理论依据。

表3 生物信息分析筛选的牛皮、驴皮、猪皮I型胶原蛋白α1链特征肽段信息
2.2 驴皮及其他皮类总离子流图的建立
2.2.1 样品前处理条件优化 阿胶含杂质多,主要成分为胶原蛋白,其结构稳定,难溶。本实验比较了超声法、加热法及研磨法溶解样品,结果表明:加热法比超声法温和,提取的蛋白量大,蛋白损伤量小。二氯甲烷-环己烷萃取系统和超滤法纯化后的样品经SDS-PAGE电泳(见图1)。可以看出,蛋白分子量在180~300 kDa,符合胶原蛋白分子量分布范围。基于以上数据,本研究采用加热法溶解、二氯甲烷-环己烷萃取和超滤法对样品进行前处理。

注:A.萃取系统考察;B.纯化条件考察;1.三氯甲烷-环己烷萃取系统;M.蛋白Marker;2.二氯甲烷-环己烷萃取系统;3.过滤法;4.超滤法;5.三氯乙酸-丙酮法。图1 不同前处理条件阿胶的SDS-PAGE电泳图谱
2.2.2 酶解条件优化 通过Tricine-SDS-PAGE检测酶解结果,优化后的酶解条件为:酶解温度38 ℃,消化时间12 h以上,pH 8.0,加酶比为4∶1~1∶1,底物质量浓度为0.017~0.025 g·mL-1。以上条件下,胶原蛋白被较为充分酶解,酶解肽段多集中在1.2~3.3 kDa,与生物信息预测结果基本相符,图2为底物浓度考察结果。
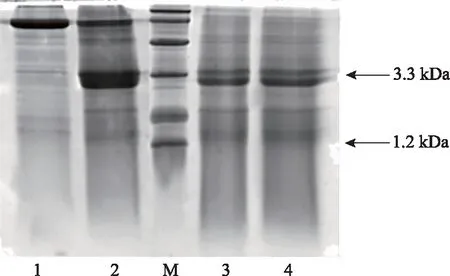
注:1.加酶比为1∶1;2.加酶比为2∶1;M.蛋白Marker;3.加酶比为3∶1;4.加酶比为4∶1。图2 底物浓度考察Tricine-SDS-PAGE电泳图谱
2.2.3 3种皮类UPLC-TOF/MS分析结果 由图3可见,3种皮类的多肽总离子流图较为相似,主要是由于特征性肽段的数量在胶原蛋白序列中所占比例小。根据《中国药典》方法提供的阿胶特征性多肽离子m/z 539.8,对3种皮类的图谱进行提取离子分析。

注:Sample 1.牛皮样品多肽总离子流图;Sample 2.猪皮样品多肽总离子流图;Sample 3.驴皮样品多肽总离子流图。图3 3种皮类所得多肽的液质联用总离子流图
经验证,m/z539.8对样品进行提取离子分析,能找出3种皮类的差异,酶解驴皮在16.87 min提取离子扫描中有明显响应值。而其他皮类是空白,由此可根据m/z539.8来鉴定阿胶真伪,经换算,药典用于鉴定阿胶的特征肽段不包含在生物信息技术预测的驴皮特征肽段内,推测可能由于样品前处理及酶解条件差异产生不完全酶解或与肽段上某些氨基酸残基后期修饰有关。
将理论计算出的特异性肽段分子量换算为m/z,实验验证结果显示,m/z766.4能找出3种皮类的差异,酶解驴皮在27.76 min提取离子扫描中有明显响应值,表明m/z为766.4,分子量为1 530.802 2可作为鉴别阿胶的特异峰,对应的多肽为GEAGPAGPAGPIGPVGAR。
2.3 实际样品的鉴定结果
对于10组收集到的样品用上述的特异性阿胶鉴别方法能进行有效的鉴别。数据结果表明(图4),10组阿胶样品中,仅3、4、10号阿胶样品检测出特征峰,以驴皮胶为对照,测定特征峰相对丰度,结果显示这3种阿胶样品相对丰度分别为67%、38%、72%,因此,这3种阿胶产品基本符合标准,通过特征峰丰度分析可进一步量化阿胶产品中驴皮胶含量。第7、9号样品也出现特征峰,但相对丰度比例甚小,其余5种阿胶样品完全检测不出特征峰,可由此结果推测阿胶质量问题之严重。

注:A.3号阿胶样品的提取离子流图;B.4号阿胶样品的提取离子流图;C.10号阿胶样品的提取离子流图。图4 酶解阿胶样品m/z 766.4时提取离子流图
3 结论与展望
驴、牛及猪的胶原蛋白氨基酸序列在NCBI上查得后经ExPASy PeptideMass进行酶切模拟,得到12段驴皮存在的特异性肽段,可能为特异性鉴别肽段。经实验验证,m/z766.4,分子量为1 530.802 2,对应的多肽为GEAGPAGPAGPIGPVGAR能有效鉴别驴皮与其他皮类。在10组阿胶样品中,据此肽段进行鉴定的结果表明该方法与《中国药典》方法的鉴定能力一致。本实验首次运用生物信息技术模拟、对比和筛选3种皮类胰酶酶解的差异性肽段,并提供肽段的氨基酸序列、位置及分子量。与已报道的特征肽段检测方法相比,本研究采用生物信息技术结合HPLC-MS方法,通过理论实验相互印证使结果更加全面、稳定、高效。另外,本研究首次对样品前处理方法进行系统考察,为后续实验稳定、高效奠定基础。本研究基于生物信息技术结合UPLC/Q-TOF-MS技术,检测到1条与预测结果匹配的驴皮胶特异肽,下一步将建立阿胶特异肽数据库,促进胶类药材质量控制方法的系统化和标准化。

