基于肽键热振荡理论对僵蚕炮制前后体外抗帕金森活性的研究△
李晶峰,王亚萍,边学峰,张辉,孙佳明
长春中医药大学,吉林 长春 130117
僵蚕为蚕蛾科昆虫家蚕BombyxmoriLinnaeus 4~5龄的幼虫感染(或人工接种)白僵菌Beauveriabassiana(Bals.)Vuillant而致死的干燥体[1]。僵蚕具有息风止痉、祛风止痛、化痰散结的功效[2],临床上常用于肝阳上亢、高热、痰浊、血虚、阴虚等所致的以肢体痉挛、抽搐、颤动等为特点的证候,该证候与帕金森的临床表现静止性震颤、运动迟缓、肌强直和姿势步态障碍相似。并且,僵蚕的辛散之力较强,有腥臭气味[3-4],患者直接服用生品会产生恶心、呕吐等反应,故僵蚕服用前需要对其炮制来降低其腥臭味和刺激性。肽键热振荡理论认为,动物类药材中活性肽在加热炮制过程中,肽键的热振荡作用,导致肽键断裂产生更多小分子肽段,其结构发生不同程度的改变,生理活性发生相应的变化。本文基于僵蚕的传统功效,重点针对体外抗帕金森病作用,依据肽键热振荡理论对僵蚕炮制前后的体外抗帕金森活性进行系统研究。
1 材料
1.1 试药
6-羟基多巴胺(6-OHDA)、维生素C、乙酰胆碱酯酶(AchE)、石杉碱甲、5,5′-二硫代双(2-硝基苯甲酸,DTNB)、碘化硫代乙酰胆碱(ATCI)(Sigma公司);磷酸缓冲盐(PBS)、胎牛血清、DMEM培养液、0.25%胰酶(美国Gibco公司);牛血清蛋白(北京鼎国昌盛生物技术有限公司);二甲基亚砜(DMSO)、氢氧化钠(NaOH)、三氯乙酸、酒石酸钾钠(C4O6H4KNa)、硫酸铜(CuSO4·5H2O)、磷酸氢二钠(Na2HPO4·12H2O)、磷酸二氢钠(NaH2PO4·12H2O)(北京化工有限公司);麦麸(市售);水为实验室自制纯化水。
僵蚕购买自吉林省百草大药房,经长春中医药大学张辉教授鉴定为僵蚕。人神经母细胞瘤细胞(SH-SY5Y)购买自中科院上海细胞库。
1.2 仪器
恒温加热烫板(常普天仪器制造有限公司);红外温度检测仪(华盛昌仪器实业有限公司);KQ3200B型超声波清洗器(昆山市超声仪器有限公司);SPECORD©200 PLUS紫外可见分光光度计(德国耶拿分析仪器股份公司);HH-6型数显恒温水浴锅(常州国华电器有限公司);GL-20G-Ⅱ型低温超速离心机(上海安亭科学仪器厂);电子天平(Sartorius);Model 680型酶标仪(美国BIO-RAD);DSHZ-300A旋转式恒温振荡器(江苏太仓设备厂);GZLY-0.4型药用真空冷冻干燥机(北京速原中天科技有限公司)。
2 方法
2.1 僵蚕样品的制备
2.1.1 僵蚕不同极性溶媒提取物的制备 僵蚕药材粉碎过三号筛,得到药材粗粉。称取10 g僵蚕药材粗粉加10倍量(100 mL)石油醚超声提取1 h,过滤,滤液80 ℃水浴蒸干(石油醚提取物,S1);待药渣溶剂挥干后加8倍量(80 mL)乙酸乙酯超声提取1 h,过滤,滤液蒸干(乙酸乙酯提取物,S2);同上操作得到甲醇提取物(S3)、水提取物(S4)。
2.1.2 僵蚕不同组分的分离 依次使用截留量为10、3、1 kDa超滤离心管对僵蚕水提取液超滤,分别收集不同分子质量的天然肽溶液,分级为>10 kDa、3~10 kDa、1~3 kDa、<1 kDa组分,冷冻干燥。
2.1.3 炒僵蚕的制备 称取100 g僵蚕,将恒温烫板的温度设置为180 ℃,待温度上升至所设温度时倒入10 g麦麸,翻炒至麦麸起烟后,加入称量好的僵蚕,炒制15 min。筛出麦麸,将炒制好的僵蚕放凉,粉碎过三号筛,得到炒僵蚕样品,备用[3]。
2.1.4 僵蚕酶解品的制备 取僵蚕>10 kDa冻干粉5 mg溶于蒸馏水中,底物浓度为3%,100 ℃水浴加热15 min,待温度降至60 ℃,置于恒温磁力搅拌器中,调至pH为9.0,加入酶底比为6%的胰蛋白酶,水解5 h后迅速转入沸水浴中煮沸15 min灭酶,冷却至室温,3600 r·min-1离心20 min,收集上清液冻干。
2.2 对6-OHDA诱导的人神经母细胞瘤细胞(SH-SY5Y)细胞保护作用的筛选研究
2.2.1 药物的制备 僵蚕不同极性溶媒提取物及水提取物不同组分用DMEM培养液溶解,分别配成质量浓度为0.1、0.05、0.025 mg·mL-1溶液,0.22 μm滤膜过滤除菌,备用。
2.2.2 SH-SY5Y细胞培养 用含10%新生胎牛血清、100 U·mL-1链霉素、100 μg·mL-1青霉素的DMEM培养液,于37 ℃、5%CO2、饱和湿度的培养箱中培养细胞[5]。细胞呈贴壁生长,待SH-SY5Y细胞进入对数生长期后选取生长状态良好的细胞,用0.25%的胰蛋白酶消化,使细胞从瓶壁上分离下来,以1∶3~1∶4比例传代。当传代细胞进入对数生长期即进行实验。
2.2.3 实验方法
2.2.3.1 对6-OHDA损伤的SH-SY5Y细胞增殖率的影响实验 将对数生长期的SH-SY5Y细胞接种到96孔板,调节细胞浓度为1×104每孔。在培养箱中培养12 h后,吸出旧的培养基,给药组每孔加入100 μL不同浓度的样品溶液,空白对照组每孔加入100 μL完全培养基,再置于培养箱中培养3 h,除去培养基,样品组每孔加入100 μmol·mL-1的6-OHDA,空白对照组每孔加入100 μL DMEM培养液[6],置于培养箱中培养24 h,每孔加20 μL四唑盐(MTT)[7]试液(5 mg·mL-1,PBS溶解),继续于培养箱中培养4 h,将孔内液体吸出,每孔加入100 μL DMSO,置于酶标仪振荡10 min,在490 nm波长下测定吸光度A。

(1)
2.2.3.2 对SH-SY5Y细胞毒性实验 将生长期的SH-SY5Y细胞接种到96孔板,调节细胞浓度为1×104每孔。在培养箱中培养12 h,吸出旧的培养基,然后每孔加入100 μL不同浓度的样品溶液(DMEM培养液溶解),空白对照组每孔加入100 μL DMEM培养液[6],置于培养箱中培养24 h,每孔加20 μL MTT试液,继续于培养箱中培养4 h,将液体吸出,每孔加入100 μL DMSO,置于酶标仪振荡10 min,在490 nm波长下测定吸光度A。

(2)
2.3 对抑制AchE活性的筛选
在96孔板中依次加入40 μL样品溶液,80 μL PBS(0.1 mol·L-1,pH=8.0),20 μL 5,5′-二硫代双-(2-硝基苯甲酸)(DTNB,2.5 mmol·L-1)及20 μL乙酰胆碱酯酶(AchE,0.25 U·mL-1,pH=8.0 PBS溶解稀释)。37 ℃孵育10 min 后,加20 μL硫代乙酰胆碱(ATCI,1 mmol·L-1)。37 ℃孵育10 min后,用酶标仪在405 nm下测定其吸光度[8],根据下式计算抑制率。
抑制率(%)=[(A空白-A完全抑制)-(A样品-A样品空白)]/(A空白-A完全抑制)×100
(3)
其中,空白组用40 μL PBS(pH8.0)代替40 μL样品溶液;完全抑制组用40 μL石杉碱甲(10 μg·m L-1)代替40 μL样品溶液。样品空白组用20 μL PBS(pH8.0)代替20 μL AChE(0.25 U·mL-1,pH8.0 PBS溶解稀释)。
2.4 三氯乙酸处理法测定寡肽含量
取僵蚕样品1 mg溶于1 mL蒸馏水中,加入15%三氯乙酸溶液1 mL,摇匀,放置10 min,沉淀酸不溶性蛋白质,置离心管中,4000 r·min-1离心10 min,取上清液1 mL样品溶液为粗蛋白溶液[9]。

(4)
2.5 双缩脲试剂法测定蛋白含量
2.5.1 溶液配制 双缩脲试剂:称取0.075 g CuSO4·5H2O,0.25 g酒石酸钾钠,用25 mL水溶解,再加10% NaOH 15 mL,溶解后用水定容至50 mL,粗蛋白溶液见2.4。
2.5.2 实验步骤 见表1。

表1 双缩脲法测定蛋白含量操作步骤
注:—为不加任何试剂。
混匀,放置30 min后,用分光光度计在540 nm波长处比色,以空白管调零点,测定各管吸光度值。
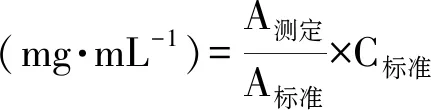
(5)
(6)
3 实验结果与分析
3.1 僵蚕不同极性溶媒提取物对6-OHDA诱导损伤的SH-SY5Y细胞保护作用筛选
模型组与空白对照组比较,存活率显著降低(P<0.01),S1在质量浓度分别为0.025、0.05 mg·mL-1时,S3在3个浓度下与模型组比较存活率差异有统计学意义(P<0.05),不同浓度S4对细胞保护作用与模型组比较差异有统计学意义(P<0.01),可见水提取物对6-OHDA诱导损伤的SH-SY5Y细胞保护作用最强,结果见图1。
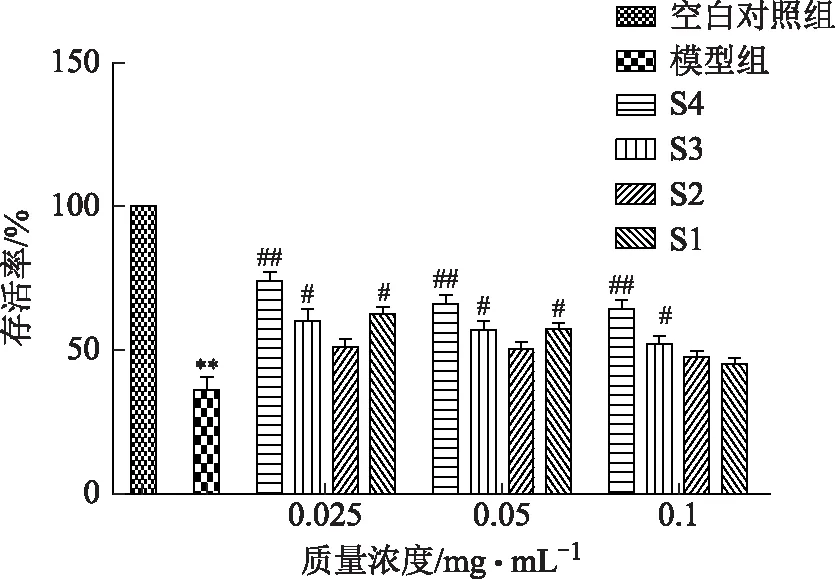
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01,n=5。图1 僵蚕不同极性溶媒提取物对6-OHDA诱导损伤SH-SY5Y细胞的保护作用
3.2 僵蚕活性组分筛选
3.2.1 僵蚕不同组分对AchE抑制活性的筛选 僵蚕水提物各组分在质量浓度为2.5~10 mg·mL-1时对AchE均有一定的抑制力,且有剂量依赖性,其抑制作用从大到小依次为:<1 kDa、1~3 kDa、3~10 kDa、水提取物、>10 kDa,结果见图2。
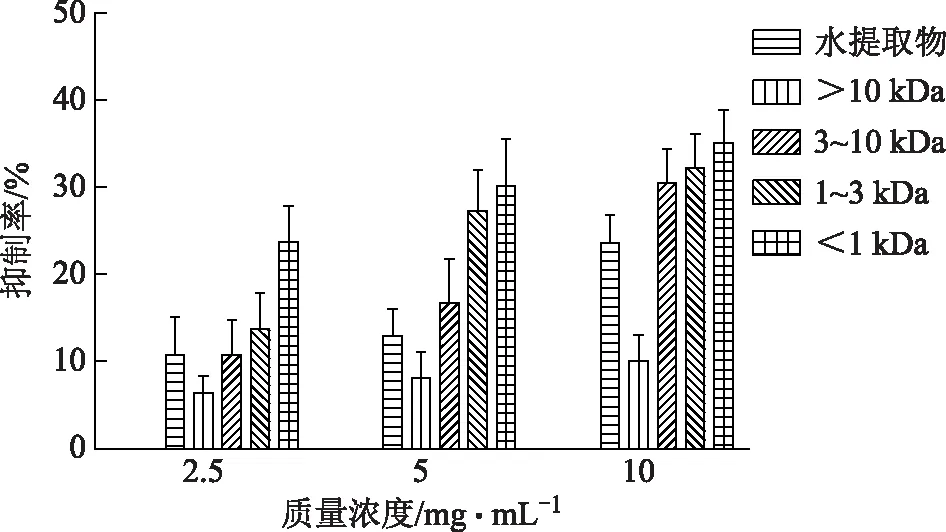
图2 僵蚕不同组分对AchE抑制率的影响
3.2.2 僵蚕不同组分对6-OHDA诱导损伤SH-SY5Y细胞保护作用的筛选 根据僵蚕提取物的不同组分综合考虑,除>10 kDa组分在0.025 mg·mL-1时有明显毒性,其他组分质量浓度在0.025~0.1 mg·mL-1时有明显的增殖作用,见图3A,故将僵蚕提取物的质量浓度定在0.025、0.05、0.1 mg·mL-1进行对6-OHDA损伤的SH-SY5Y细胞增殖率影响实验。模型组与空白对照组比较细胞增殖率显著性降低(P<0.05),与模型组比较,<1 kDa组分在质量浓度为0.05~0.1 mg·mL-1时细胞增殖率有显著性升高(P<0.01),1~3 kDa 组分在质量浓度为0.05、0.1 mg·mL-1时有显著性升高(P<0.05),对细胞的保护作用最强的为<1 kDa组分,结果见图3B。
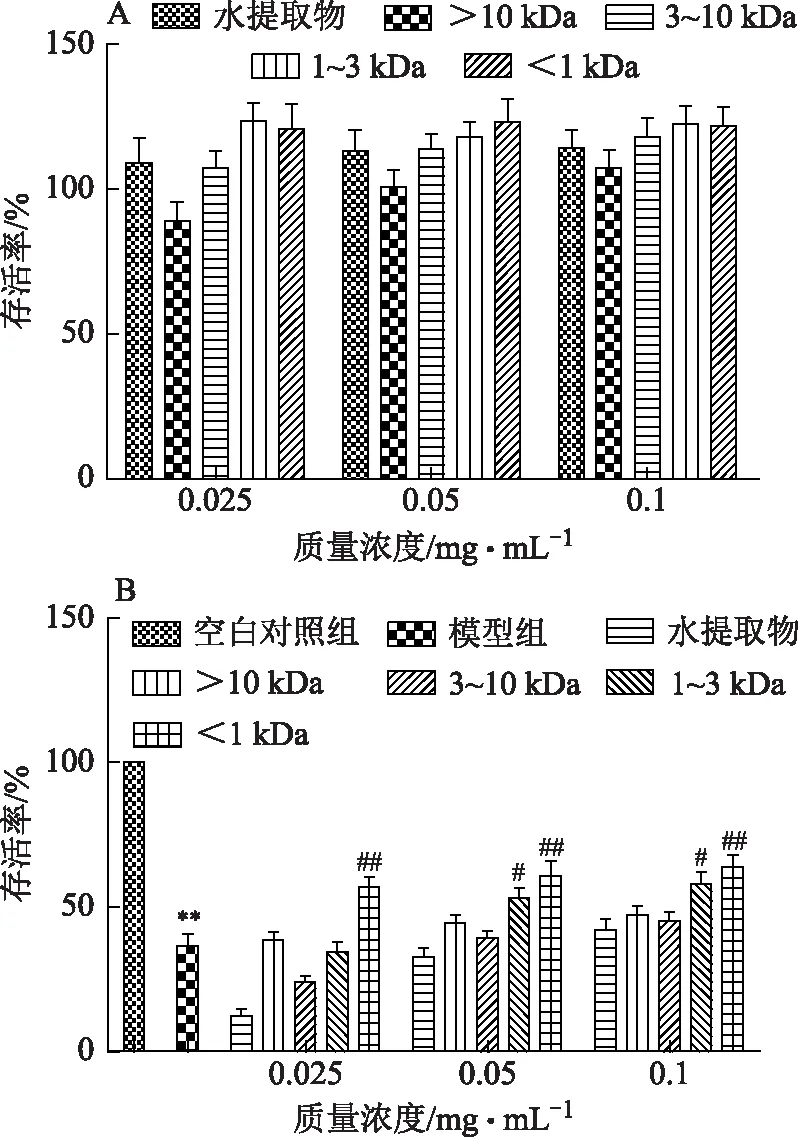
注:A.僵蚕不同组分对SH-SY5Y细胞的毒性实验;B.僵蚕不同组分对6-OHDA损伤的SH-SY5Y细胞的保护作用;与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01,n=5。图3 僵蚕不同组分对SH-SY5Y细胞的影响
3.3 炮制前后僵蚕毒性对比
取僵蚕5个不同组分分别配制成质量浓度为0.5 mg·mL-1的样品,僵蚕>10 kDa组分在0.5 mg·mL-1浓度下,SH-SY5Y细胞的存活率为79.52%,对细胞有明显的杀伤作用;炒僵蚕>10 kDa组分在0.5 mg·mL-1浓度下SH-SY5Y细胞的存活率为91.42%,对细胞没有明显的杀伤作用,并有一定的增殖作用,其他组分在质量浓度为0.5 mg·mL-1时对SH-SY5Y细胞均无明显杀伤作用,通过在相同浓度下对细胞造成的损伤程度比较,结果表明,僵蚕经过炮制后毒性降低,符合炮制使其减毒的目的,实验结果见图4。

图4 僵蚕与炒僵蚕对SH-SY5Y细胞毒性实验
3.4 炮制前后僵蚕<1 kDa组分活性对比
僵蚕及炒僵蚕<1 kDa组分在质量浓度为2.5~10 mg·mL-1时,对AchE有一定的抑制作用。相同浓度下僵蚕寡肽对AchE的抑制率略高于炒僵蚕寡肽,结果见图5A。僵蚕对SH-SY5Y保护作用实验中,
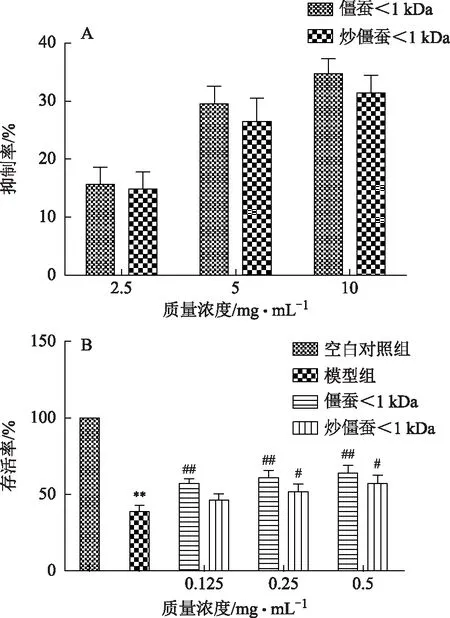
注:A.僵蚕及炒僵蚕寡肽对AchE的抑制率;B.僵蚕及炒僵蚕寡肽对6-OHDA诱导的SH-SY5Y细胞保护作用;与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01,n=5。图5 僵蚕炮制前后不同组分对SH-SY5Y细胞的影响
与空白对照组比较,模型组细胞增殖率显著降低(P<0.01),与模型组比较,僵蚕<1 kDa组分在质量浓度为0.125~0.5 mg·mL-1时对损伤SY5Y细胞有显著的增殖作用(P<0.01),在质量浓度为0.5 mg·mL-1时有增殖率最大,达到63.95%;炒僵蚕<1 kDa组分在质量浓度为0.25~0.5 mg·mL-1时对损伤SY5Y细胞有显著的增殖作用(P<0.05),综上所述,炒僵蚕<1 kDa组分对细胞的保护作用弱于僵蚕,结果见图5B。
3.5 炮制前后僵蚕寡肽含量的对比
分别对僵蚕炮制前后总提取物蛋白含量及<1 kDa组分寡肽含量进行比较,僵蚕炮制后蛋白含量降低,但炒僵蚕<1 kDa组分的寡肽含量及收率均高于僵蚕,推测原因可能是经过肽键热振荡作用使蛋白质的肽键发生断裂,生成小分子肽段,炮制后活性下降可能是>10 kDa蛋白含量下降和<1 kDa寡肽含量升高的综合作用结果。
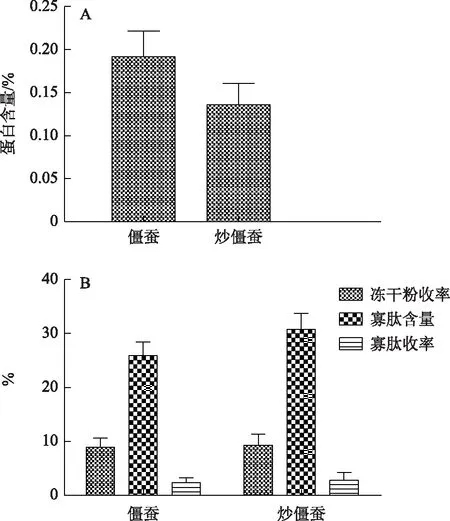
注:A.炮制前后蛋白含量对比;B.炮制前后寡肽收率比较。图6 僵蚕炮制前后蛋白含量、寡肽收率的比较
3.6 炮制前后僵蚕天然与酶解<1 kDa组分活性及寡肽含量对比
炮制前后僵蚕天然与酶解<1 kDa组分质量浓度为2.5~10 mg·mL-1,随着浓度的增加对AchE的抑制率随之增加,在相同浓度下进行对比,天然<1 kDa组分对AchE的抑制率强于酶解<1 kDa组分,但差别不大,结果见图7A。炮制前后僵蚕天然<1 kDa组分的活性均高于酶解<1 kDa组分,但酶解寡肽的收率高于天然寡肽,僵蚕酶解寡肽为天然寡肽的1.31倍,炒僵蚕酶解寡肽收率为天然寡肽的1.67倍,结果见图7B。
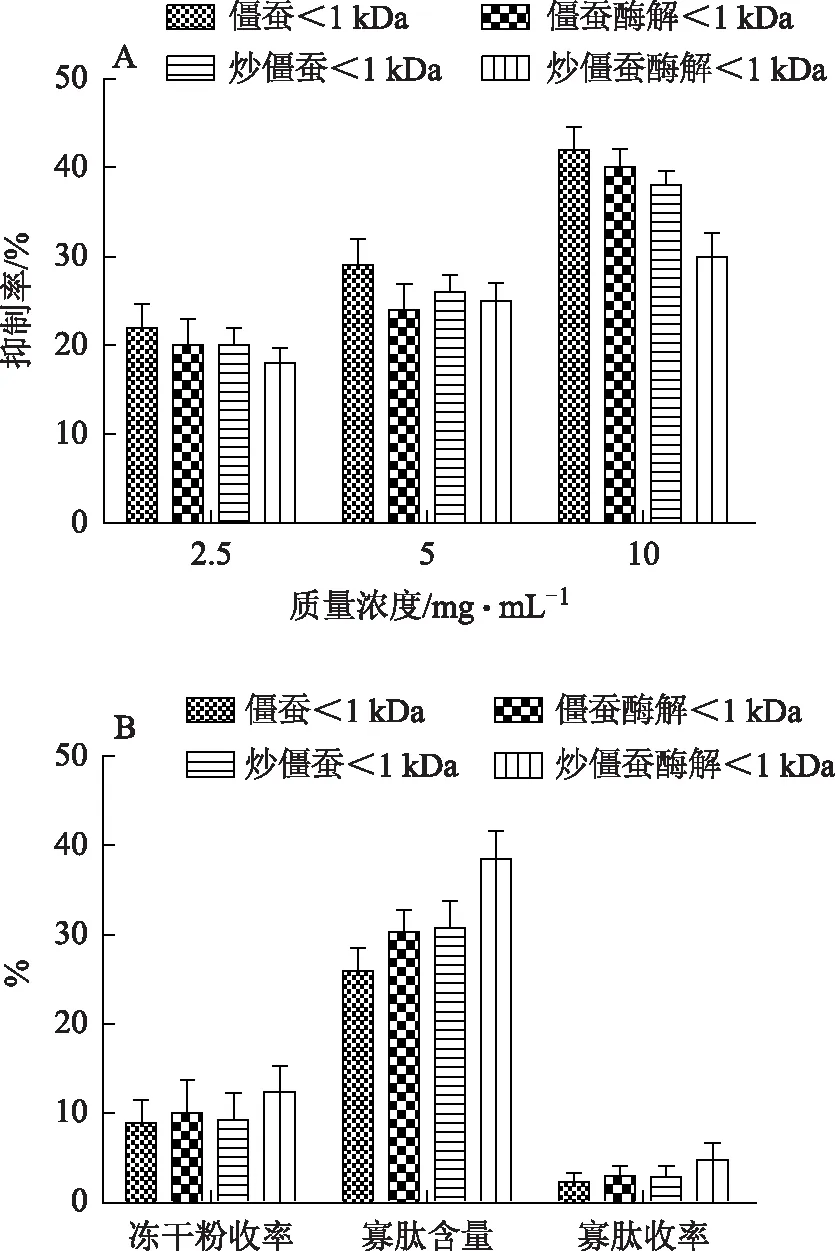
注:A.炮制前后僵蚕天然与酶解<1 kDa组分对AchE的抑制率影响;B.炮制前后天然寡肽与酶解寡肽含量对比。图7 僵蚕炮制前后天然与酶解<1 kDa组分活性及寡肽含量比较
4 讨论
僵蚕是一种虫类动物药,研究多集中在僵蚕品质、炮制工艺等方面[10-12],对其活性研究较少。其具有息风止痉、祛风止痛、化痰散结的功效,结合相关症状,有文献报道[13-14]僵蚕与其他中药配伍治疗帕金森的经验,为了进一步研究僵蚕治疗帕金森疾病的物质基础,本文筛选了僵蚕体外抗帕金森的活性部位。
6-OHDA诱导体外细胞SH-SY5Y损伤模型最常用于帕金森(PD)的发病机制和药物疗效的研究[15-19]。细胞凋亡被认为是帕金森病病理机制中神经元死亡的病因之一,AchE可以在胆碱能神经突触部位和神经肌肉接头终止胆碱能神经信号的传递,并且在诱导各种类型的细胞系凋亡的过程中,都有AchE的表达增加,提示AchE可能参与了PD发病过程中的神经元凋亡。故本文应用上述两个指标来筛选活性成分[20-22]。
为了筛选僵蚕治疗帕金森病活性组分,本文应用6-OHDA诱导的SH-SY5Y细胞损伤模型对其全成分(僵蚕不同极性溶媒提取物)进行系统研究,经活性筛选表明,其水提取物活性最强。进而根据不同分子量对僵蚕水提取物进行分析,结果表明,5个组分中的活性最强的为<1 kDa组分。
本文基于肽键热振荡理论对僵蚕炮制前后的化学成分与毒性、活性变化规律进行研究。结果表明,僵蚕麸炒后,总蛋白含量下降,总寡肽含量升高,表明经肽键热振荡作用肽键断裂,产生了更多的寡肽成分,且僵蚕>10 kDa组分对SH-SY5Y细胞具有抑制增殖作用,但炒僵蚕>10 kDa组分对SH-SY5Y无明显抑制增殖作用。说明炮制后毒性降低,同时活性略有下降,这可能是具有一定毒性的蛋白含量下降和活性寡肽含量升高的综合作用结果。将天然与酶解<1 kDa组分进行AchE抑制及寡肽收率方面进行比较。实验结果表明,天然寡肽的活性略强于酶解寡肽,但酶解寡肽的收率要高于天然寡肽,在工业上酶解寡肽可代替天然寡肽。

