西南地区动脉粥样硬化性心血管疾病患者阿司匹林抗血小板药效相关基因多态性分析*
楚明明,王 强,张,邹 朗,雷 健,张 蓉
(陆军军医大学第二附属医院药剂科,重庆 400037)
动脉粥样硬化性心血管疾病(ASCVD)被称为“发达国家居民健康的头号杀手”,在发展中国家的发病率也日趋增高[1]。血小板的粘附、活化和聚集在ASCVD的病理生理过程中起重要作用。常用抗血小板聚集药物阿司匹林是防治ASCVD的基石。2006年,美国预防服务工作组将服用阿司匹林作为心血管疾病高危人群成本效益和临床价值较高的预防措施[2]。但部分患者服药后出现阿司匹林抵抗(AR),发生率为5.5% ~60%[3]。AR受遗传、细胞和临床等多方面因素影响,目前有多种单核苷酸多态性(SNP)被报道与AR相关,如环氧合酶-1(COX-1)基因多态性、血小板糖蛋白(GP)Ⅱb/Ⅲa基因多态性、二磷酸腺苷(ADP)受体P2Y1基因多态性、血小板糖蛋白Ⅰa/Ⅱa受体基因多态性等[4-5]。本研究中通过分析 GPⅢaPLA2,PEAR1,PTGS1,GP1BA 4 个基因位点在西南地区人群中的突变情况,探讨阿司匹林抗血小板药效相关基因多态性的分布情况,为临床实施个体化的阿司匹林治疗方案提供依据。现报道如下。
1 资料与方法
1.1 研究对象
选取医院心血管内科2018年4月至9月收治的需口服阿司匹林治疗的ASCVD患者358例(年龄18~80岁,性别不限)。排除有阿司匹林禁忌证,3个月内发生过脑出血,1个月内进行过重大手术,以及严重感染、恶性肿瘤和免疫系统疾病患者。本研究经医院医学伦理委员会批准,患者签署知情同意书。
1.2 仪器与试药
仪器:Fluotec 48E型微量荧光检测仪(西安天隆科技有限公司);SorvallTMLegendTMMicro 17R型离心机(Thermo Scientific公司);LX-300型迷你离心机和Vortex-5漩涡混合器(海门其林贝尔仪器制作有限公司)。
试药:阿司匹林肠溶片(Bayer Vital GmbH,进口药品注册证号H20130339,规格为每片100 mg)。测序反应通用试剂盒(北京华夏时代基因科技发展有限公司)。
1.3 阿司匹林抗血小板药效相关基因多态性检测
采集患者静脉血2 mL,置乙二胺四乙酸(EDTA)抗凝管中,经裂解、结合、洗涤、洗脱、纯化,得样本DNA片段,然后经聚合酶链反应(PCR)进行扩增,通过焦磷酸测序法测定基因多态性。
1.4 统计学处理
采用SPSS 24.0统计学软件分析。正态分布的连续性变量以±s表示,行双侧t检验;计数资料以百分率(%)表示,行 χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 阿司匹林抗血小板药效相关基因检测
358例患者中,GPⅢaPLA2(T>C)基因均为野生型,无突变;PEAR1(G >A)基因野生(GG)型 111例,突变杂合(GA)型 180例,突变纯合(AA)型67例,突变率68.99%;PTGS1(-842A >G)基因野生(AA)型 356例,突变杂合(AG)型 2 例,突变率 0.56%;GP1BA(5792C>T)基因野生(CC)型307例,突变杂合(CT)型48例,突变纯合(TT)型3例,突变率14.25%。详见表1。
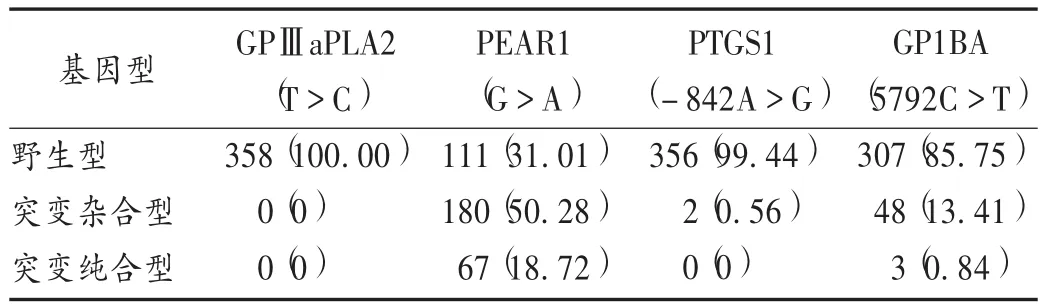
表1 阿司匹林抗血小板药效相关基因检测结果[例(%)]
2.2 患者基因型一般资料
统计患者基因型时,排除2例PTGS1位点突变杂合型,基于GPⅢа PLA2和PTGS1均为野生基因型,依据PEAR1和GP1BA基因型分组。PEAR1基因野生型111例(31.18%),突变型 245 例(68.82%),GP1BA 基因野生型305例(85.67%),突变型51例(14.33%)。纳入患者按基因型的不同分组,野生组与突变组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表2。
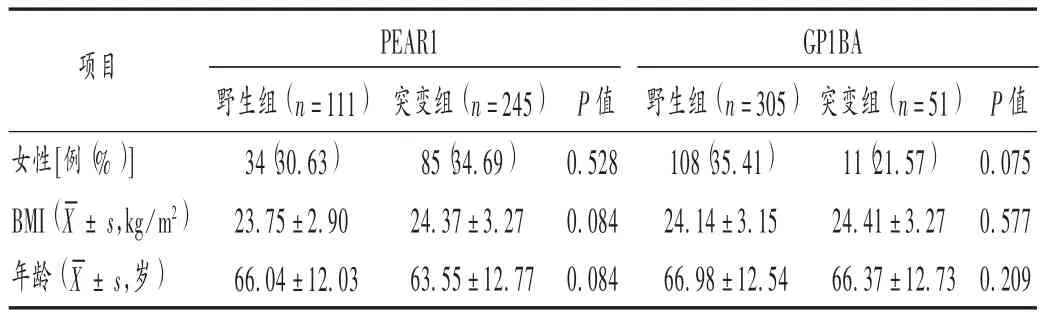
表2 患者基因型基线信息
3 讨论
阿司匹林是治疗和预防心脑血管疾病的主要药物,但部分患者即使规律服用阿司匹林仍会发生AR。目前,AR的发生机制尚未研究清楚,以往研究提示,抗血小板药物代谢及作用过程中涉及的相关基因多态性可能是重要因素。研究较多的阿司匹林代谢相关基因有COX、血小板膜糖蛋白、PEAR1及PTGS1等。
COX以COX-1和COX-2两种同工型存在,在前列腺素合成过程中发挥关键作用。阿司匹林可使COX-1乙酰化失活,抑制血栓素A2的产生,阻止血小板聚集。MAREE等[6]的研究表明,携带COX-1突变体842G等位基因的患者更易出现AR。LEPÄNTALO等[7]的研究发现,COX-1基因842位点G等位基因在AR患者中的分布频率显著升高,血小板聚集和血栓素水平显著增加,故推断G等位基因与AR的发生相关。
血GP受体GPⅢa基因外显子2第1 565位基因突变后,GPⅢa蛋白33位点亮氨酸(PLA1)被脯氨酸(PLA2)置换,影响血小板的最终激活。SZCZEKLIK等[8]监测了携带PLA等位基因的80名健康男性服用阿司匹林前后出血时间的改变,结果携带PLA2等位基因的人出血时间较携带PLA1等位基因者短,提示携带PLA2等位基因者更易发生AR。GPIb是由 GPIbα和GPIbβ 2个亚基构成,其表达减少会引发血小板的聚集和释放。FUJIWARA等[9]发现,在110例健康男性受试者中,血小板膜 GP1bα多肽(GPIBA)基因型为CC或CT的,与基因型为TT的相比,AR风险增加。
PEAR1是表达在血小板和内皮细胞上的1型膜蛋白,该受体的磷酸化可能促进血小板脱颗粒,引起血小板之间不可逆的聚集反应。WÜRTZ等[10]的研究表明,携带PEAR1基因rs12041331位点A等位基因的患者服用阿司匹林时,发生心肌梗死及死亡的比例升高。LEWIS等[11]研究发现,PEAR1基因rs12041331位点A等位基因携带者,在单用阿司匹林或联用氯吡格雷行抗血小板治疗时,心血管事件发生率及死亡率均显著升高。研究提示[12],PEAR1的野生G基因的基因频率为0.61,突变A基因的基因频率为0.39。石秀锦等[13]的研究表明,中国人群中PEAR1的野生G基因的基因频率为0.624,突变A基因的基因频率为0.376,与本研究结论一致。本研究中,GP1BA基因存在突变,突变率为14.25%。GPⅢaPLA2和PTGS1两个基因的突变率较低,与石秀锦等[13]的研究结果接近。
PTGS1位点突变在爱尔兰人群中频率为6%,而本研究结果显示,其在中国人群中的频率较低,约为0.56%,表明人种差异是遗传药理学研究的重要影响因素。
本研究结果表明,在患者服用阿司匹林之前,检测其阿司匹林抗血小板疗效相关基因突变情况,可预估其抗血小板治疗反应,从而为患者制订个体化的治疗方案,减少血栓栓塞事件发生。相较于服药后监测患者血小板聚集率及血栓弹力素等判定该药对患者是否有效,基因检测更方便、快捷,可提前预判患者是否会产生抵抗,最大限度地保障药物的有效性和安全性。本研究不足之处在于开展时间不长,样本量不足,且未获得患者的预后信息,下一步可继续扩大样本量,同时持续追踪患者的预后信息进行研究,为临床合理使用阿司匹林提供更有力的循证依据。

