野生笃斯越桔总花青素对SPCA-1细胞活力抑制及机理
姜浩瀚, 吕留庄, 景志行, 汪雯翰, 许剑锋*
(1.上海海洋大学 食品学院,上海 201306;2.上海市农业科学院 食用菌研究所,上海 201403)
笃斯越桔(Vaccinium uliginosumLinn.)具有可观的观赏价值,是珍稀的药用植物[1]。中国越桔属植物丰富,目前常见的品种均引种于国外[2]。越橘中富含花色苷、天然视紫质等活性成分,具有预防脑神经衰老[3],改善心血管功能和抗癌等显著的生物活性[4]。目前研究表明,越橘中花色苷在减轻目眩[5];保护血管,促进视红细胞再生方面有特殊的功效[6]。野生越桔花青苷种类及含量丰富,其花色苷的质量分数可达到3.3~33.8 mg/kg,远高于人工栽培5~20倍[7-8]。随着国家经济实力提升,人民生活水平逐步提高,饮食结构的改变等因素,肿瘤的发病率也在逐年上升。近年来,已有部分研究表明黄酮类合化物具有抗肿瘤及逆转肿瘤多药耐药的活性,如芹菜素 (apigenin)[9]、 夫 拉 平 度 (flavopiridol)[10]、佩 兰 素(eupatorin)[11]等。近几年,国外相关研究表明花青素在抑制肿瘤增殖和阻断致癌因子、诱导细胞扩散方面发挥一定作用,但有关花青素针对肺腺癌细胞SPCA-1的抗肿瘤特性以及作用机理尚未发现有研究报道。
作者以人肺腺癌细胞系SPCA-1为研究对象,参照高效的总花青素提取方法[12-15],通过检测笃斯越桔总花青素对体外培养SPCA-1肿瘤细胞活力的抑制作用、细胞凋亡蛋白表达,深入研究其作用机理,为中国野生笃斯越桔进一步开发和相关抗癌药物的发现奠定理论基础。
1 材料与方法
1.1 材料与试剂
笃斯越桔:大兴安岭林区并在-20℃冻存;甲酸、蒸馏水、甲醇(分析纯),购自上海辛森化学科技有限公司;大孔树脂:XAD-7,购自郑州勤实科技有限公司;SPCA-1细胞株,由上海海洋大学保存传代;RPMI-1640、无色RPMI-1640和胎牛血清,购自GIBCO公司;活性氧检测试剂盒(S0033),购自上海前尘生物科技有限公司;Ribonuclease A(RNase A)、alamarBlue@ 、Propidium iodide(PI),均购自上海浩洋生物科技有限公司;凋亡试剂盒、P53、Caspase-3、Bcl-2、Bax试剂盒,购自上海酶联生物科技有限公司。
1.2 仪器与设备
BD Accuri C6流式细胞仪,美国碧迪公司产品;TG-17高速冷冻离心机,四川蜀科仪器有限公司产品;Christ Alpha 2-4 LD冷冻干燥机,天津钧星瑞科技有限公司产品;BC-R2005型旋转蒸发仪,上海一科仪器有限公司产品;Synergy-HT多功能酶标仪,美国Bio-TEK公司产品。
1.3 试验方法
1.3.1 中国野生笃斯越桔中总花青素制备 按照Prior等[12-15]实验方法稍作修改,将笃斯越桔冻果匀浆并冻干成粉,取200 g粉末,加入2 L(甲醇∶水∶甲酸=85∶15∶0.5,体积比),超声 5 min,4 ℃、6000 r/min离心10 min并回收上清液。 重复上述操作3次,合并清液,4℃、8000 r/min离心10 min,上清旋转蒸干备用。
1.3.2 中国野生笃斯越桔总花青素纯化 基于XAD-7的大孔树脂柱,用体积分数95%乙醇洗脱2~3个体积,用蒸馏水洗清洗后,再用2~3倍体积分数0.5%甲酸-水溶液饱和吸附柱,加入上清液待充分吸附后,体积分数0.5%甲酸-甲醇溶液洗脱,回收总花青素并去除甲醇,除酸后冷冻干燥成粉并置于-20℃保存。
1.3.3 SPCA-1细胞培养及生长抑制研究 SPCA-1细胞复苏接种于250 mL培养瓶中,选取DMEM培养基,在37℃、体积分数5%CO2恒温培养箱中培养。将细胞培养皿中细胞采用胰酶消化,吹打成细胞悬液,调节细胞密度至 2×104个/mL,每孔200 μL接种于96孔板中并培养4~6 h。待细胞贴壁,除去旧培养基,分别加入质量浓度不等的样品(50、80、100、150 μg/mL 和 200 μg/mL) 培 养 基100 μL,其中 25 μg/mL 的 5-氟尿嘧啶(5-Fu)是阳性对照,DMSO是阴性对照。置于37℃、体积分数5%CO2细胞培养箱中共培养72 h,更换培养基,分别加入180 μL培养基和20 μL Alamar blue原液并置于培养箱中。测定波长为570 nm和600 nm时的吸光度值,根据公式计算抑制率并求IC50值。

式(1)中:S,抑制率,%;A1,样品组 570 nm 吸光度;A2,样品组600 nm 吸光度;A3,控制组570 nm 吸光度;A4,控制组600 nm 吸光度。
1.3.4 花青素对SPCA-1细胞早期凋亡影响 调整生长状态良好的SPCA-1细胞浓度至1×105个/mL,每孔1 mL细胞悬液接种于12孔板,本组实验包含阴性对照组 (体积分数 5‰ DMSO),3组样品组(50、100 μg/mL 和 200 μg/mL) 和 阳 性 对 照 组(25 μg/mL 5-Fu),分别向 3 个样品组加入含有 50、100 μg/mL和200 μg/mL花青素的培养基,培养48 h后,加入质量分数0.05%EDTA进行离心,收集细胞。一部分加入2.5 μL Annexin V-FITC和2 μL PI、300 μL Binding Buffer悬浮细胞混匀,室温避光孵育15 min,FACS标准程序测定。另一部分加入 100 μL 含 1 μg/mL PI和 500 μg/mL Rnase A 的PBS溶液,常温放置30 min,加300 μL PBS后,FACS标准程序测定。
1.3.5 流式细胞术PI染色法检测对SPCA-1细胞周期影响 按照1.3.3方法培养SPCA-1细胞并将其分为阴性对照组,4 个样品组 (50、80、100 μg/mL和200 μg/mL)和阳性对照组。分别向样品组中加入含 50、80、100 μg/mL 和 200 μg/mL 花青素培养基,37℃培养48 h,离心并收集细胞,加预冷体积分数70%乙醇,4℃固定,再次离心,细胞用PBS溶液清洗 2 次,加 500 μg/mL Rnase A 和 100 μL 含 1 μg/mL PI的PBS试液,放置30 min,加300 μL PBS后,FACS标准程序测定。
1.3.6 流式细胞术DCF染色法检测SPCA-1细胞ROS释放 按照1.3.3方法培养SPCA-1细胞并将其分为阴性对照组,4 组样品组 (20、50、100 μg/mL和 200 μg/mL)和阳性对照组,加入含 20、50、100 μg/mL 和 200 μg/mL 花青素培养基;37 ℃培养24 h,倒除培养基,加入400 μL含有50 mmol/L DCF 的 PBS,37 ℃培养 30 min,除上清液加 300 μL质量分数0.05%EDTA,用FACS标准程序检测。
1.3.7 花青素对 SPCA-1细胞 Caspase-3、P53、Bcl-2、Bax蛋白表达的影响
1)不同质量浓度药物处理细胞。收集细胞,1000 r/min、3 min离心,除上清液,调整培养基浓度为5×106个,定培养基至5 mL,在37℃、体积分数5%CO2、饱和湿度培养4~6 h,分别每孔加入样品使质量浓度为 5-Fu(12.5、50 μg/mL)、花青素(50、80、100、200 μg/mL)的培养基 5 mL,DMSO 溶液为阴性对照,37℃培养48 h。
2)准备细胞提取物。细胞在4℃、1000 r/min条件下,离心10 min并收集,用PBS洗细胞一次;预冷的Cell Lysis Buffer溶液稀释细胞到目标浓度。在冰上孵育5 min。4℃、10 min离心;取上清液,保存至-70℃。
3)Caspase-3、 P53、Bcl-2、Bax 活 性 测 试 。Caspase-3、P53、BAX、Bcl-2 蛋白活性的测定方法按试剂盒说明书操作。
1.3.8 统计学方法 本研究细胞实验所得数据用软件FlowJo7.6.3分析,并对各项结果使用spss 20进行显著性分析。
2 结果与分析
2.1 中国野生笃斯越桔花青素对SPCA-1细胞增殖的影响
由图1可知,SPCA-1细胞增殖作用明显受到野生笃斯越桔总花青素的抑制,且呈显著的依赖性,数据分析显示野生笃斯越桔花青素对SPCA-1细胞增殖抑制作用的IC50值为107.399 μg/mL。

图1 不同质量浓度总花青素对SPCA-1细胞增殖抑制作用Fig.1 Inhibition effect of different concentrations of anthocyanins on SPCA-1 cells proliferation
2.2 中国野生笃斯越桔花青素对SPCA-1细胞早期凋亡的影响
实验结果如图2所示,当50、100 μg/mL和200 μg/mL花青素组早期细胞凋亡率分别为20.3%,28.3%和39.5%,均明显高于阴性对照组,且呈现质量浓度依赖性。由表1可得出,较之阴性对照组,阳性对照组、100 μg/mL 和 200 μg/mL 样品组均呈现极显著性差异。
2.3 中国野生笃斯越桔花青素对SPCA-1细胞周期的影响
花青素处理组都能明显降低处于G0/G1期细胞的数量,进而能引起 SPCA-1细胞凋亡,实验表明凋亡细胞主要来自于 G0/G1期细胞,如图3所示;参照阳性对照,虽然也引起凋亡细胞比率的上升,但是凋亡细胞主要来自于G2/M期,两者的处在不同作用时期。

图2 不同质量浓度花青素对SPCA-1细胞凋亡的影响Fig.2 Effects of different concentrations of anthocyanins on apoptosis of SPCA-1 cell
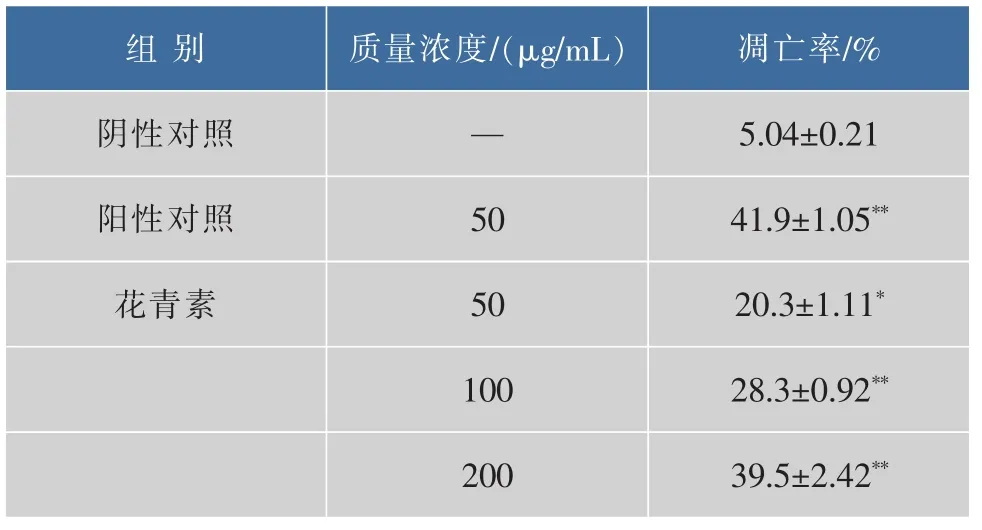
表1 不同质量浓度花青素诱导SPCA-1细胞凋亡率(x±s)Table 1 Rate of SPCA-1 cell apoptosis induce by different concentrations of anthocyanins
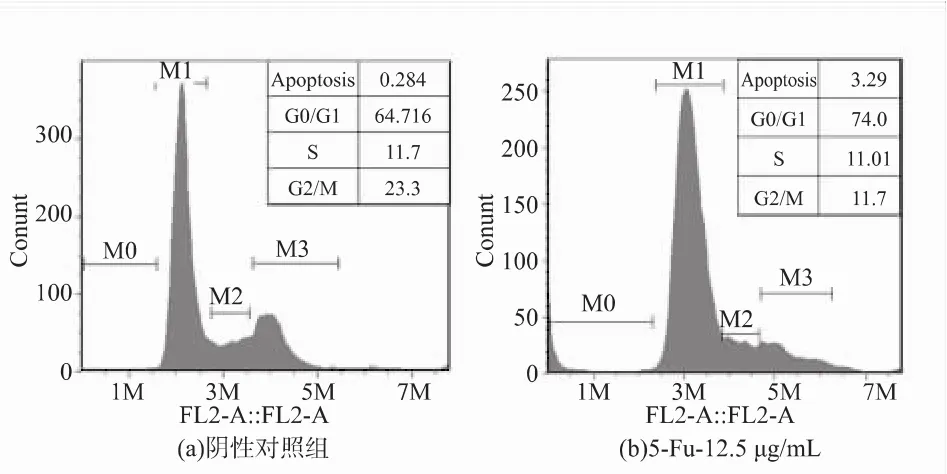

图3 不同质量浓度花青素对SPCA-1细胞周期的影响Fig.3 Effect of different concentrations of anthocyanins on SPCA-1 cell cycle
2.4 中国野生笃斯越桔花青素对SPCA-1细胞ROS释放的影响
结果如图4所示,在20 μg/mL的质量浓度时ROS 释放不明显, 在 50、100 μg/mL 和 200 μg/mL的花青素均能明显引起ROS的释放,尚未发现质量浓度依赖性。 因为已有研究表明肿瘤细胞凋亡,Fas-FasL受体途径和线粒体途径在很大程度上都依赖于ROS,而且2种途径是相互联系的,与ROS水平密切相关。
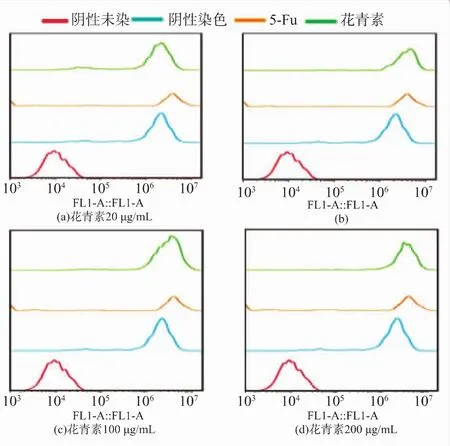
图4 不同质量浓度花青素对SPCA-1细胞ROS释放的影响Fig.4 Effect of different concentrations of anthocyanins on ROS release of SPCA-1 cells
2.5 总花青素对SPCA-1细胞Caspase-3、P53、Bcl-2、Bax蛋白表达的影响
由表2可知,经不同质量浓度花青素处理48 h后的SPCA-1细胞内Caspase-3质量浓度均比阴性对照组增强。较之于阴性对照组,阳性对照组以及样品质量浓度为 100 μg/mL 和 200 μg/mL 时Caspase-3 表达差异极显著(P<0.01)。

表2 不同质量浓度花青素对Caspase-3蛋白表达的影响Table 2 Effect of different concentrations of anthocyanins on Caspase-3 protein expression of SPCA-1 cells
由表3可知,经不同质量浓度花青素处理48 h后的SPCA-1细胞内P53质量浓度均比阴性对照组增强,较之阴性对照组,阳性对照组12.5 μg/mL以及花青素质量浓度为50、80 μg/mL时没有表现出显著性差异,但在阳性对照组50 μg/mL、样品质量浓度为100 μg/mL和200 μg/mL时存在极显著差异(P<0.01)。

表3 不同质量浓度花青素对SPCA-1细胞P53蛋白表达的影响Table 3 Effect of different concentrations of anthocyanins on P53 protein expression of SPCA-1 cells
由表4和表5可知,经不同质量浓度花青素处理48 h后的SPCA-1细胞内BAX蛋白质量浓度含量均比阴性对照组增强。较之阴性对照组,阳性对照组50 μg/mL以及花青素质量浓度为100 μg/mL和 200 μg/mL 时均具有极显著性差异(P<0.01)。 与之对应的Bcl-2蛋白质量浓度阳性对照组和实验组对比阴性对照组均表现为下降,同样地,与阴性对照组相比,阳性对照组50 μgmL/及花青素质量浓度为100 μg/mL和200 μg/mL时均具有极显著性差异(P<0.01)。

表4 不同质量浓度花青素对SPCA-1细胞BAX蛋白表达的影响Table 4 Effect of different concentrations of anthocyanins on BAX protein expression of SPCA-1 cells
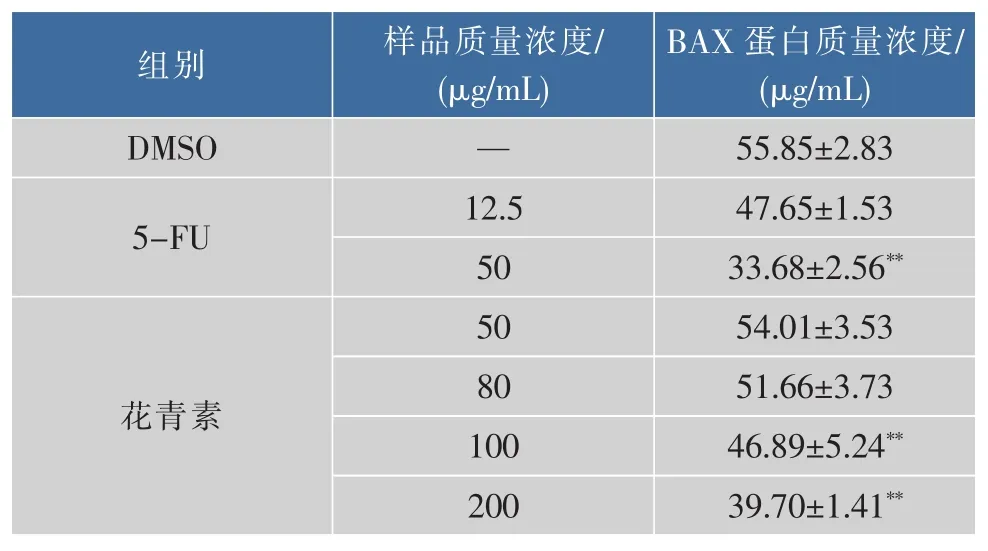
表5 不同质量浓度花青素对Bcl-2蛋白表达的影响Table 5 Effect of different concentrations of anthocyanins on Bcl-2 protein expression of SPCA-1 cells
3 结语
肺癌发病率在国内外仍处于不断上升态势,据统计报道,肺癌一直居于各种肿瘤发病的榜首,关于肺癌研究和治疗技术动态因此备受瞩目。据病理学上分类可以将肺癌细分为鳞状细胞癌、小细胞癌、腺癌、大细胞癌、腺鳞癌等,实验选取的SPCA-1肺腺癌细胞属于人肺腺癌系,人肺腺癌在亚州地区较为常见,也是与吸烟相关的组织类型[16]。本实验研究表明中国野生笃斯越桔花青素对体外SPCA-1细胞活力及增殖有明显的抑制作用,同时进一步研究发现其改变细胞周期,细胞周期阻断在S期,并且有早期凋亡现象的产生。
研究表明,花青素通过作用于周期调控蛋白(P53、BAX、Bcl-2)、 细胞周期蛋白 D1 和细胞周期蛋白A等来阻滞细胞周期的各个阶段,从而发挥抗增殖作用[17],因而提示花青素导致SPCA-1细胞G2/M期比例下降的作用,可能是通过作用于以上调控蛋白来完成的。生物体内存在着一套完善的氧化—抗氧化平衡体系,当平衡打破,ROS持续升高时,将促使细胞发生转化、进而引起细胞的凋亡。本文研究发现花青素能引起肺癌细胞SPCA-1细胞ROS释放量增加,表明青花素的促细胞凋亡作用可能通过引起ROS释放来实现的。
Bcl-2家族包括Bax、Bak等促调亡蛋白,Bcl-2、Bd-xL等抑调亡蛋白,大多数由C端跨膜结构域和Bcl-2同源结构域构成。研究认为Bcl-2蛋白是可以防止ROS对细胞的损伤,而ROS升高会上调Bax蛋白的表迗,从而诱导细胞色素 C的释放,启动调亡[18]。Caspase乃调亡中最重要的酶,ROS通过与它的相互作用,共同调节细胞的凋亡。研究表明ROS的产生需要Caspase的激活,Caspase—旦被抑制,ROS的增加也被阻断[19]。本文研究发现中国野生笃斯越桔花青素在浓度为50~200μg/mL范围内均能使 SPCA-1细胞 Caspase-3、P53、BAX蛋白的表达量有不同程度增加,而Bcl-2的表达量则一定程度下降。
在功能食品开发方面,植物的来源以及活性成分的种类含量一直都是重要的考量标准。除了花青素含量上存在优势以外,实验表明野生笃斯越桔有近13种花色苷单体远高于其他浆果[20]。中国有大面积的野生笃斯越桔得不到充分利用,结合特殊的生物活性,加工成相应的功能食品则具有宽广的应用前景。伴随着花色苷抗肿瘤作用的深入研究以及各类花青素单体之间协同作用机制的进一步清晰,花青素有成为抗肿瘤生物医药的潜力,还兼具了发挥其对人体有利的其他功能特性优势。

