菊芋全粉对刺参生长性能及灿烂弧菌刺激下免疫因子应答变化的影响
贾晨晨,包焕玲,孟现尧,朱晓振,衣悦涛
(1.中国科学院烟台海岸带研究所,山东烟台264003;2.中国科学院大学,北京100049;3.山东东方海洋科技股份有限公司,山东烟台264003)
近年来,我国刺参养殖产业迅速发展。2017年我国刺参总产量达25万吨,是海水养殖业的支柱型产业(姜森颢等,2017)。但由于刺参缺乏特异性免疫,细菌性疾病对刺参危害极大。灿烂弧菌作为一种致病性嗜盐细菌(马爱敏等,2009),是引发刺参腐皮综合征的主要致病菌。刺参感染灿烂弧菌后会造成极高的死亡率,制约了刺参养殖业的健康发展(王印庚等,2004)。
为提高刺参抗病力,除了微生态制剂、中草药成分添加剂改善刺参免疫能力外,利用益生元改善刺参肠道健康也是一种前景良好的新策略(赵倩等,2017;柳序等,2016)。研究证明,益生元能够提高水产动物对营养的利用率,增强新陈代谢,并促进水产动物生长性能,增强其抗病能力(Guer reiro等,2017;Yang等,2016;Torrecillas等,2011),这些研究为益生元在水产养殖中的应用奠定了研究基础。
菊芋全粉微溶于水,制备成本低,其中含50%~60%的菊粉,菊粉作为水溶性益生元,具有调节肠道微生物组成、增强免疫和提高抗病能力等功能。因菊粉使用成本高,水溶性强,因此本试验选用菊芋全粉作为益生元饲料添加剂应用于刺参养殖中,研究其对刺参生长性能、灿烂弧菌刺激下刺参体腔液中相关免疫酶应答变化的影响,以期为菊芋全粉在刺参养殖中的应用及刺参的健康养殖提供理论基础。
1 材料与方法
1.1 试验动物 试验所用刺参由山东东方海洋科技股份有限公司养殖场提供,初始体重为(4.7±0.1)g,将刺参饲养于40 L塑料质水箱中,水温(17±1)℃,pH(8.1±0.2),海水盐度为27‰~29‰,每日投喂1次(16:00)饲料,投喂量为刺参体重的3%,每日采用虹吸法去除残饵及粪便并换水30%。暂养1周后用于试验。
1.2 试验设计 暂养结束后,挑选360只健康刺参,随机分为3组,每组6个平行,每个平行20只刺参,对照组饲喂基础日粮,试验Ⅰ、Ⅱ组分别在基础饲料中添加5 g/kg和15 g/kg菊芋全粉,饲养周期为28 d。日粮组成及营养水平如表1所示。

表1 试验日粮组成及营养水平
1.3 灿烂弧菌感染试验 28 d养殖试验结束后进行感染试验,试验使用的灿烂弧菌经活化后接种于2216E培养液中(梁超,2011),在30℃下培养24 h,调整菌液浓度为109cell/mL,用1 mL无菌注射器经腹腔注射对刺参进行感染,每只注射量为0.1 mL。继续投喂饲料。
1.4 测定指标与方法
1.4.1 生长性能指数测定及分析 试验前将各组刺参称重并计算平均初重W0,分别在饲养试验第28天时,将各组刺参禁食24 h后,称重Wt,日增重(ADG)和饲料利用率(FCR)计算公式如下:
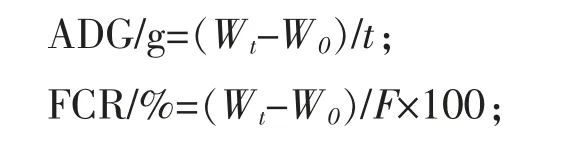
式中:t为饲养试验天数,d;F为刺参总摄食量,g。
1.4.2 免疫因子活力变化的测定 在感染试验后第0、1、2、3、4、5天时分别从每组取出9只健康刺参,在冰盘上取出刺参体腔液,于4℃、3000 r/min离心10 min,取上清液于离心管中,置于-80℃冰箱中保存,用作体腔液免疫指标的测定。
刺参体腔液样品中酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)和超氧化物歧化酶(SOD)活性采用试剂盒(南京建成公司)测定。
1.5 数据处理与分析 数据用SPSS 16.0软件进行单因素方差分析(One-way ANOVA),结果以“平均值±标准差”表示,当P<0.05时为差异显著。
2 结果与分析
2.1 菊芋全粉对刺参生长性能的影响 由表2可知,与对照组相比,试验Ⅰ、Ⅱ组刺参的平均日增重和平均日摄食量差异不显著(P>0.05);试验Ⅱ组刺参的饲料利用率显著高于对照组(P<0.05)。说明15 g/kg菊芋全粉能显著提高刺参的饲料利用率。
2.2 菊芋全粉对灿烂弧菌刺激后刺参免疫因子应答变化的影响
2.2.1 灿烂弧菌刺激后刺参ACP活力变化 测定结果显示,灿烂弧菌刺激后,刺参的ACP活性呈先增加后降低的周期性变化,试验Ⅰ组刺参ACP活力在第3天显著高于对照组,而在第2、第4天却显著低于对照组(P<0.05);试验Ⅱ组刺参的ACP活力在第3天时显著高于对照组(P<0.05),其他时间与对照组无显著差异(图1)。

表2 菊芋全粉对刺参生长性能的影响
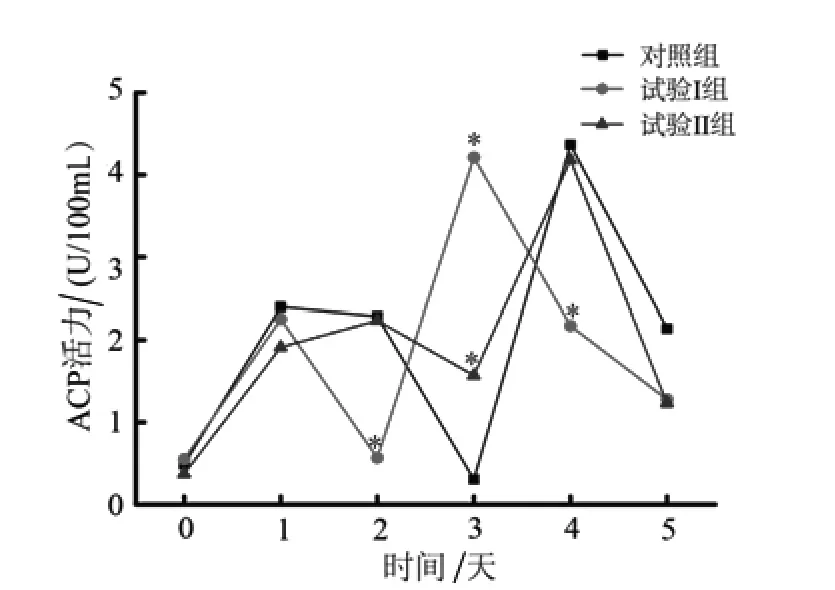
图1 灿烂弧菌刺激后刺参体腔液中ACP活力变化
2.2.2 灿烂弧菌刺激后刺参AKP活力变化 由图2可知,灿烂弧菌刺激后刺参AKP活力急剧增加,但随着时间的延长AKP系统的应答能力逐渐恢复到初始水平。这可能是由于AKP完成了对入侵灿烂弧菌的免疫应答。此外,试验Ⅱ组刺参AKP活力始终显著高于对照组(P<0.05),结果表明在灿烂弧菌感染时,添加15 g/kg菊芋全粉可以显著提高刺参AKP活力。
2.2.3 灿烂弧菌刺激后刺参SOD活力变化 由图3可知,相较于对照组,试验Ⅰ组刺参在细菌感染1 d后SOD活力显著提高(P<0.05),之后下降并逐渐趋于初始水平;试验Ⅱ组刺参在细菌感染第1天和第2天时SOD活力始终显著高于对照组(P<0.05),并从第3天开始逐渐下降至初始水平。结果表明在灿烂弧菌刺激下,15 g/kg菊芋全粉对SOD活力的提高作用更为明显。
2.2.4 灿烂弧菌刺激后刺参LYZ活力变化 如图4所示,灿烂弧菌刺激后第1、2天,试验Ⅱ组与对照组刺参LYZ活力受到抑制,而试验Ⅰ组刺参LYZ活力显著升高(P<0.05),并在第4天时恢复到初始水平。结果表明灿烂弧菌会抑制刺参的溶菌应答反应,饲料中添加5 g/kg菊芋全粉可显著改善这种抑制。
3 讨论
3.1 菊芋全粉对刺参生长性能的影响 关于益生元对水产动物生长性能的影响报道不一,有研究认为并无显著效果,也有研究证明益生元可改善水产动物的生长性能(Guerreiro等,2015;孙永欣等,2012;Ringo等,2010),这可能与益生元的种类、添加量及水产动物的种类、年龄、养殖方式等均有关系。本研究采用菊芋全粉作为益生元饲料添加剂,试验结果表明,饲料中添加15 g/kg菊芋全粉可显著提高刺参的饲料利用率,其原因可能是菊芋全粉会影响刺参肠道结构或者消化酶活性,进而促进刺参的生长,提高其对饲料中营养物质的利用率,这与Abdelmalek等(2015)对海鲈鱼的研究结果一致。本研究中菊芋全粉对刺参的ADG影响不大,可能是试验周期短,其中机理仍需进一步研究。
3.2 菊芋全粉对灿烂弧菌刺激后刺参免疫因子应答变化的影响 灿烂弧菌作为刺参腐皮病的主要病原菌,制约着刺参养殖业的健康发展。益生元作为功能性成分,可以改善水产动物肠道健康,进而增强机体免疫力。因此本研究将菊芋全粉作为益生元饲料添加剂应用于刺参饲料中,研究其对灿烂弧菌刺激后刺参体腔液内免疫因子如ACP、AKP、SOD及LYZ活力变化的影响。其中ACP是巨噬细胞溶酶体的标志酶,可吞噬消化颗粒形异物(Meng等,2003)。本研究结果显示灿烂弧菌感染时,ACP可有效应答弧菌入侵,其活力呈现先增加后降低的周期性变化,这可能是由于ACP大量参与对弧菌的反应,使得ACP活力提高,随后由于ACP大量消耗造成ACP活力暂时性下降,研究结果表明,15 g/kg菊芋全粉可抑制ACP活力降低的程度。AKP是一种对底物专一性要求较低的磷酸单脂水解酶,是重要的解毒系统,并与一些营养物质的消化吸收有关(Zhang等,2000)。研究结果表明,15 g/kg菊芋全粉可显著提高细菌感染时刺参AKP活力,刘云等(2008)用海藻硫酸多糖与壳聚糖喂养刺参,也得到了类似结果。SOD作为一种重要的抗氧化酶,主要参与清除体内过量的自由基,同时在机体清除病原菌过程中增强自我防御功能,因此SOD活力是反映机体免疫力的重要指标(董晓亮等,2013),本研究结果表明灿烂弧菌刺激后,刺参SOD活力呈现先升高后逐渐恢复至初始水平的趋势,其中菊芋全粉添加量为15 g/kg时效果最佳,该结果与贻贝(Mytilus edulis)(Tanguy等,2013)的结果不同,灿烂弧菌并没有抑制SOD系统的应答能力,这可能与动物种类、年龄有关。LYZ通过水解革兰氏阳性菌细胞壁中的乙酰氨基多糖,可破坏和消除入侵异物,从而起到杀菌防御功能(王淑娴等,2010)。研究结果表明,灿烂弧菌入侵初期,对照组刺参LYZ活力受到抑制,这与丛聪(2015)的研究结果一致,但5 g/kg菊芋全粉组刺参LYZ活力却显著增强,这表明5 g/kg菊芋全粉在灿烂弧菌感染初期可显著提高LYZ活力。

图2 灿烂弧菌刺激后刺参体腔液中AKP活力变化
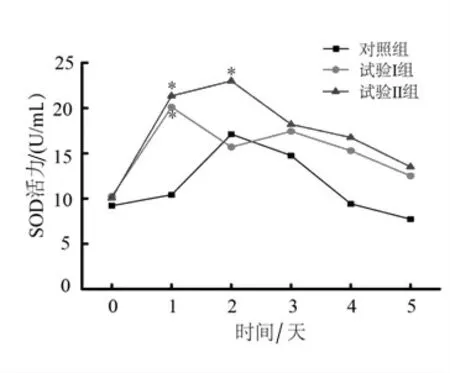
图3 灿烂弧菌刺激后刺参体腔液中SOD活力变化
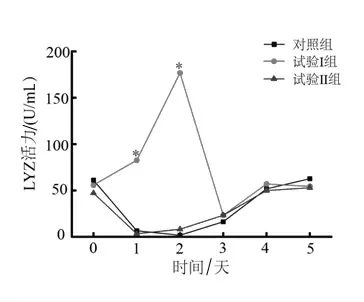
图4 灿烂弧菌刺激后刺参体腔液中LYZ活力变化
4 结论
日粮中添加15 g/kg菊芋全粉可显著提高刺参的饲料利用率;灿烂弧菌刺激时能有效地提高刺参体液中ACP、AKP、SOD活力,而5 g/kg菊芋全粉可显著提高灿烂弧菌诱导时刺参LYZ活力;综上,本试验条件下菊芋全粉的添加量为15 g/kg时,刺参的免疫因子活力提高效果显著,因此菊芋全粉具备作为刺参免疫增强剂的潜在应用价值。

