铬天青S法结合高效液相色谱法测定甲烷氧化菌素含量
陈林林,韩 可,李 伟,吴嘉树,辛嘉英,2
(1.哈尔滨商业大学省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076; 2.中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室,甘肃兰州 730000)
甲烷氧化菌是一类可以直接以甲烷作为碳源和能源进行生长的革兰氏阴性细菌[1],对温室效应起到了有效的抑制作用[2]。甲烷氧化菌素(methanobactin,Mb)是一种小分子的荧光肽,在细胞外能以分泌物的形式存在,在细胞内参与颗粒性甲烷单加氧酶(MMO)的组成,并且存在于细胞内膜上[3]。Mb与铜结合后所形成的物质会影响MMO的活性[4],MMO作为甲烷氧化菌的典型特征代谢产物,能将甲烷催化氧化为甲醇[5]。Mb与铜的结合物Mb-Cu具有超氧化物歧化酶(superoxide dismutase,SOD)的活性[6-7],Mb不仅能清除超氧阴离子,而且能够清除羟自由基,可以应用于延缓衰老的功能性食品或化妆品当中,作为抗氧化剂也具有一定的应用前景。
由于Mb发酵时间较长,且甲烷氧化菌在发酵过程中由于发酵条件的限制产生的Mb含量较低。因此为了获得纯度高、成熟的Mb,需要在发酵过程中实现对Mb含量的监控以及对发酵成熟的Mb进行检测。Mb含量的检测方法有分光光度法、紫外光谱法、荧光法以及高效液相色谱法等[8]。利用紫外检测定量Mb会有很大的误差,因为甲烷氧化菌在发酵的过程中会向菌液释放很多有紫外吸收的小肽,对检测结果有影响。国外曾有利用铬天青(CAS)法琼脂平板检测甲烷氧化菌产Mb的例子[9-10],利用CAS法,通过颜色变化更直接地进行检测。
利用高效液相色谱法(HPLC)对M.trichosporiumOB3b代谢的Mb每24 h含量进行测定,确定M.trichosporiumOB3b分泌Mb的日变化趋势,但是却无法验证Mb的成熟程度。铬天青法可以通过咪唑基团与Cu的结合产生颜色的变化,从而检测Mb发酵的程度以及含量。本文通过紫外光谱对Mb在CAS体系中发生的光谱变化,作为分析利用CAS法检测Mb的测定依据,并通过优化后的CAS法检测M.trichosporiumOB3b发酵液当中的Mb含量。既实现了对Mb的实时监测,又可以更准确直接地检测Mb,为Mb通过发酵法富集和应用的研究提供数据支持。
1 材料与方法
1.1 材料与仪器
甲基弯菌(M.trichosporiumOB3b) 俄罗斯科学院催化研究所;铬天青S、十六烷基三甲基溴化铵(HDTMA) 天津市光复精细化工研究所;乙二胺四乙酸、磷酸二氢钾、磷酸氢二钾、磷酸氢二钠、无水乙醇、甲醇 天津市天力化学试剂有限公司;HP-20大孔吸附树脂 日本三菱化学公司。
BSA224S电子天平 赛多利斯科学仪器(北京)有限公司;DHG-9203A型电热恒温鼓风干燥箱、R-20旋转蒸发仪 上海一恒科学仪器有限公司;HDL洁净工作台 北京东联哈尔仪器制造有限公司;YY-15-2PF2 单相电容运转电动机 上海申胜生物技术有限公司;U3000高效液相色谱仪 Themo仪器有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;HNY-100B恒温培养振荡器 天津市欧诺仪器仪表有限公司;TGL-16高速台式离心机 上海医疗器械六厂;2-16K冷冻离心机、Z-16K冷冻离心机 Sigma公司;UV-2550紫外-可见分光光度计 日本岛津;F-7000FL220-240V荧光光谱仪 Watter公司;UV-2550组合式紫外检测器 上海金达生化仪器有限公司;HL-2S恒流泵 上海沪西分析仪器厂有限公司;Ulti Mate3000高效液相色谱仪 赛默飞世尔仪器有限公司。
1.2 实验方法
1.2.1 Mb的培养以及分离纯化 根据文献[11]按照OB3b菌种培养基配制方法,配制1 L培养基置于发酵罐中,以甲烷为碳源,培养周期为24 h。培养周期结束后对Mb进行分离纯化。通过冷冻干燥后,得到Mb的冻干粉。
1.2.2 光谱分析Mb及CAS法测定的依据
1.2.2.1 紫外光谱分析Mb发酵程度 取1.2.1纯化后的Mb利用紫外-可见分光光度计在200~700 nm之间进行扫描,通过Mb在紫外中的特征峰判定Mb的成熟程度,以确定发酵成熟后Mb可利用CAS法测定的依据。在此基础上可以测定分离纯化后Mb冻干粉的纯度,进一步作为HPLC定量的依据,从而实现发酵前4 d Mb含量的测定。
1.2.2.2 排除其他小肽对检测方法的影响 将纯化到的Mb干粉,取2.5 mg利用蒸馏水定容至5 mL制成样液。取2个25 mL的容量瓶,分别向其中加入2.0 mL 0.02 mmoL/L CAS 溶液、4.0 mL 0.02 mmoL/L HDTMA溶液及2.0 mL磷酸缓冲溶液(0.4 g/L K2HPO4、0.262 g/L KH2PO4、0.74 g/L Na2HPO4),向其中一个容量瓶中加入1 mL的Mb样液。摇匀定容,15 min后用1 cm比色皿,在200~700 nm波长范围内进行紫外扫描,得二者的紫外吸收光谱图进行分析对比。
1.2.2.3 Mb与Mb-Cu紫外光谱检测 在比色皿中加入2 mL浓度为5×10-4moL/L的Mb溶液,使用5 μL微量进样器向其中逐渐注入0.1 moL/L的CuSO4溶液,利用紫外-可见分光光度计观察Cu加入后Mb的紫外光谱变化。
1.2.2.4 Mb夺取CAS体系中Cu2+的证明 将纯化到的Mb干粉,取2.5 mg定容至5 mL制成样液。取4个25 mL的容量瓶,分别用移液管移取2.0、2.0、1.2、4.0、1.0、1.0 mL的磷酸缓冲溶液、0.02 mmoL/L 的CAS、CuSO4、HDTMA溶液、0.01 moL/L EDTA溶液及Mb样液,按CAS+HDTMA、CAS+HDTMA+CuSO4、CAS+HDTMA+CuSO4+EDTA、CAS+HDTMA+CuSO4+Mb的组合方式在四个瓶中加入溶液,摇匀定容,15 min后分别在200~700 nm波长范围内进行紫外扫描,得四者的紫外吸收光谱图进行分析对比。
1.2.3 CAS法检测条件的确定 取数个25 mL容量瓶,加入2 mL的0.02 mmoL/L CAS溶液,不同体积的0.02 mmoL/L CuSO4溶液、0.02 mmoL/L HDTMA溶液以及磷酸缓冲溶液,摇匀定容,静置几分钟后,以蒸馏水作空白,在607 nm下测定吸光值。每组平行测3次,取平均值绘制曲线。分别考察反应条件为CAS溶液2.0 mL、HDTMA溶液4.0 mL、磷酸缓冲溶液0.5 mL、反应时间15 min时,CuSO4溶液添加量(0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL)对CAS络合体系的影响;反应条件为CAS溶液2.0 mL、CuSO4溶液1.2 mL、磷酸缓冲溶液0.5 mL、反应时间15 min时,HDTMA溶液添加量(1.0、2.0、3.0、4.0、5.0、6.0 mL)对CAS络合体系的影响;反应条件为CAS溶液2.0 mL、CuSO4溶液1.2 mL、HDTMA 4.0 mL、反应时间15 min时,磷酸缓冲液添加量(0.5、1.0、1.5、2.0、2.5、3.0 mL)对CAS络合体系的影响;以及反应条件为CAS溶液2.0 mL、CuSO4溶液1.2 mL、HDTMA溶液4.0 mL、磷酸缓冲溶液2.0 mL时,络合时间(5、10、15、20、25、30 min)对CAS络合体系的影响。
1.2.4 CAS法检测Mb含量
1.2.4.1 Mb含量的测定 取7支试管并进行编号,按CAS:HDTMA:CuSO4体积比为1.0∶8.0∶0.7的比例配制100 mL C液,分别向试管中加入9 mL C液及1 mL 1.2.1中的冻干粉溶液和蒸馏水混合液,其冻干粉溶液的添加量依次为0.0、0.2、0.3、0.5、0.7、0.9、1.0 mL,以1号为空白在607 nm波长下测定吸光值,每组平行测3次,取平均值绘制曲线。通过在含有2.0 mL 0.02 mmoL/L CAS溶液、1.2 mL 0.02 mmoL/L CuSO4溶液、4.0 mL 0.02 mmoL/L HDTMA溶液、2.0 mL磷酸缓冲溶液的反应体系中,依次加入不同体积的0.01 moL/L EDTA溶液,于607 nm紫外吸收波长下测得的吸光值[12]。此操作平行3次,计算平均值。
1.2.4.2 Mb含量的计算 取8个25 mL容量瓶,分别用移液管移取2.0 mL 0.02 mmoL/L CAS溶液、1.2 mL 0.02 mmoL/L CuSO4溶液、4.0 mL 0.02 mmoL/L HDTMA溶液、2.0 mL磷酸缓冲溶液置于容量瓶中,然后依次加入0.0、0.3、0.6、0.9、1.2、1.5、1.8、2.0 mL的0.01 moL/L EDTA溶液,摇匀定容,静置15 min后,以蒸馏水作空白,在607 nm下测定吸光值。平行测3次,取平均值绘制EDTA工作曲线,根据EDTA工作曲线y=-0.0447x+0.0738,r=0.9895,求出Mb对EDTA的当量浓度(μmoL·mL-1),由公式[13-16]求出1 L发酵液中的Mb含量。Mb含量计算公式为:
Mb含量(μmoL/250 mL)=EDTA当量浓度×25×2.5
1.2.5 HPLC法检测Mb含量
1.2.5.1 HPLC法的检测条件 色谱柱:C18XDB(4.6 mm×150 mm,5 μm);检测器:二极管阵列检测器;柱温:30 ℃;流速:0.4 mL/min;流动相:A为去离子水,B为100%乙腈;采用梯度洗脱,0~2 min 100%~88% A、2~5 min 88%~75% A、5~11 min 75%~68% A、11~15 min 68%~50% A、15~25 min 50%~0% A运行25 min;进样量10 μL。
1.2.5.2 HPLC法检测Mb含量 取10 μL发酵液纯化获得Mb干粉样液于高效液相色谱仪中检测,结合三维液相色谱图与紫外光谱图确定Mb的出峰位置。取0.5 mg的OB3b Mb冻干粉加入蒸馏水配成1 mL干粉溶液,在高效液相色谱仪中进样1 μL浓度分别为2.5×10-3、5×10-3、7.5×10-3、1×10-2、1.25×10-2、1.5×10-2g/mL的冻干粉溶液进行检测,得到不同含量Mb的液相色谱图,获得相应保留时间内各Mb含量对应的峰面积,绘制出峰面积与Mb含量的标准曲线。每24 h对发酵液进行提取,于高效液相色谱仪下进行检测,得到不同时间段下的Mb液相分析图后,利用线性关系,得到相应的Mb含量,考察M.trichosporiumOB3b代谢Mb的日含量变化情况。
2 结果与分析
2.1 光谱分析Mb及CAS法测定的依据
2.1.1 紫外光谱分析Mb发酵程度 对发酵过程中的Mb每24 h进行分离纯化提取,以蒸馏水为空白,在200~700 nm波长下扫描的紫外吸收光谱如图1所示。由图1可知,发酵24 h的Mb只在290 nm处有一个特征峰;发酵48 h在290 nm处有一个特征峰;发酵72 h在290、340 nm处有两个特征峰;发酵96 h在290、340、390 nm有三个特征峰;发酵120 h在290、340、390 nm有三个特征峰。根据文献[11]可知与Cu2+结合的咪唑基团在340、390 nm处产生。由此可见Mb只有发酵72 h后才有与Cu结合的咪唑基团,发酵96 h后的Mb较为成熟。

图1 Mb紫外光谱图Fig.1 Mb ultraviolet spectrum
2.1.2 排除其他小肽对检测方法的影响 由图2可知,两种混合体系在400 nm以后几乎是重合的,在不加 CuSO4的情况下,加Mb体系与不加Mb体系在607 nm处均无特征吸收峰,说明MethylosinustrichosporiumOB3b向发酵液中分泌的多种小肽并不会影响Mb的紫外检测结果,故排除发酵液中杂蛋白的干扰。
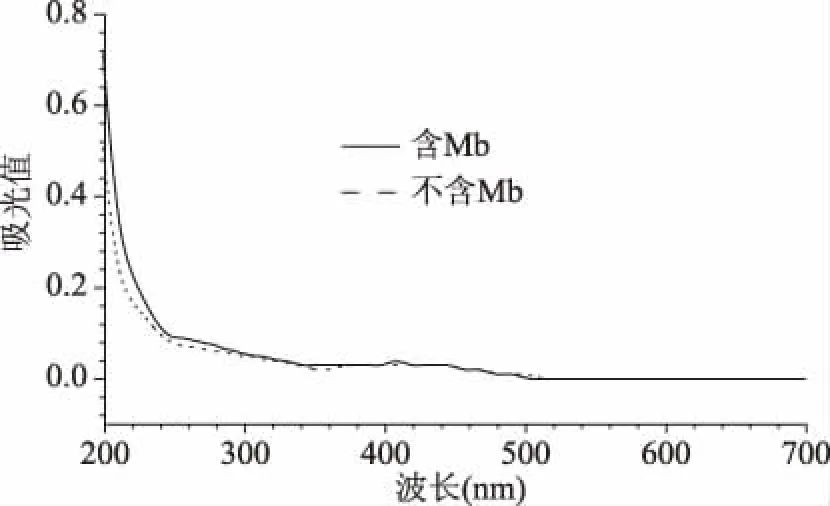
图2 无铜CAS体系添加Mb的紫外光谱Fig.2 UV spectrum of Mb added to copper-free CAS system
2.1.3 Mb紫外光谱的检测 由图3可以看出,Mb紫外-可见光谱图中有三处吸收峰,分别为290、340、394 nm,这与文献报道的Mb的结构[17]一致。当加入Cu2+后,340 nm的4-羟基-5-亚硫酰咪唑基团以及394 nm的硫酰咪唑基团的特征峰均下降,表明纯化后的Mb具有4-羟基-5-亚硫酰咪唑基团和硫酰咪唑基团,且Cu2+与Mb的咪唑酮环发生了配位结合。

图3 Mb及Mb-Cu紫外光谱Fig.3 UV spectrum of Mb and Mb-Cu
2.1.4 Mb夺取CAS体系中Cu2+的证明 CAS+HDTMA、CAS+HDTMA+CuSO4、CAS+HDTMA+CuSO4+EDTA、CAS+HDTMA+CuSO4+Mb四种组合方式的混合体系在200~700 nm波长下扫描得到的紫外吸收光谱结果如图4所示。由图4可知,CAS溶液与CuSO4溶液形成的络合体系在加入Mb和EDTA后,607 nm附近的吸收峰均有所降低,表明Mb与EDTA相同,均能够夺取络合物CAS-Cu中的Cu2+,从而具有降低特征吸收峰的作用[18]。因此利用铬天青法检测Mb含量可行。
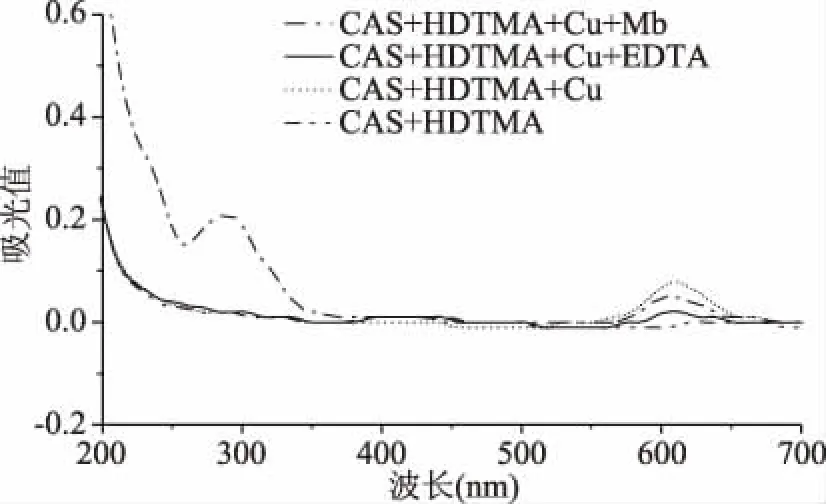
图4 四种反应体系的紫外光谱Fig.4 UV spectrum of four reaction systems
2.2 CAS法检测条件的优化
2.2.1 CuSO4溶液添加量对CAS体系的影响 由图5可知,络合体系的吸光值会随着CuSO4溶液的添加量逐渐增加,一定量后达到最大值。在0~1.2 mL时络合体系的吸光值逐渐上升。当CuSO4的添加量为1.2 mL时,吸光度达到最大值,说明体系中有足够的Cu2+发生反应。继续添加CuSO4溶液,吸光度呈下降趋势,使得溶液中含有多余游离Cu2+而不利于工作曲线及Mb的测定。因此选取CuSO4溶液的添加量为1.2 mL。

图5 CuSO4溶液添加量对CAS体系的影响Fig.5 Effect of addition of CuSO4 solution on CAS system
2.2.2 HDTMA溶液添加量对CAS体系的影响 由图6可知,随着HDTMA由1 mL增加至4 mL时,络合体系的吸光值上升明显,而当HDTMA添加量高于4.0 mL后,吸光值趋于稳定,这表明HDTMA溶液添加量为4.0 mL时,对整个体系的增色效果达到最大。因此选取HDTMA溶液的添加量为4 mL。
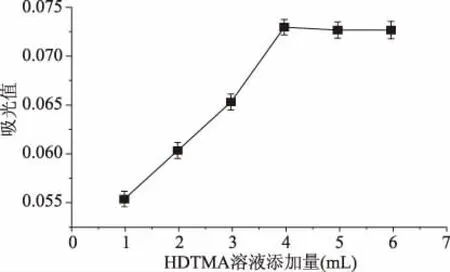
图6 HDTMA溶液添加量CAS体系的影响Fig.6 Effect of addition of HDTMA solution on CAS system
2.2.3 磷酸缓冲溶液添加量对CAS体系的影响 由图7可知,添加不同体积的磷酸缓冲溶液,其络合体系对应的吸光度值接近,表明磷酸缓冲液对于反应体系影响不明显。在0~2 mL时,络合体系的吸光值有小幅度的上升,当添加量超过2.0 mL时,吸光值趋于平稳,这表明磷酸缓冲溶液添加量为2.0 mL时,络合体系的稳定性较好。因此选取磷酸缓冲溶液的添加量为2.0 mL。
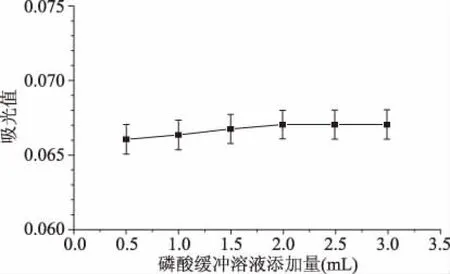
图7 磷酸缓冲溶液添加量对CAS体系的影响Fig.7 Effect of addition of phosphate buffer solution on CAS system
2.2.4 络合时间对CAS体系的影响 由图8所示,CAS与CuSO4络合时间在0~15 min波动明显。当络合体系形成时间大于15 min时,体系吸光度稍有下降并处于稳定,表明络合时间为15 min时反应完全,络合体系达到稳定。因此选取反应时间为15 min。
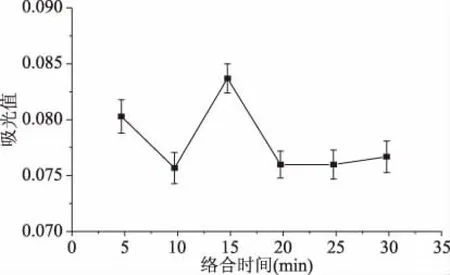
图8 络合时间对CAS体系的影响 Fig.8 Effect of complexation time on CAS system
2.3 CAS法对Mb含量的检测结果
2.3.1 CAS法对Mb含量线性关系的测定 按0.1 mmol/L CAS:0.1 mmol/L HDTMA:0.1 mmol/L CuSO4体积比为1.0∶8.0∶0.7的比例配成CAS络合体系,加入不同浓度的Mb冻干粉溶液后,在607 nm吸收波长下测得的吸光值如图9所示。
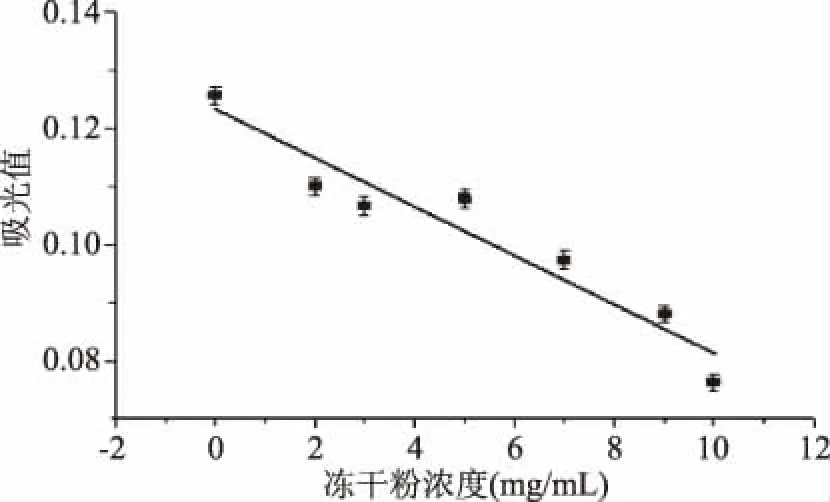
图9 Mb含量与吸光值的线性关系 Fig.9 Linear relationship between Mb content and absorbance
从图9可以看出,在含有Mb的CAS-Cu络合体系中,Mb的浓度与反应体系的吸光度同EDTA与吸光度的关系(y=-0.0447x+0.0738,r=0.9895)相似,均呈线性关系,且其线性方程为y=-0.0042x+0.1232,其中r值为0.9495,线性关系可靠。因此可通过EDTA的工作曲线求得Mb的EDTA当量浓度,进而求得发酵液中的Mb含量。
2.3.2 CAS法对发酵液中Mb含量的测定 将2.0 mL发酵液纯化的Mb样液加入到由2.0 mL 0.02 mmoL/L CAS溶液、1.2 mL 0.02 mmoL/L CuSO4溶液、4.0 mL 0.02 mmoL/L HDTMA溶液、2.0 mL磷酸缓冲溶液配成的络合体系中,静置15 min后于607 nm波长下测得吸光值,此操作平行3次,求出的Mb含量如表1所示。表1表明 OB3b 1 L发酵液当中Mb的含量为26.91 μmoL,并且其相对标准偏差(RSD)小于5%,重现性较好。

表1 Mb含量测定结果Table 1 Determination results of Mb content
2.3.3 Mb含量最低检测限的测定 将1 mL的Mb样液稀释后,加入到由2.0 mL 0.1 mmoL/L CAS溶液、1.2 mL 0.02 mmoL/L CuSO4溶液、4.0 mL 0.1 mmoL/L HDTMA溶液、2.0 mL磷酸缓冲溶液配成的络合体系中,静置15 min后于607 nm波长下测得吸光值,此操作平行3次,求出Mb含量如表2所示。由表2可知,通过CAS法检测OB3b 1 L发酵液当中Mb最低含量为稀释50倍后的浓度值,最低检测限为0.042 μmoL/L,并且其相对标准偏差(RSD)小于5%,重现性较好。

表2 Mb含量最低检测限Table 2 Minimum detection limit of Mb
2.4 HPLC法对Mb含量的检测结果
2.4.1 HPLC法检测Mb的定性分析 10 μL发酵液纯化的Mb样液的高效液相色谱图及3D液相色谱图如图10、图11所示。由图10可以看出,在保留时间为10.843 min出现的吸收峰与在图11在同一保留时间出峰位置相对应,说明为同一种物质,且由图11中可以看出,保留时间为10.843 min出现的吸收峰分别出现在275、340、394 nm,再结合2.1.3中的紫外光谱图当中Mb的特征峰出峰位置,分析证实保留时间10.843 min处的吸收峰为Mb。
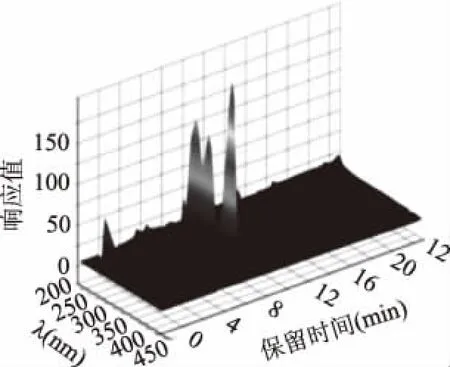
图11 Mb三维液相色谱图Fig.11 Mb three-dimensional liquid chromatogram

图10 Mb高效液相色谱图Fig.10 High performance liquid chromatogram of Mb
2.4.2 HPLC检测Mb的定量分析 将经CAS法检测获得Mb含量为83.33 μmoL的冻干粉制成1 mL干粉溶液,在高效液相色谱仪中进样1 μL浓度分别为2.5×10-3、5×10-3、7.5×10-3、1×10-2、1.25×10-2、1.5×10-2g/mL进行检测,检测绘制出的峰面积与Mb含量的线性关系曲线,线性方程为y=10.5251x+4.4038,r值为0.9998,线性关系可靠。
将20 μL 24 h间隔下取出的250 mL发酵液的Mb样液于高效液相色谱仪下进行检测,得到不同时间段下Mb保留时间内的峰面积,将其代入到峰面积与Mb含量的线性关系中,得到发酵液中的Mb日含量如表3所示。由表3可知,24、48 h下测得的Mb含量为1.008、1.336 μmoL·250 mL-1,表明在培养前期,MethylosinustrichosporiumOB3b分泌出的Mb含量极低;72~96 h时间段内,得到250 mL发酵液当中的Mb含量分别为3.125、7.500 μmoL,OB3b培养后期分泌的Mb含量明显增加,每个时间段样品重复测定3次,由标准差SD和RSD的结果分析可知,重现性良好。

表3 甲烷氧化菌不同培养时间段下分泌的Mb含量Table 3 Mb content secreted by methane oxidizing bacteria at different culture time
3 结论
通过对MethylosinustrichosporiumOB3b的Mb的紫外光谱图与三维液相色谱图的结合分析,证明发酵液中Mb具有硫酰咪唑基团及酪氨酸活性基团,并结合色谱分析时的出峰位置获得了利用CAS方法结合HPLC方法测定Mb的依据。通过优化后的CAS分光光度法(各试剂的添加量为0.02 mmoL/L CAS溶液2.0 mL、0.02 mmoL/L CuSO4溶液1.2 mL、0.02 mmoL/L HDTMA溶液的添加量4.0 mL、磷酸缓冲液2.0 mL、络合时间为15 min)测定了1 L发酵液当中Mb的含量为26.91 μmoL;通过CAS法检测OB3b 1 L发酵液当中Mb最低含量为稀释50倍后的浓度值,最低检测限为0.042 μmoL/L,重现性较好。在此基础上结合HPLC法实现了对发酵液中Mb含量的周期监测,在发酵24、48、72、96 h时发酵液中Mb含量分别为1.008、1.336、3.125、7.500 μmoL/250 mL。本文对前人所述方法进行了进一步的改进,精密度和方法的稳定性都有所提高,为Mb的发酵、生产和应用提供依据。

