核桃多酚与蛋白质的作用方式及其抗氧化活性
吕丹丹,毛晓英
(石河子大学食品学院,新疆石河子 832000)
核桃具有丰富的营养价值和生理活性,位列世界四大坚果之首[1],在坚果类食物中深受人们的喜爱。核桃仁蛋白质含量达8%~24%,并含有18种氨基酸,其必需氨基酸种类、含量与人体所需相近,营养物质丰富且含量均衡,是一种对人体有益的优质植物蛋白资源[2-3]。在核桃果仁中除了含有丰富的蛋白质外,还含有1.85%~2.75%的多酚[4]。Yang等[5]研究结果表明,北美地区的9种主食坚果中核桃果仁的总酚含量最高。流畅等[6]证实核桃在15种富含油脂的天然类食品中多酚含量最高。植物多酚是植物体中相对分子质量在500~3000范围内的具有多元酚结构的重要次生代谢产物。核桃多酚主要包括酚酸类、黄酮类、缩合单宁和水解单宁[7]。
在食品生产加工等环节中,蛋白质等生物大分子都不可避免地受到来自多酚物质的影响。多酚因含酚羟基的化学结构,蛋白质分子由于存在多种不同功能的基团,使得多酚与蛋白质之间通过非共价作用包括氢键、离子键、疏水相互作用等这些相对较弱的作用类型相结合。共价作用主要是在碱性有氧环境下酚类化合物氧化形成相应的醌类,进而与蛋白质链中的氨基酸残基反应[8-10],共价键理论是多酚与蛋白相互作用研究过程中提出的一种成键理论,对籼稻谷壳[11]、油菜籽[12]和啤酒[13]等中通过碱水解得到的结合酚已有研究,但对于核桃中共价结合酚的研究未见报导。
本文旨在通过不同浓度的氯化钠和尿素破坏核桃多酚和核桃蛋白间的作用力,研究核桃多酚与核桃蛋白间的结合机制。由于植物多酚的邻位酚羟基极易被氧化,且对自由基有较强的捕捉能力,使植物多酚具有很强的抗氧化活性[14]。因此,本文通过测定不同结合方式多酚的抗氧化活性,以期确定主要行使抗氧化功能的多酚种类。
1 材料与方法
1.1 材料与仪器
和田产薄皮核桃 新疆石河子市农贸市场;福林酚(2 mol/L) 北京生物科技股份有限公司;DPPH(纯度98%)、菲咯嗪-钠盐(纯度97%) 均出自上海源叶生物科技有限公司;10 kDa超滤膜 上海斯信生物科技有限公司;其它试剂 均为国产分析纯。
752型紫外可见分光光度计 上海光谱仪器有限公司;PHS-3C雷磁pH计 上海仪电科学仪器股份有限公司;Millipore 8050型超滤杯 上海摩速科学器材有限公司。
1.2 实验方法
1.2.1 样品的制备
1.2.1.1 核桃脱脂粉的制备 采用毛晓英[15]的方法略做改动。以和田薄皮核桃为原料,将去壳的核桃仁(不去内种皮)粉碎后,采用正己烷以1∶5 (w/v)的料液比浸提脱脂1 h后抽滤,采用相同方法对滤渣进行二次脱脂,滤液为无色透明时脱脂结束,收集滤渣,置于通风厨内挥干溶剂。将滤渣用粉碎机粉碎后过150目筛,即为核桃脱脂粉,置于冰箱4 ℃冷藏备用。
1.2.1.2 碱提酸沉法制备核桃蛋白 采用毛晓英[15]的方法略改,制备碱提(pH11)蛋白:依据蛋白碱溶酸沉原理,取核桃脱脂粉3 g,加入去离子水按照1∶26 (w/v)的料液比溶解,用2 mol/L的NaOH调节溶液的pH为11,室温下磁力搅拌30 min,以4000×g离心25 min,取上清液(上清液实际颜色为棕色且并不澄清)即为碱提(pH11)蛋白溶液。
制备酸提(pH3.5)蛋白:依据蛋白碱溶酸沉原理,将上述碱提(pH11)蛋白溶液用2 mol/L的HCl调节溶液pH为3.5,于室温下磁力搅拌30 min,以4000×g离心25 min,沉淀即为酸提(pH3.5)蛋白。
1.2.1.3 不同结合组分多酚制备 采用Su[16]和Xu[12]等的方法略作修改,从核桃蛋白中提取不同结合方式的核桃多酚。取上述碱提(pH11)蛋白溶液50 mL,加入250 mL去离子水进行超滤(超滤膜截留分子量10 kDa),透过膜的部分(P)为游离态酚,截留下来的部分(R)作为后续研究多酚与蛋白结合机制的样品。用250 mL 0.05 mol/L NaCl释放离子结合多酚,采用超滤的方法进行分离。用0.05 mol/L NaCl+1.5 mol/L尿素共250 mL加入到上一步截留的蛋白溶液中,释放氢键结合态多酚,采用超滤的方法进行分离。用0.05 mol/L NaCl+8 mol/L尿素共250 mL加入到上一步截留的蛋白溶液,释放疏水相互作用结合的多酚,采用超滤进行分离。
释放核桃蛋白共价结合的多酚采用以下方法:向上述超滤截留的蛋白溶液中添加4 mol/L NaOH溶液70 ℃碱水解12 h,然后采用超滤进行分离,将截留下来的蛋白溶液(此时的蛋白溶液经碱水解超滤后残渣极少)添加0.05 mol/L NaCl+8 mol/L尿素共250 mL,然后采用超滤分离,合并两次滤液,即得共价结合态多酚。将各步骤收集到的多酚溶液调pH至7,装入不同棕色试剂瓶中,标记并密封,于4 ℃冷藏备用。不同浓度氯化钠和尿素溶液由图1依次加入蛋白溶液后在室温下磁力搅拌1 h,用氮气加压在0.15 MPa条件下进行超滤。取酸提(pH3.5)蛋白,重复上述操作步骤,由于蛋白的酸沉特性,为防止超滤膜堵塞,实验过程采用3000 r/min离心,将沉淀与超滤后的滞留液合并,作为下一步多酚提取的样液。

图1 pH3.5和pH11条件下不同结合方式多酚提取流程图Fig.1 Flow chart of the extraction of different combinations of polyphenols at pH3.5 and pH11注:UF、R和P分别代表超滤、滞留和渗透。
1.2.2 多酚含量测定 采用蒲成伟等[17]的方法略改。准确吸取浓度为0.025 mg/mL的没食子酸标准溶液0.25、0.5、0.75、1.0、1.25、1.5、1.75、2.0、2.25、2.5 mL至10 mL棕色容量瓶中,分别添加250 μL的福林酚溶液,避光反应6 min,再向其中加入7% Na2CO3溶液2.5 mL,用蒸馏水定容至10 mL,摇匀避光反应90 min后,在波长为765 nm处测定吸光度,根据所得数值绘制标准曲线,得回归方程。
取2 mL酚样(pH3.5和11条件下所得10个多酚样品)至10 mL 棕色容量瓶中,依次加入上述溶液,相同条件下测定吸光度。根据回归方程和所测定的结果,计算得出样品溶液中多酚含量。

式中:C:根据标准曲线,样品的吸光度所对应的标准品浓度,μg/mL;M:样品的质量,g;V1:样品提取总体积,mL;V2:分析时用样品体积,mL;10:稀释倍数。
1.2.3 抗氧化性测定 取20 mL酚样(pH3.5和pH11条件下所得10个多酚样品)至100 mL容量瓶定容,即稀释5倍。
1.2.3.1 DPPH自由基清除能力 采用Zhang[18]等人的方法。取2 mL酚样(上述条件下,稀释5倍后酚样,1.2.3.2~1.2.3.4同),加入2mL 62.5 μg/mL DPPH-乙醇(无水乙醇)溶液,摇匀避光静置30 min,在波长为517 nm处测定吸光度。
式中:A0:空白对照组吸光度值,Ai:样品组吸光度值,Ai0:样品空白对照组吸光度值。
1.2.3.2 Fe2+螯合能力 采用Karama[19]的方法略改。取2 mL酚样,加入100 μL 5 mmol/L FeSO4,2 mL蒸馏水和100 μL 5 mmol/L菲咯嗪,混匀后静置10 min,在波长为562 nm处测定样品吸光度As。用2 mL蒸馏水代替样品作空白对照Ac。

1.2.3.3 还原能力的测定 采用李笑笑[20]的方法略改。取2 mL酚样,加入2 mL 0.2 mol/L pH6.6 的磷酸盐缓冲溶液、2 mL 1%铁氰化钾,混匀后50 ℃水浴20 min,取出待测样,加入2 mL 10%三氯乙酸,将得到的反应混合液于3000 r/min离心10 min,取上清液4 mL,加入4 mL蒸馏水和 0.8 mL 0.1%三氯化铁,振荡混合均匀,在波长为700 nm处测定其吸光度。
1.2.3.4 脂质过氧化抑制能力测定 采用代沙[21]的方法略改。取1 mL LLS(取1 g卵磷脂溶解于100 mL 10 mmol/L pH7.4的PBS中,冰浴振荡)、1 mL 400 μmol/L三氯化铁、1 mL 400 μmol/L抗坏血酸和1 mL酚样品,充分混匀,避光37 ℃水浴60 min,取出待测样,再加入2 mL TCA-TBA-HCl摇匀(三氯乙酸-硫代巴比妥酸-盐酸混合液:37.5 g TCA、0.925 g TBA、5.25 mL浓盐酸依次加入250 mL蒸馏水中),90~100 ℃水浴15 min后迅速冷却,于2000 r/min离心10 min,取上清液在波长为535 nm测定样品吸光度As,用1 mL双蒸水代替样品作空白对照Ac。脂质过氧化抑制率计算公式如下。
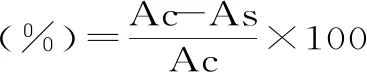
1.3 数据处理
所有实验重复3次,绘图采用Origin 8.5软件,显著性分析采用SPSS statisics 23.0单因素ANOVA中的Duncan检验。
2 结果与分析
2.1 没食子酸标准曲线
以没食子酸标准品建立没食子酸标准曲线,得标准曲线方程为y=0.0942x+0.0131(R2=0.9975),式中:x为多酚质量浓度(以没食子酸计,μg/mL;y为所对应的吸光度。决定系数R2=0.9975,浓度在0.625~6.25 μg/mL范围内,核桃多酚含量与吸光度有良好的线性关系。
2.2 不同结合方式多酚含量测定结果
五种不同结合方式多酚溶液中多酚含量测定结果如图2所示。在pH3.5和pH11时,非共价结合态多酚含量分别为11.31、7.74 mg/g,占总酚含量的44.02%、36.75%,核桃多酚与蛋白质的主要作用方式为非共价结合。共价结合态多酚分别为7.92、7.05 mg/g,占总酚含量的30.83%、33.48%。核桃仁在酸提和碱提条件下分别有74.85%、70.23%多酚通过化学键与蛋白质发生作用。在pH3.5和pH11时,游离态多酚的含量分别为6.46、6.27 mg/g,说明有25.15%、29.77%的多酚不通过任何作用力,仅以游离态形式存在于核桃脱脂蛋白溶液中。

图2 不同结合态多酚含量Fig.2 Polyphenol content in different bound forms注:不同字母表示相同提取pH不同结合方式 多酚含量之间差异显著(p<0.05)。
2.2.1 离子键结合 研究中发现在pH3.5和pH11的蛋白溶液中通过0.05 mol/L NaCl破坏离子键所得多酚含量最少,分别为2.58、1.73 mg/g,Le等[9]研究指出多酚的离子化羟基和羧基位可能与蛋白质中带正电荷的赖氨酸的ε-氨基相互作用,从而在多酚与蛋白之间形成少量的离子键。在pH3.5时通过氢键与蛋白质结合的多酚含量较高,此时蛋白中大部分官能团带正电荷,而在pH11时,带正电荷的官能团大量减少,例如赖氨酸在pH11时侧链不带电荷[22],多酚可离子化结合的蛋白质上的位点急剧减少。毛晓英[15]的研究表明核桃蛋白以酸性蛋白为主,等电点集中在pI4.8~6.8之间,少数的蛋白是碱性蛋白pI8.4~9.0。因此,在pH11时,通过离子键与蛋白质结合的多酚含量减少。
2.2.2 氢键结合 在pH3.5和pH11的蛋白溶液中通过0.05 mol/L NaCl和1.5 mol/L尿素破坏氢键所得多酚含量分别为4.24、3.60 mg/g。多酚因多羟基结构具有较强的亲水性,蛋白质兼具亲水亲油性,多酚的亲水基团与蛋白质的亲油基团能够发生氢键作用形成紧密结构[23]。多酚分子中酚羟基、醇羟基、醚键等活性基团,既可以作为氢键质子给体,也可以作为质子受体与蛋白质主链上肽键的羰基、侧链上的羟基、胍基、羧基发生氢键结合[24]。在pH3.5的溶液中通过氢键与蛋白质结合的多酚含量高于pH11的蛋白溶液。一方面可能是蛋白质氢原子受体位点在蛋白溶液呈碱性时不利于氢键的形成[16],另一方面,碱溶和酸沉条件下,蛋白质在溶液中的存在状态不同,可能影响了超滤膜对多酚的超滤效果,导致pH3.5时氢键结合组分多酚含量略高于pH11。
2.2.3 疏水相互作用 在pH3.5和pH11的蛋白溶液中通过0.05 mol/L NaCl和8 mol/L尿素破坏疏水相互作用所得多酚含量分别为4.49、2.41 mg/g。多酚中含有酚羟基和苯环,使其同时具备了亲水性和疏水性,蛋白质多肽中的芳香环或脂肪族侧链等氨基酸残基比较集中的区域,在水溶液中由于疏水作用而形成了疏水区域[25]。正因为这些疏水区域的存在,使多酚与蛋白间发生了疏水相互作用。Richard等[26]研究结果表明生物活性多酚与神经降压素通过疏水特性彼此识别。在pH3.5的溶液中通过疏水键与蛋白质结合的多酚含量高于pH11的溶液。在碱性环境中,蛋白质分子易发生变性和解离,疏水性残基暴露[27]。理论上应有更多疏水性蛋白残基与疏水多酚相互作用。但黄惠华等[28]研究明胶与单宁酸的络合反应,结果表明在体系pH为3.5时,两者反应程度最大且产生的络合物最多。Mateus[29]研究发现当体系pH为4.5时,即牛血清蛋白等电点附近时,原花青素与牛血清蛋白的结合程度最大。两者的实验现象解释为蛋白质pI附近多酚-蛋白质间的交联结合力大于蛋白质间排斥力。因此pH3.5时结合的多酚含量多,由溶剂破坏作用力所得多酚含量也越高。
2.2.4 共价键结合 研究中发现在pH3.5和pH11的蛋白溶液中,分别有7.92、7.05 mg/g的多酚通过共价键与核桃蛋白相互作用。酚类化合物具有较高的反应活性,在碱性条件下能够被氧化成半醌和醌。醌是一种反应性的亲电中间体,易受蛋白质链中的亲核分子如赖氨酸、蛋氨酸和半胱氨酸等的攻击,从而形成交联的蛋白质聚合物[30]。共价结合态多酚占总多酚含量的30.83%、33.48%,在单个多酚组分中含量最高(p<0.05)。一方面碱性有氧环境下多酚形成半醌和醌与蛋白作用,另一方面核桃仁(去除内种皮)中本身可能存在结合态酚类,都能致使结合态酚类含量升高。如Alu’datt等[31]通过低浓度的强酸和强碱水解得到大豆和亚麻籽结合酚,亚麻籽结合酚占总酚含量的20%~30%,大豆结合酚占10%~20%。在Ross等[32]的试验中干豆结合态多酚占总酚含量的94%。但以往的研究中对这类多酚与蛋白的结合研究较少,由以上结果可知,共价结合方式在多酚与蛋白结合中不容忽视。其含量高可能与所选原材料、蛋白与多酚间作用方式和提取多酚时的作用条件有关,例如提取液、溶剂作用时间,pH和温度等。
2.3 不同结合方式多酚抗氧化性研究
2.3.1 DPPH自由基清除能力 不同结合态多酚对DPPH自由基清除能力测定结果如图3所示,由图3可知,游离态多酚对DPPH自由基的清除能力最强(p<0.05),pH3.5和pH11时的清除能力分别为82.34%、43.68%。在pH3.5时,游离态多酚的抗氧化性分别是离子结合、氢键结合、疏水结合和共价结合的6.1、3.3、3.1和14.2倍,在pH11时,分别为2.7、2.6、3.7和8.4倍。可知游离态多酚抗氧化能力明显高于其他结合态多酚。造成这种现象的原因可能是抗氧化性与多酚含量存在相关性,游离酚含量越高,抗氧化活性越强[18]。另外,游离酚和结合酚在植物体中存在的位置不同,游离酚主要存在于植物细胞液泡中,结合酚主要通过酯键与细胞壁中木聚糖侧链上一些糖残基相连[33]。结合方式以及在机体中行使功能的不同,也有可能造成抗氧化性存在巨大差异。共价结合多酚清除自由基能力最低,在pH3.5和pH11时分别为5.79%、5.23%。在Alu’datt等[31]的研究中,采用碱水解(0.1 mol/L NaOH)和酸水解(0.1 mol/L HCl)所得大豆和亚麻籽的结合态多酚抗氧化能力明显低于游离酚(此实验中非碱水解提取酚类都为游离酚),与本研究共价结合酚抗氧化活性较弱的结果相一致。

图3 不同结合态多酚对DPPH自由基的清除效果Fig.3 DPPH radical scavenging activity of different bound polyphenols
2.3.2 Fe2+螯合能力 多酚对Fe2+的螯合能力测定结果如图4所示,由图4可知,游离态多酚对Fe2+螯合能力最强(p<0.05),不同结合态多酚对Fe2+螯合能力在 pH3.5和pH11条件下分别为游离态71.88%、49.96%,离子结合态11.19%、16.32%,氢键结合态18.14%、13.3%,疏水结合态19.88%、11.70%,共价结合态9.40%、8.56%。在pH3.5条件下,游离态多酚的抗氧化性分别是其它结合态多酚的6.4、4.0、3.6和7.6倍,pH11时为3.0、3.8、4.3和5.8倍。游离态多酚的抗氧化活性显著高于共价和非共价结合态多酚(p<0.05)。某些酚类物质具有特定功能基团可以螯合Fe2+,且六元环结构比五元环结构与金属离子形成的螯合物更稳定[34]。不同结合态酚类的抗氧化性也可能受到自身酚类结构的影响。

图4 不同结合态多酚对Fe2+的螯合能力Fig.4 Fe2+chelating ability of different bound polyphenols
2.3.3 还原力 多酚还原力测定结果如图5所示,由图5可知,游离态多酚吸光度最大,还原力最强(p<0.05)。 pH3.5和pH11游离态吸光度值分别为1.157、0.857,离子结合态吸光度值分别为0.143、0.27,氢键结合态吸光度值分别为0.415、0.338,疏水结合态吸光度值分别为0.438、0.291,共价结合态吸光度值分别为0.367、0.345。抗氧化剂是通过自身的还原作用给出电子从而清除自由基,还原力越强,抗氧化活性越强。还原力与其他三种测定多酚抗氧化活性结果一致,游离态多酚的抗氧化能力最强。

图5 不同结合态多酚的还原能力Fig.5 Reduction capacity of different bound polyphenols
2.3.4 脂质抗过氧化性 脂质过氧化主要指生物体内多不饱和脂肪酸和胆固醇在自由基作用下发生氧化。在酸性条件下丙二醛与硫代巴比妥酸反应生成有色化合物,在532 nm有特征吸收值[35]。
多酚抑制脂质过氧化能力测定结果如图6所示,由图6可知,游离态多酚抑制脂质过氧化的能力最强(p<0.05)。 pH3.5和pH11条件下游离酚抑制率分别为47.71%、32.69%,离子结合态多酚抑制率分别为7.6%、10.19%,氢键结合态多酚抑制率分别为15.59%、14.71%,疏水结合态多酚抑制率分别为17.29%、10.21%,共价结合态多酚抑制率分别为11.71%、11.35%。在pH3.5条件下,游离态多酚的抗氧化性分别是其它结合态多酚的6.3、3.1、2.8和4.1倍,pH11条件下分别为3.2、2.2、3.2和2.9倍。多酚可以抑制催化剂的活性,达到抑制起始自由基传播的目的。初始型抗氧化剂(AH)通过与脂质自由基L·、烷氧自由基LO·或过氧自由基LOO·反应抑制脂质的氧化链反应。抗氧化剂自由基的A·也能与过氧自由基、烷氧自由基反应而终止脂质氧化反应[35]。游离态多酚的抗氧化能力最强可归因于游离态多酚抗氧化活性更高,其在核桃仁中本身以游离态形式存在,其它结合态多酚可能结构更稳定。因此游离态多酚抑制脂质过氧化的能力更强。

图6 不同结合态多酚抑制脂质过氧化效果Fig.6 Effects of scavenging lipid peroxidation of different bound polyphenols
抗氧化剂的抗氧化活性主要表现在清除自由基、抑制脂质(也可以是蛋白质或DNA)的氧化降解、还原力和抑制促氧化剂等方面[35]。究其根本,抗氧化剂通过阻断脂质氧化的链式反应或抑制减缓脂质氧化的速率,达到抗氧化的目的。由以上结论可知,pH3.5和pH11游离态酚类含量仅是三种非共价结合态酚类含量的1.4~2.5倍和1.7~3.6倍,略低于共价结合态酚类,但抗氧化能力显著高于其它结合态酚类。由此可知,多酚的抗氧化活性不仅与含量有关,其结构可能也发挥着重要作用。
3 结论
酚类化合物通过与蛋白质、脂质和碳水化合物络合,影响食品的营养价值。核桃中丰富的蛋白质和多酚在加工过程中发生相互作用,本研究结果表明非共价结合态多酚含量>共价结合态多酚含量>游离态多酚含量,非共价结合是核桃多酚与核桃蛋白质的主要作用方式。抗氧化活性研究结果显示,游离态多酚的抗氧化活性显著高于其他结合态多酚(p<0.05)。本研究为核桃多酚与核桃蛋白互作机制的进一步研究提供理论依据,为多酚提取及工业化生产提供新方向,并为提高脱酚核桃蛋白功能性质和生物学特性提供理论依据。

