有氧条件下酿酒酵母YF1914产乙醇发酵条件优化及其产香特性
范光森,刘朋肖,吴秋华,富志磊,成柳洁,朱宇婷,朱运平,杨 然,李秀婷,*
(1.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048; 2.北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048; 3.北京工商大学食品学院,北京 100048)
白酒是我国国酒,它是借用酒曲这一特殊糖化发酵剂催化富含淀粉质的粮谷发酵,再经蒸馏、贮存和勾调而成的酒精饮料[1]。在白酒中,乙醇是其主体成分,酒醅中乙醇含量很大程度上决定了白酒的产量,另外,乙醇体积分数还是评价白酒品质的重要质量指标,与白酒的香气、口味和风格息息相关[2-3]。众所周知,微生物,尤其是酿酒酵母的代谢活动是白酒酿造中乙醇的重要来源,对于白酒发酵速率、产量、风味和品质具有重要的作用[4-5]。因此,有必要系统探究微生物中的酿酒酵母产乙醇的发酵条件。
中国白酒传统的酿造工艺生产过程更多的局限于手工操作,劳动强度大、生产效率低,在劳动力成本大幅度提升的今天,有必要在进行深入研究的基础上推进机械化程度的提高,实现传统酿造方式向现代化酿造方式转型[6]。在这一过程中,看似机械化设备的研制与使用是实现成功转型的关键,但事实上,蕴含在白酒酿造过程中的内在机制解析才是真正实现白酒酿造现代化生产的核心,也是更好实现机械化设备应用的前提[7]。在这一趋势的推动下,中国白酒的酿造已涌现部分现代化酿造方式尝试的案例,如不锈钢槽车地面恒温发酵系统代替传统地缸发酵,发酵桶、发酵池代替传统发酵设备陶缸或窖池[8]。在机械化程度提升的过程中,酿造方式也发生了微妙的变化,严格地讲,是微生物酿造微环境发生了改变。在采用地上酿造方式代替地下酿造方式转变中,较为突出的微环境变化便是酿酒过程中氧气的含量。那么,随之带来的是酿造所用微生物特性也必须随之改变,由较为严格的厌氧环境转变为微氧或有氧环境。为适应白酒酿造环境的变化,选育获得在有氧条件下高产乙醇的酵母,并对其产乙醇发酵条件进行研究成为首要的工作。这一工作的开展将会改善我国白酒生产工艺,适应现代化酿造方式,促进中国白酒的现代化酿造发展[9]。前期,本研究团队从白酒酿造用大曲中筛选获得一株在有氧环境下高产乙醇的酿酒酵母YF1914,但尚未对其产乙醇发酵条件进行系统研究[10]。因此,本文将通过单因素实验优化其在有氧环境下高产乙醇的发酵条件,并对其产香特性进行了研究,为未来白酒生产方式变革提供理论依据。
1 材料与方法
1.1 材料与仪器
酿酒酵母YF1914 本实验室自行筛选和保存;乙醇、二辛醇 购自Sigma公司;葡萄糖、酵母粉、蛋白胨、大豆蛋白胨、琼脂粉、硫酸铵、磷酸二氢钾和硫酸镁等试剂 均为国产生物或分析纯试剂;YPD培养基(g/L) 葡萄糖20、蛋白胨20、酵母粉10、琼脂粉20,115 ℃灭菌20 min;乙醇发酵培养基(g/L) 葡萄糖200、酵母浸粉10、蛋白胨20、硫酸铵1、磷酸二氢钾1、硫酸镁1,蒸馏水定容,pH自然,115 ℃灭菌20 min(培养基中酵母浸粉和胰蛋白胨各自浓度分别与各自产品标识中的有效氮量的乘积之和为该培养基的有效氮浓度);高粱 购自山东临沂沂南地区。
YQX-SG46-280S高压蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;BCN-1360型生物洁净工作台 北京东联哈尔仪器公司;电子天平、pH计 赛多利斯科学仪器有限公司;LHS-100CL恒温恒湿培养箱 上海一恒仪器设备有限公司;TU-19紫外-可见分光光度计 北京普析通用仪器有限责任公司;Microfuge 2R离心机 北京田林恒泰科技有限公司;1260series高效液相色谱仪 Agilent 科技有限公司;TSQTM8000 evo三重四级杆气质联用仪 美国Thermo Fisher Scientific。
1.2 实验方法
1.2.1 乙醇发酵条件优化 将实验室保存于甘油管中的酿酒酵母YF1914接种于YPD液体培养基中(50 mL装于250 mL三角瓶),30 ℃、120 r/min培养活化24 h,然后接入乙醇发酵培养基中培养。采用step-by-step单因素优化方法,按照表1中所列因素依次进行考察优化其产乙醇发酵条件。
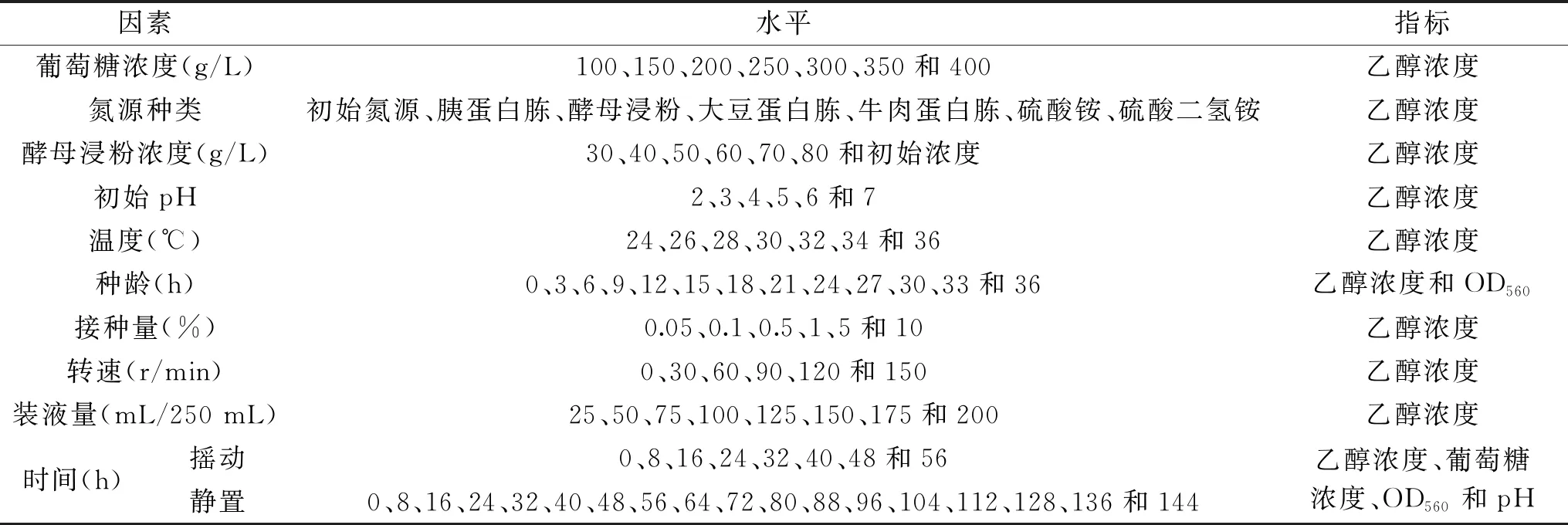
表1 优化酵母发酵产乙醇条件参数Table 1 Experimental parameters for optimal ethyl alcohol production
1.2.2 酵母发酵产香 将酵母YF1914在YPD液体培养基(固体YPD培养基中不添加琼脂)中活化,以1%的接种量接种于高粱浸出液培养基中,在30 ℃下,120 r/min培养32 h。发酵液于4 ℃、10000 r/min离心10 min,取上清液采用顶空固相微萃取-气质联用法(SPME-GC-MS)检测该酵母所产挥发性香气成分。高粱浸出液培养基的制备参照之前文献[11]进行,具体操作如下:称取250 g高粱粉碎至100目以下后,与水1∶4混合,待煮沸后,保持90 ℃条件下加入耐高温α-淀粉酶液化1 h,冷却,加入糖化酶于60 ℃下糖化2 h。糖化后,室温条件下,转速为10000 r/min,离心10 min,取上清,采用4层纱布进行过滤,得到滤液,将浸出液的糖度调至10 °Brix,分装于三角瓶中,115 ℃灭菌20 min。
1.2.3 酵母生物量和发酵液pH测定 酵母生物量采用分光光度计于560 nm处测定吸光值计算,发酵液pH利用pH计测定。
1.2.4 高效液相色谱法测定乙醇和葡萄糖含量 发酵液于室温条件下,10000 r/min 离心10 min,获得上清液,上清液用0.22 μm 水系滤膜过滤,参照Sun[12]文献进行高效液相色谱检测乙醇和葡萄糖。具体方法的参数为:BioRad Aminex HPX-87H(300 mm×7.8 mm);0.01 mol/L H2SO4,流速0.5 mL/min;柱温25 ℃,进样量20 μL,外标法定量。
1.2.5 顶空固相微萃取-气质联用法测定挥发性成分 参照范光森等[13]的方法,具体如下:发酵液装入顶空瓶中于50 ℃平衡30 min,将预处理好的50/30 μm DVB/CAR/PDMS萃取头插入顶空瓶中吸附30 min,然后移入气相色谱的高温气化室解吸5 min,进行气质分析;毛细管色谱柱为DB-FFAP(60 m×250 μm×0.25 μm),自动进样,分流比为10∶1,进样口温度为250 ℃,检测器温度250 ℃,载气为氦气,流速为1 mL/min,程序升温50 ℃,保留2 min,以8 ℃/min的速率升至120 ℃,保留2 min,再以10 ℃/min升至200 ℃,稳定5 min,最后以5 ℃/min升至250 ℃,稳定20 min;EI电离源,电子能量70 eV,扫描范围10~500 u,离子源温度250 ℃,接口温度250 ℃;通过质谱解析与NIST 11谱库和文献保留指数比对确定各化合物结构,并采用二辛醇作为内标进行内标半定量法计算各化合物的含量。
1.3 数据分析
每组试验进行三个平行,采用SPSS 17.0对试验数据进行差异显著性检验分析,利用Excel 2016和Origin 9.0绘图软件处理试验数据。
2 结果与分析
2.1 葡萄糖浓度对酵母YF1914产乙醇的影响
由图1可以看出,随着葡萄糖初始浓度的增加,乙醇浓度先增加后降低,当葡萄糖初始浓度为350 g/L时,乙醇浓度最大,为102.5 g/L。葡萄糖是酵母生长繁殖及转化为乙醇的动力能源,在其浓度较低时,酵母生长繁殖受到底物浓度不足的影响,乙醇产量不高,因此会随着葡萄糖初始浓度的增加,乙醇产量不断增加;而当乙醇浓度较高时(大于350 g/L),虽然前期研究结果表明该菌株能够耐受质量分数为80%的葡萄糖,但高浓度的葡萄糖形成的高渗透压会对酵母正常生长和繁殖造成较大的影响,从而造成乙醇产量下降[10]。曹宇龙等[14]研究表明葡萄糖初始浓度为286.5 g/L时乙醇发酵结果较为理想;伍保龙等[15]研究结果显示葡萄糖浓度为320 g/L时乙醇产量最高,这与本文研究结果较近。不同的酵母具有不同的葡萄糖耐受性,因此发酵产乙醇所需的最佳葡萄糖初始浓度也会有所差异。针对本文研究的酵母YF1914,其最佳产乙醇的葡萄糖初始浓度为350 g/L。

图1 葡萄糖浓度对酵母YF1914发酵合成乙醇的影响Fig.1 Effect of glucose concentration on ethyl alcohol production from yeast strain YF1914注:含有相同的字母表示采用Tukey test检验时 组间没有显著差异(p>0.05), 不同字母表示有显著差异(p<0.05);图2~图9同。
2.2 氮源种类对酵母YF1914产乙醇的影响
氮源是酵母生长繁殖所需的重要营养源,不同的氮源种类对酵母生长、产物形成及其它生理机能的影响不同[16]。由图2可以看出,在促进酵母发酵产乙醇方面,有机氮源明显优于无机氮源,并且在相同有效氮浓度下(41.6 g/L),以酵母浸粉为唯一氮源时,乙醇产量最高,达到111.7 g/L,与初始培养基复合氮源(酵母浸粉和蛋白胨)条件下的乙醇产量没有显著性差异。这可能是酵母浸粉中含有酵母生长所需要的微量元素及生长因子,能有效缩短酵母的迟滞期,快速大量合成胞内RNA,快速转录和表达与氮源代谢、乙醇发酵相关的基因[17]。考虑到成本问题,后续试验都以添加单一氮源酵母浸粉进行。
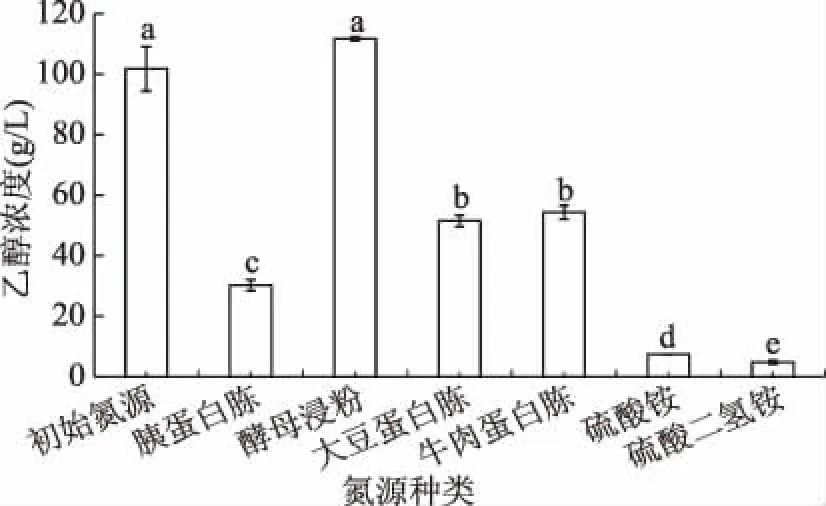
图2 氮源种类对酵母YF1914发酵合成乙醇的影响Fig.2 Effect of different nitrogen sources on ethyl alcohol production from yeast strain YF1914
2.3 氮源浓度对酵母YF1914产乙醇的影响
由图3可以看出,酵母浸粉浓度对酵母发酵产乙醇具有一定的影响,随着浓度的增加,乙醇产量先增加后降低,之后有轻微的波动。当酵母浸粉浓度为原乙醇发酵培养基有效氮浓度下(41.6 g/L,原乙醇发酵培养基有效氮浓度与酵母浸粉产品标识有效氮量的比值),乙醇产量最高为113.5 g/L。在氮源缺乏的情况下,细胞中的蛋白质及ATP含量较低,对酵母发酵乙醇的能力产生影响;氮源浓度过高,则会造成菌体生长过于旺盛,造成局部或阶段性供氧不足,引起提前衰亡[18-19]。因此,选择41.6 g/L为后续酵母浸粉的添加量。

图3 酵母浸粉浓度对酵母YF1914发酵合成乙醇的影响Fig.3 Effect of concentration of yeast extract on ethyl alcohol production from yeast strain YF1914
2.4 pH对酵母YF1914产乙醇的影响
pH不仅对酵母生长产生影响,而且也会对其代谢通路进行调控[20]。通过优化培养基初始pH发现,随着初始pH的升高,酵母发酵产乙醇能力不断增加,当初始pH为5~7时,酵母发酵产乙醇最高,这与酵母本身生长最适pH范围一致,这表明pH主要是通过影响酵母的生长速率调控乙醇产量(图4)。为后续试验的准确性和一致性,后续发酵所用培养基的pH统一调整为自然pH,即pH为5.8进行。

图4 pH对酵母YF1914发酵合成乙醇的影响Fig.4 Effect of pH on ethyl alcohol production from yeast strain YF1914
2.5 温度对酵母YF1914产乙醇的影响
温度主要是通过影响酵母体内生物酶的活性来调控生长和代谢活性。由图5可以看出在30~36 ℃之间培养时,酵母YF1914发酵产乙醇较高,这与该酵母具有较宽广的最适温度有关,酵母YF1914这一特点正适应了白酒酿造过程中温度变化范围大的特征,其这一特点可能正是长期处于白酒酿造发酵体系中选育的结果。考虑到酿酒酵母一般生长温度及其发酵产乙醇温度,后续试验选择30 ℃进行发酵培养。
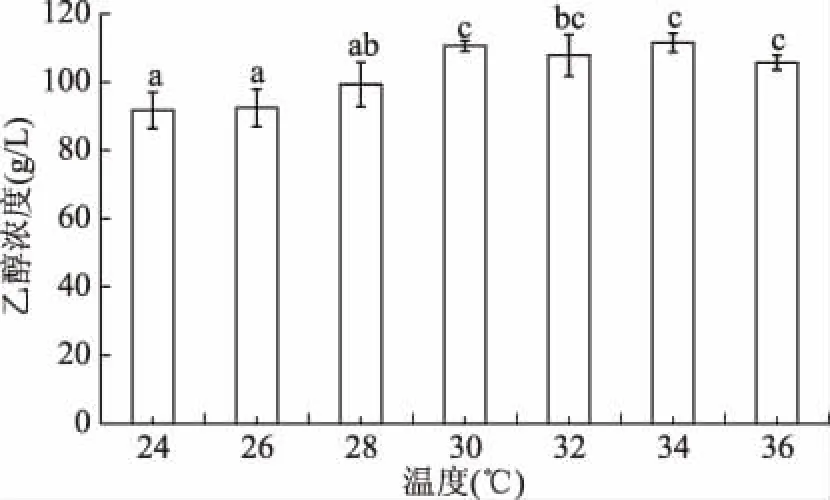
图5 温度对酵母YF1914发酵合成乙醇的影响Fig.5 Effect of temperature on ethyl alcohol production from yeast strain YF1914
2.6 种龄对酵母YF1914产乙醇的影响
不同种龄的酵母对外界环境适应能力不同,因此会影响到酵母发酵产物生成的速率和产量。由图6可以看出,接入不同种龄的酿酒酵母所产乙醇有所差异,处于延缓期以及对数前期的种子液(0~12 h),由于细胞处于适应环境状态以及实际接入的细胞数较少,因此将此时的种子进行接种,乙醇产量较低;处于对数期中后期的种子液(15~24 h),细胞已经适应环境,并且细胞数量相比其它时期较多,因此此时的种子发酵所产乙醇量较高;当种子液处于平稳期时(27~36 h),虽然实际接入细胞数量与对数中后期时基本一致,但其细胞活力相比对数期有所下降,因此不利于其发酵产乙醇。总之,处于对数生长中后期的酵母其发酵产乙醇能力较好,这与绝大多数微生物接种时对菌种菌龄的要求一致[21-22]。为此,本研究选择培养18 h的酵母作为种子液进行接种。
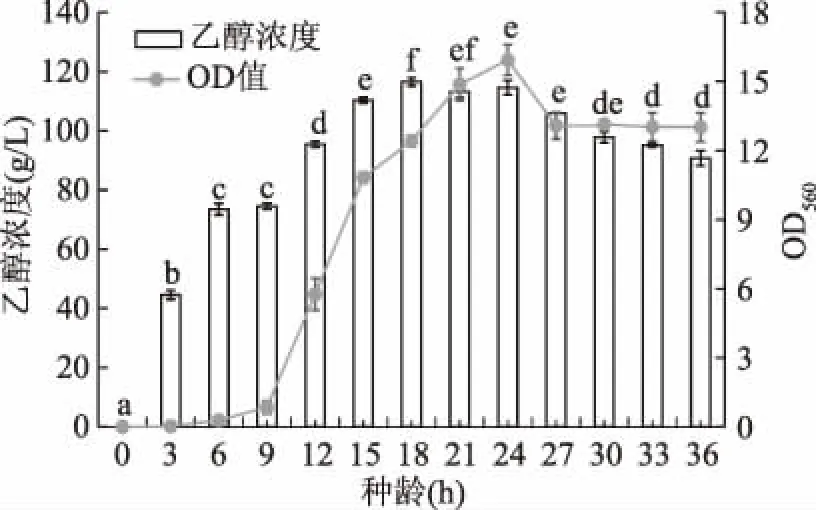
图6 种龄对酵母YF1914发酵合成乙醇的影响Fig.6 Effect of inoculum age on ethyl alcohol production from yeast strain YF1914
2.7 接种量对酵母YF1914产乙醇的影响
接种量会直接影响酵母发酵产乙醇速率,一般来讲,接种量少,延缓期长,酵母产乙醇速率低,接种量高,可能会由于营养物质或氧气不足导致乙醇产量低。通过研究接种量对酵母YF1914产乙醇的影响发现,随着接种量的增加,该酵母发酵乙醇浓度不断增加,即使在较高接种量条件下,其发酵产乙醇未受到影响(图7)。高接种量这一特性为防止污染其它杂菌提供了保障[23]。考虑到接种成本,后续研究中,以1%的接种量进行。
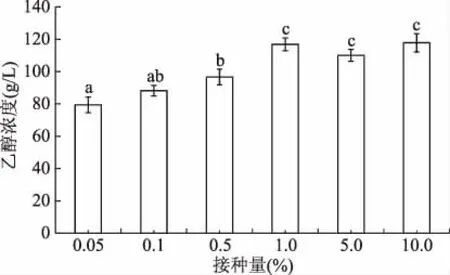
图7 接种量对酵母YF1914发酵合成乙醇的影响Fig.7 Effect of inoculation amount on ethyl alcohol production from yeast strain YF1914
2.8 转速和装液量对酵母YF1914产乙醇的影响
由图8可以看出,随着转速的提高,酵母YF1914发酵产乙醇浓度不断增加,当转速达到90~150 r/min时,乙醇浓度差异不大,为酵母YF1914产乙醇较优的条件,其中在120 r/min时,产量达到118.4 g/L,稍高于其它条件,因此选择120 r/min作为后续发酵产乙醇条件。图9表明,该酵母装液量在100 mL/250 mL以下时,发酵产乙醇效果较好,即使装液量低至25 mL/250 mL时,其乙醇产量仍处于较高水平,其中在装液量为50 mL/250 mL时,乙醇浓度达到117.6 g/L,因此后续以此装液量进行其它条件的考察。酵母YF1914这一特点正好符合本文研究的出发点,即在有氧环境下高产乙醇,这为将来白酒酿造方式的变革提供有利依据。溶氧水平对于酵母发酵生成乙醇而言有利有弊:一方面微量的溶氧是酵母保持细胞活性,提高乙醇耐受性必需的;另一方面又会抑制糖酵解途径,减少乙醇合成前体物质,降低乙醇得率[24]。

图8 转速对酵母YF1914发酵合成乙醇的影响Fig.8 Effect of agitation speed on ethyl alcohol production from yeast strain YF1914

图9 装液量对酵母YF1914发酵合成乙醇的影响Fig.9 Effect of liquid medium volume on ethyl alcohol production from yeast strain YF1914
2.9 酵母YF1914产乙醇历程
图10表明,在静置发酵方式下,酵母YF1914发酵112 h乙醇浓度达到108.3 g/L,而摇动条件下仅需32 h乙醇浓度达到124.7 g/L。比较两种发酵方式的酵母量,很明显可以看出,在摇动培养方式下酵母量明显高于静置培养条件下的酵母量。合适的氧气含量能使菌体维持较长的活力,并有可能耐受更高浓度的初始糖浓度,减少发酵周期,提高乙醇得率[24]。与相对缺氧(静置方式)条件下相比,在有氧条件(摇动方式)下酵母YF1914能够快速生长繁殖,通过细胞量的提高来实现有氧条件下快速高效地转化葡萄糖生成乙醇的目的。考虑到该菌株后期可以在有氧环境下高产乙醇,因此对该环境下培养过程的理化指标的动态变化进行了研究。结果表明(图11),在有氧环境下培养时,随着发酵时间的延长,葡萄糖浓度快速下降,发酵32 h后,发酵培养基中就已经几乎没有葡萄糖存在,这与该菌株在有氧条件下细胞量快速生长趋势一致。另外,在发酵过程中,培养基pH随着发酵时间的延长先快速降低后升高,这可能是由于在发酵前期葡萄糖含量充足,酵母快速生长并发酵产生大量酸类物质,引起pH快速下降,后期葡萄糖消耗完全,营养物质不足,酵母开始衰亡,细胞破裂引起pH稍微升高,这与酵母量及葡萄糖变化规律一致。可见,在摇动条件下,即有氧条件下,该酵母在葡萄糖消耗完全时(32 h),乙醇产量达到最高,为124.7 g/L。

图10 酵母YF1914发酵合成乙醇历程Fig.10 Time course of ethyl alcohol production by yeast strain YF1914

图11 酵母YF1914发酵过程中 葡萄糖浓度和pH变化情况Fig.11 Glucose concentration and pH changes during the fermentation process of yeast strain YF1914
2.10 酵母YF1914液体发酵产香特性
采用SPME-GC-MS法对酵母YF1914发酵产生的挥发性风味成分进行检测,结果如表2。由表2可以看出,酵母YF1914能够产生35种风味物质,其中包括醇类13种、酯类11种、醛类2种、酮类1种、烷烃类3种、烯类1种、酚类2种、呋喃类1种和酸类1种,该酵母所产这些风味物质对于其在白酒酿造过程中的应用及提高和丰富白酒风味具有一定的意义。酵母YF1914所产异丁醇和异戊醇都是高级醇,虽然含量过多对酒的感官存在一定的副作用,但在合理的浓度范围内却是白酒中醇甜和助香剂的主要物质,也是形成香味物质的前驱物质[25]。虽尚无明确的研究表明高级醇含量发挥醇甜和助香作用的浓度,但依据白酒相关的现有国家标准规定的含量要求(<30 mg/L)可以初步推断其发挥以上作用的浓度应<30 mg/L[26]。2,3-丁二醇是酵母发酵糖类物质产生的,具有增加酒的甜味作用,是当前白酒甜感的重要风味来源[27]。酵母YF1914所产的芳樟醇是一种萜烯类化合物,不仅具有一定的药理作用,而且还赋予白酒浓青带甜的木青香,该风味物质多在玫瑰香型葡萄酒中发现,在白酒中鲜有报道[28]。3-甲硫基丙醇存在于多种酒饮料中,具有洋葱、甜的肉及肉汤的气味,并且被定为芝麻香型白酒的特征风味物质,对白酒品质具有重要的影响,该酵母能够发酵产3-甲硫基丙醇,对提高白酒焙烤香具有重要的作用[29]。(R)-(+)-β-香茅醇和香叶醇是单萜醇类物质,是啤酒酒花香气的重要成分,对啤酒香气质量产生直接影响,在白酒中也较少有报道,而该酵母发酵能够产生这两种风味物质,不仅提高白酒香气,在白酒酿造中有较好的应用前景,在啤酒酿造中也具有应用潜力[30]。酵母YF1914具有突出的β-苯乙醇生产能力,而β-苯乙醇能够赋予白酒淡雅玫瑰香味[31]。该酵母还能产生具有保健功效的成分反式-橙花叔醇、红没药醇、对羟基苯乙醇、金合欢烯等[32-35]。具有清新的果香与酒香的乙酸乙酯是清香型、老白干香型和米香型等香型白酒的特征风味物质,而乙酸苯乙酯则具有舒适的花香,2-甲基丁酸-2-苯乙酯具有一定的茶香味,这些酯类化合物能够提高白酒的香味,由表2可见该酵母具有一定的产酯增香能力[36-38]。另外,该酵母还能够产生具有油脂香的3-羟基-2-丁酮[33]。综上可见,该酵母不仅具有在有氧条件下高产乙醇特点,还具有突出的产香特性。
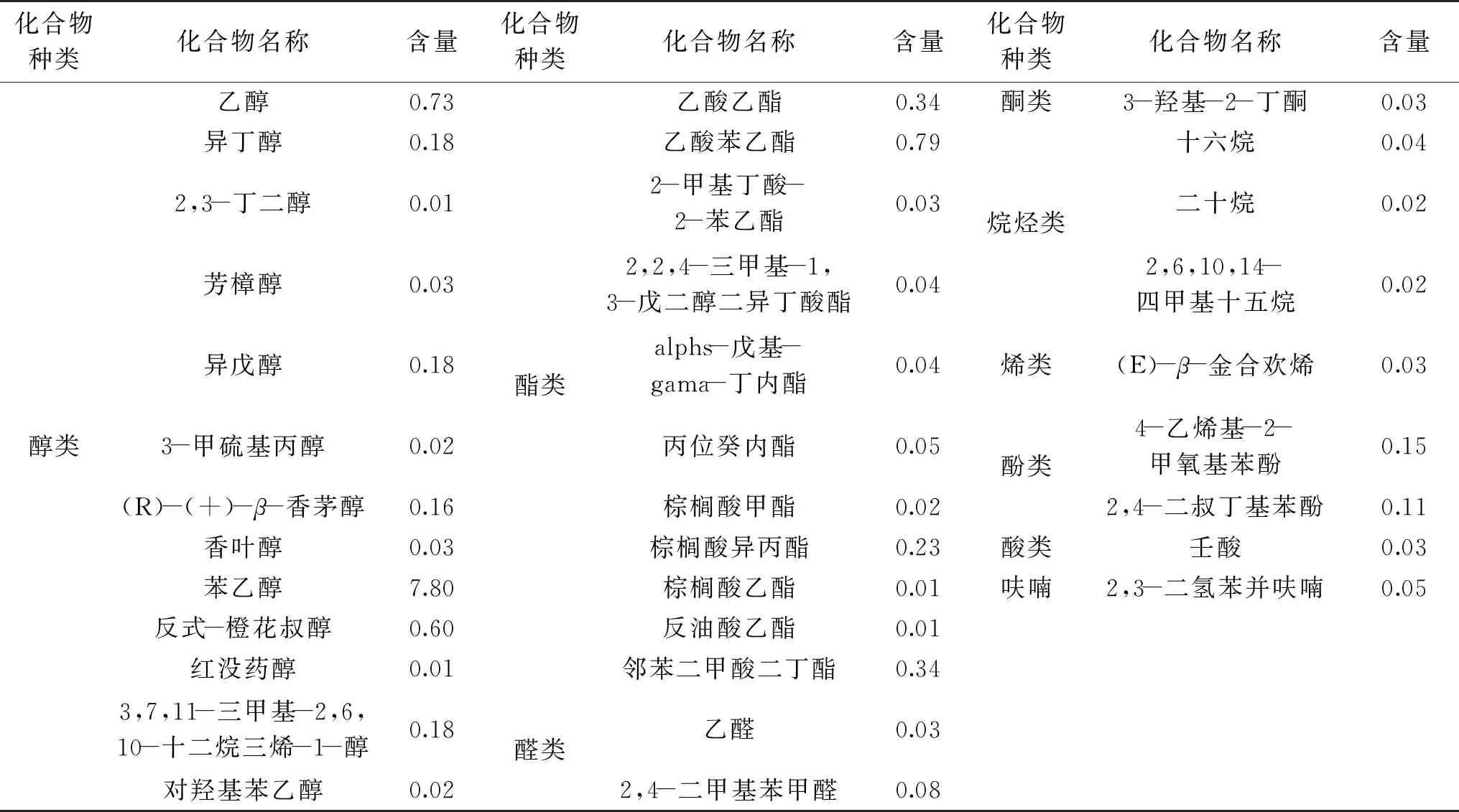
表2 酵母YF1914发酵液中挥发性成分组成及含量(g/L)Table 2 Composition and content of volatile components of yeast strains YF1914 in the fermentation broth(g/L)
3 结论
本研究对一株酿酒酵母YF1914在有氧环境下产乙醇的发酵条件进行了优化,为未来因白酒酿造方式改变带来的微环境变化提供适合的酿造菌株及发酵参数。本文在原有基础的乙醇发酵条件下(硫酸铵1 g/L、磷酸二氢钾1 g/L、硫酸镁1 g/L),通过单因素实验优化,最终确定该酵母产乙醇的最佳条件为:葡萄糖350 g/L,酵母浸粉41.6 g/L,初始pH5.8,接种量1%,装液量50 mL/250 mL,在30 ℃、120 r/min条件下培养32 h。在该条件下酵母YF1914合成乙醇高达124.7 g/L,并且该酵母液体发酵能够产生较多的呈香风味物质,这一结果为未来白酒实现有氧发酵的酿造方式提供数据参考。

