羊口疮病毒127基因的克隆表达及亚细胞定位分析
钟灵毓 王元红 白彩霞 杨侃侃 俞赵荣 鲁智敏 张学琪 刘自敏蒋书东 李永东 王勇







摘要:为了对羊口疮病毒( ORFV) AH-FlO株/27基因进行原核表达及亚细胞定位,本试验采用PCR方法扩增出ORFV127基因,成功构建原核表达重组质粒pGEX-6p-1—ORFV127和真核重组质粒pECFP-N1- ORFV127。将原核表达重组质粒转化到大肠埃希氏菌中表达,并进行纯化和鉴定。以纯化的蛋白质免疫BALB/e雌鼠制备多克隆抗体,利用Western-blot技术鉴定其反应原性。利用脂质体介导法将重组质粒pEGFP-N1-ORFV/27转染至Vero细胞,通过倒置荧光显微镜观察其在细胞中的表达及亚细胞定位。结果表明,获得的ORFV127基因序列全长为558bp,ORFV127蛋白在大肠杆菌中获得高效表达,主要以包涵体蛋白质的形式表达,大小约49 000。Western-blot结果显示,免疫小鼠获得的抗ORFV127蛋白的多克隆抗体可特异性识别ORFV127蛋白,倒置荧光显微镜观察发现,ORFV127蛋白主要定位于细胞质。本试验结果为后续研究ORFV127蛋白的功能提供了宝贵的生物材料。
关键词:羊口疮病毒;ORFV127基因;原核表达;亚细胞定位
中图分类号:S855.3
文献标识码:A
文章编号: 1000-4440(2019)03-0646-07
羊口疮,即羊传染性脓疱,是由痘病毒科、副痘病毒属的羊口疮病毒( Orf virus,ORFV)引起的绵羊、山羊、人、红鹿、松鼠和驯鹿等多种动物的一种急性、接触性、嗜上皮性人兽共患病,以口唇、舌、鼻、乳房等部位形成丘疹、水疱、脓疱和结成疣状结痂为特征,且主要引起皮肤和黏膜的增生性病变,3-6月龄的羔羊最易感染,成年羊发病较少[1-4]。ORFV导致的死亡率不高,但若混合其他病原感染时,死亡率会显著升高[5]。自19世纪50年代起,中国10余个省份不断有羊口疮疫情的相关报道,目前该病主要流行于中国西北地区,对中国畜牧养殖业造成了较大的危害[6-7]。
口疮病毒基因组为线性双链DNA,其全长约为138 kb。基因组由中央核心基因和末端基因组成[8]。中央核心基因(ORFV009 - ORFV111)相对保守,主要参与调控病毒粒子在细胞浆中的装配成熟以及病毒的复制、包装和释放,两侧末端基因(OR-FVO01 - ORFV008、ORFV12 - ORFV134、主要為与病毒的毒力、宿主嗜性、免疫逃避和免疫调节有关的基因,这些基因具有较高的种间变异性,且大多与病毒的致病机制有关,因此末端变异区具有重要的研究价值[9-13];本试验研究的ORFV127基因位于基因组的3'UTR,编码白介素-10(vIL-IO),是ORFV早期表达的基因之一[14]。
本试验拟以羊口疮病毒AH-F10株基因组为模板,扩增出ORFV127基因,构建重组质粒pGEX-6p-1-ORFV127和pEGFP-NI-ORFV/27,结合Western-blot及亚细胞定位等技术,获得了抗ORFV127蛋白的多克隆抗体及ORFV127基因在真核细胞中的表达情况,以期为后续研究ORFV127蛋白的生物学功能以及ORFV与宿主细胞相互作用机制奠定基础。
1 材料与方法
1.1 试验材料
DH5a和Rosetta( DE3)感受态细胞购自TaKaRa公司,ORFV AH-F10株[15]、pGEX-6p-l载体及Vero细胞由本实验室保存,6周龄SPF级BALB/c雌鼠购自安徽医科大学实验动物中心,许可证号:SCXK(皖)2017-001。
1.2 主要试剂
Solution I、rTaq DNA聚合酶、pMD19-T载体、限制性内切酶EcoR I和Bam H I均购自TaKaRa公司,质粒小提试剂盒、无内毒素质粒大提试剂盒购自Axygen公司,琼脂糖凝胶DNA回收试剂盒、病毒基因组DNA/RNA提取试剂盒购自Tiangen公司,谷胱甘肽S一转移酶( GST)标签鼠源单抗、羊抗小鼠IgG/HRP购自ZSGB-BIO公司,二氨基联苯胺(DAB)显色试剂盒购自Boster公司,增强化学发光(ECL)试剂盒、脂质体转染试剂Lipofectamine 2000、改良杜氏伊格尔培养基( DMEM)、胎牛血清(FBS)购自Ther-moFisher公司,4’,6-二脒基-2-苯基吲哚(DAPI)染色液购自Beyotime公司,其余试剂均为国产分析纯。
1.3 0RFV127基因的扩增
根据GenBank上公布的ORFV127基因序列( No. KP010354.1),通过Primer Premier 5.0软件设计2对引物用于扩增ORFV127基因,预期扩增产物大小为558 bp。上、下游引物序列为:ORFV127-(pGEX-6p-l)up:5’-CGGGATCCATGTCGAACAA-CAAAAITCT-3'(下划线处为添加的Bam H I酶切位点),ORFV127-( pGEX-6p-l)dw:5’-GGAAT-TCrITATGATTTAGTAGTCATGTATGAT_3’(下划线处为添加的Eco R I酶切位点),ORFV127-( pEGFP-N1) up:5’_GGAAITCTGATGTCGAACAACAAAArITCT_3’(下划线处为添加的Eco R I酶切位点),ORFV127-( pEGFP-NI) dw:5’-CGGGATCCCGTGATITAGTAGT-CATGTATGAT-3’(下划线处为添加的Bam H I酶切位点)。引物由上海生物工程有限公司合成。
采用合成的引物PCR扩增ORFV127基因,PCR扩增条件:95℃预变性5 min:95℃变性50 s,57℃退火30 s,72℃延伸40 s,30个循环后,72℃再延伸10 min。PCR扩增体系:rTaq DNA聚合酶Mix 10μl,AH-FIO株基因组模板1μl,上、下游引物各1μl,补加灭菌ddH,O至20μl。PCR产物按胶回收试剂盒步骤回收纯化后克隆至pMD19-T载体,并进行PCR、双酶切及序列测定,对测序结果进行分析。
1.4 0RFV127基因重组质粒的构建
将鉴定正确的质粒经Eco R I和Bam H I酶切后分别克隆至同样经双酶切的pGEX-6p-l及pEGFP-N1载体中。菌液PCR扩增、双酶切鉴定阳性克隆,将测序正确的重组质粒分别命名为pGEX-6p-l-ORFV/27和pEGFP-N1-ORFV/27.
1.5 重组蛋白质的诱导及纯化
将重组表达质粒pGEX-6p-l-ORFV/27转化至Rosetta感受态细胞。挑取单菌落接种于含氨苄青霉素的溶菌肉汤( LB)液体培养基中,37℃恒温摇床振荡培养至OD600为0.6-0.8时,加入异丙基-p-D-硫代半乳糖苷(IPTG)至终浓度为l mmol/L,33 0C恒温摇床振荡培养3-6 h后离心收集菌体进行SDS-PAGE电泳。采用常规包涵体洗涤、尿素复性及蔗糖浓缩方法[16]对重组蛋白质进行纯化。
1.6 重组蛋白质的Westen-blot鉴定
将纯化后的重组蛋白质经SDS-PAGE电泳后,转膜,5%脱脂奶粉4℃封闭过夜,杂交膜清洗液(TBST)漂洗3次后加入1:1 000稀释的抗GST标签的鼠源单抗,37℃孵育th。TBST漂洗3次后加入1:1 000稀释的辣根过氧化物酶(HRP)标记的羊抗鼠IgG二抗,37℃孵育th。TBST漂洗3次,DAB试剂盒显色。
1.7 多克隆抗体的制备及分析
以纯化的ORFV127蛋白免疫6周龄BALB/c雌鼠,免疫程序参照文献[17]进行。第4次免疫7d后,从小鼠眼眶采血,分离血清。对已诱导的重组蛋白质及pGEX-6P-1对照菌蛋白质进行SDS-PAGE电泳,转膜,以制备的血清为一抗,HRP标记的羊抗鼠IgG作为二抗进行Western-blot分析。
1.8 亚细胞定位分析
常规方法复苏Vero细胞,接种于6孔板中,加入含IO%FBS的DMEM培养基并将其置于37℃、5% CO,的细胞培养箱中进行培养。待其细胞密度达到70% - 80%时,利用脂质体介导法按Lipofectamine 2000试剂盒说明书将重组质粒pEGFP-N1-ORFV/27转染至Vero细胞。设置空载体转染组作为阴性对照。转染48 h后DAPI染色细胞核,在倒置荧光显微镜下观察表达蛋白质在Vero细胞中的定位。
2 结果与分析
2.1 目的基因的扩增
以AH-F10株基因组为模板,经PCR成功扩增出ORFV127基因,產物经1%琼脂凝胶电泳鉴定,显示出l条大小约为558 bp的特异性片段,与预期相符(图1)。
2.2 重组质粒的鉴定
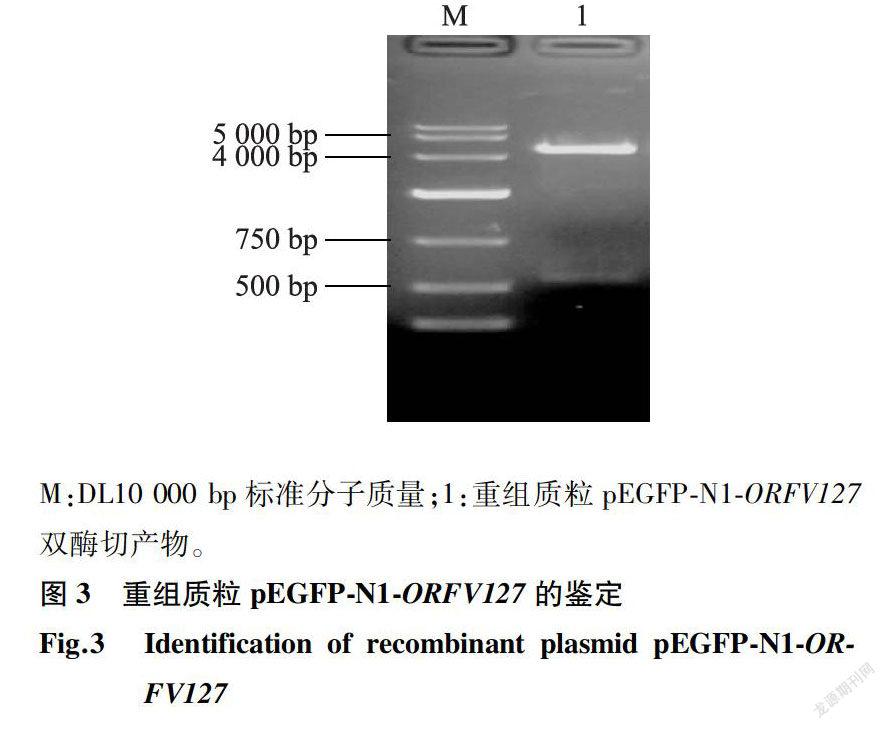
将重组质粒pGEX-6p-l-ORFV/27和pEGFP-N1-ORFV127,分别经Bam H I和Eco R I双酶切得到2个片段,均与预期相符(图2、图3)。测序结果显示,目的基因已成功克隆至pGEX-6p-l和pEG-FP-N1载体中且未发生碱基缺失或突变。
2.3 序列分析
采用DNAstar软件将AH-FIO株ORFV127基因编码的氨基酸序列与GenBank公布的10株ORFV127基因编码的氨基酸序列进行同源性分析。对比结果(图4)显示,本试验毒株与10株参考毒株的氨基酸序列同源性为97.0% - 100. 0%。AH-F10株与N22株的氨基酸序列完全一致,与OV-SAOO株的氨基酸序列同源性高达97.0%,而与中国福建、山东及广东地区流行毒株的氨基酸序列同源性为97.3% -99.1%。ORFV127基因位于末端变异区,该区域的基因大多具有较高的种间变异性,但根据对比结果发现,AH-F10株的ORFV127基因编码的蛋白质保守性较高,因此本试验研究的ORFV127蛋白具有一定的代表性。
2.4 重组蛋白质的SDS-PAGE检测
取不同诱导时间的菌液进行SDS-PAGE电泳,以未诱导的菌液作阴性对照。SDS-PAGE电泳结果(图5)显示,重组菌经诱导后表达的蛋白质大小约为49 000,且在诱导3h时表达量最高。对ORFV127蛋白进行可溶性分析,取超声破碎后菌液的上清与沉淀进行SDS-PAGE电泳。结果(图6)显示,沉淀中有明显特异性条带,说明表达的ORFV127蛋白在大肠杆菌中主要以包涵体的形式存在。
2.5 Western-blot鉴定
纯化后的蛋白质经抗GST标签的单抗进行Western-blot检测,结果(图7)显示,存在大小约49 000的特异性条带及大小约27 000的GST蛋白,说明ORFV127-GST融合蛋白能够被GST单抗特异识别,重组融合蛋白质具有良好的反应原性。
2.6 多克隆抗体的制备
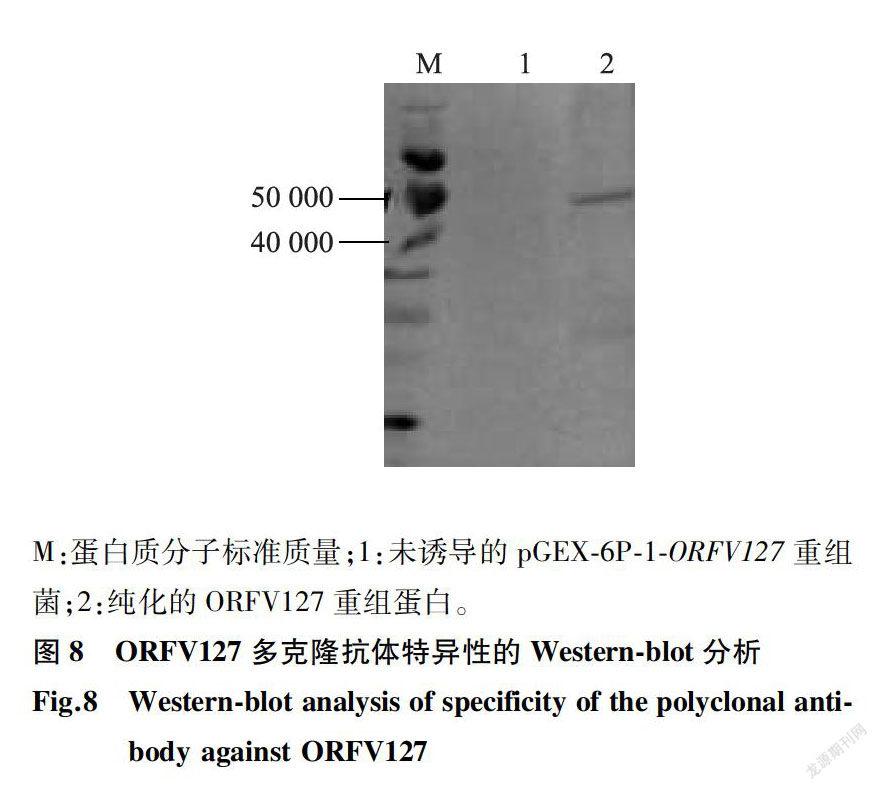
获得的蛋白质经第4次免疫后7d,小鼠眼眶采血并分离血清,用该血清作为一抗,ORFV127蛋白作为抗原进行Western-blot鉴定,结果(图8)表明,制备的多克隆抗体能够与ORFV127蛋白发生特异性反应,而未诱导的pGEX-6P-1-ORFV/27重组菌未见该条带。这说明制备的抗127-GST融合蛋白质多克隆抗体特异性较好。
2.7 重组质粒pEGFP-N1-ORFV127在Vero细胞中的表达检测
转染48 h后,用DAPI染色细胞核,在倒置荧光显微镜下观察空载体和重组质粒在Vero细胞中的表达情况。结果(图9)表明,转染pEGFP-N1空载体质粒及pEGFP-N1-ORFV/27重组质粒的细胞中绿色荧光均在细胞质中出现。
3 讨论
羊口疮是一种重要的人畜共患传染病,主要感染部分羊属动物和人类,传播速度较快,在世界各地的发生率不断上升,对养羊业造成威胁[6]。葛士坤等[18]对2006-2016年中国羊口疮病毒的遗传进化进行分析,发现世界各地流行的代表性毒株在中国均有变种分布,推测中国ORFV毒株进化特殊且可能来源于国外OV-SAOO株和N22株。本研究从AH-F10株中扩增出ORFV127基因全长,测序后将其序列与各地区经典毒株序列进行对比分析。结果表明,AH-F10株ORFV127基因编码的氨基酸序列与N22株的完全一致,与OV-SAOO株的氨基酸序列同源性为97.0%,而与中国福建、山东及广东地区流行毒株的氨基酸序列同源性为97.3% - 99.1%。由此可见,在安徽地区流行的ORFV毒株较复杂,需对其演化进行持续监测,为当地疫病防控及国内外ORFV遗传进化分析提供基础。
为深入了解ORFV127基因的功能,本试验对ORFV127基因进行原核表达。原核表达是目前外源基因表达最常用的方法之一,而成功表达目的蛋白质后获取抗体则是研究该基因及其基因表达产物生物学功能的关键。本研究通过GST标签融合表达系统成功构建重组原核表达载体pGEX-6P-1-ORFV127,并对表达条件进行优化。在本试验中,IPTG浓度的变化对目的蛋白质表达影响不明显,但转速及温度的变化对目的蛋白质表达有显著影响,在33℃恒温摇床转速为150 r/min时诱导3h,大量高效表达出127-GST融合蛋白质。蛋白质经尿素纯化、蔗糖浓缩后免疫6周龄BALB/c雌鼠,经Western-blot鉴定,成功获得特异性良好的抗127-GST融合蛋白质的多克隆抗体血清。这为建立新的ORFV检测方法以及深入研究ORFV127功能提供宝贵的生物材料。
另外,为研究ORFV127基因在宿主细胞中的表达分布情况,本试验利用融合表达EGFP和ORFV127蛋白的真核表达质粒,将其转染至Vero细胞中进行127-EGFP融合蛋白质的表达检测。在病毒侵染过程中,病毒基因组的复制、蛋白质的表达、粒体的组装以及病毒在细胞间的运动等都是在特定的亚细胞位点完成的,病毒编码蛋白质的功能与其在细胞内的定位密切相关。相关研究指出,在ORFV感染早期,ORFV127蛋白能够抑制宿主体内的先天反应和炎症反应,削弱抗原提呈细胞的抗原提呈能力,达到病毒抵抗宿主免疫反应的目的[19-20]。本试验亚细胞定位结果显示,绿色荧光聚集在细胞质,提示该蛋白质主要在细胞质中行使其生物学功能,这与ORFV127蛋白抑制细胞释放炎性介质,干扰抗原呈递的功能相一致。日后可以进一步优化试验过程,在不同时间点对ORFV127蛋白的定位进行观察,有利于更加准确、全面地掌握OR-FV127蛋白的定位信息,進而分析该蛋白质在ORFV感染宿主细胞过程中发挥的作用。
参考文献:
[1]殷震,刘景华,动物病毒学[M].2版,北京:科学出版社,1997: 977-980.
[2] 11 W, NING Z,HAO W, et al.Isolation and phylogeneticanalvsis of orf virus from the sheep herd outbreak in northeastChina[J].BMC Veterinary Research, 2012,8(1):229.
[3]王勇,殷冬冬,杨侃侃,等,羊口疮病毒的分离鉴定及其遗传进化分析[J].扬州大学学报(农业与生命科学版),2017,38(2):10-14.
[4] DE LA CONCHA-BERMEJILLO A,CUO J, ZHANCZ, et al. Se-vere persistent orf in young goats[J].Journal of Veterinary Diag-nostic Investigation, 2003, 15(5):423-431.
[5] VIKOREN T,LILLEHAUG A,AKERSTEDT J,et al-A severeoutbreak of contagious ecthyma( orf) in a free-ranging musk ox( Ovibos moschatus) population in Norway[J].Veterinary Microbi-ology, 2008, 127( 1/2): 10-20.
[6] 杨海波,孟庆玲,乔军,等.羊口疮病毒新疆流行株的分离鉴定及其遗传进化分析[J].西北农林科技大学学报(自然科学版),2015,43(2):14-22.
[7]杨钰,冯杰,刘嫒,等.重庆地区羊口疮病毒的分离鉴定及FIL基因的原核表达[J].中国畜牧兽医,2015,42(6):1396-1401.
[8]
TSAI S M, CHAN K W, HSU W L,et al.Development of a loop-mediated isothermal amplification for rapid detection of orf virus[J]. Journal of Virological Methods, 2009, 157(2):200-204.
[9] 白刚,贾怀杰,何小兵,等,羊口疮病毒ORF129基因重组质粒的构建及其在BHK-21细胞中的表达[J].甘肃农业大学学报,2013,48(5):8-13.
[10] IMLACH W. MCCAUC_HAN C A,MERCER A A,et al.Orfvirus-encoded interleukin-10 stimulates the proliferation of murinemast cells and inhibits cytokine svnthesis in murine peritonealmacrophages[J].Joumal of General Virology, 2002, 83(5):1049-1058.
[11] DELHON G,TULMAN E R,AFONSO C L,et al. Cenomes of theparapoxviruses ORF virus and bovine papular stomatitis virus[J].Journal of Virology, 2004, 78(1):168-177.
[12]闫丰超,邵佳,窦永喜,羊口疮病毒分子生物学的研究进展[J].中国兽医科学,2013(1):103-109.
[13]成伟伟,张克山,刘永杰,等.羊传染性脓疱病毒基因组结构和主要基因功能研究进展[J].动物医学进展,2014, 35(7): 82-85.
[14] BENNETr J R. LATEEFZ,FLEMING S B. et al- Orf virus IL-10reduces monocyte, dendritic ceLl and mast ceLl recruitment to in-flamed skin[J].Virus Research, 2016, 213: 230-237.
[15] WANG Y. YANG K. BAI C,et al.Development of a SYBR CreenI real-time PCR for the detection of the orf virus[J].AMB Express,2017,7(1):21.
[16]王勇,赵玉洁,杨侃侃,等.口疮病毒020基因的克隆、表达及多抗制备[J].安徽农业大学学报,2017,44(5):780-783.
[17]殷冬冬,白彩霞,唐井玉,等.Nectin-4基因的原核表达及多克隆抗体制备[J].扬州大学学报(农业与生命科学版),2016,37(3):6-10.
[18]葛士坤,张凯照,鲁荣,等.2006-2016年中国羊口疮病毒的遗传演化分析[J].中国畜牧兽医,2018,45(2):439-447.
[19]于永忠,吴志军,朱战波,等.羊口疮病毒分子特征与免疫逃逸策略[J].病毒学报,2012,28(3):278-284.
[20] CHAN A. BAIRD M, MERCER A A. et al.Maturation and func-tion of human dendritic cejls are inhibited bv orf virus encoded in-terleukin-10[J].Iournal of Ceneral Virology, 2006, 87( ll):3177-3181.
(责任编辑:王妮)

