反式脂肪酸对肥胖大鼠氧化还原态的影响
余辉艳 范荣 化轶男 佟超 钱晓蒙 肖荣 麻微微

摘 要:目的:利用高脂饲料建立大鼠肥胖模型,通过对添加不同剂量反式脂肪酸(TFAs)喂养的大鼠脑及血液氧化损伤相关指标比较,探讨TFAs对肥胖大鼠脑和血液抗氧化系统的影响机制。方法:健康雄性SD大鼠40只,随机分为4组:对照组(CON组)、喂饲基础饲料、饮食诱导的肥胖组(DIO组),喂饲高脂饲料,1%及8%反式脂肪酸组(1% TFAs、8% TFAs组)喂饲添加1% TFAs及8% TFAs的高脂饲料。8周后,心脏取血后,处死动物,留取脑组织及血液以检测相关指标。结果:不同饲料喂养8周后,8% TFAs组大鼠脑丙二醛(MDA)含量明显高于CON组、 DIO组与1% TFAs 组(P<0.01);CON组、DIO组、1% TFAs及8% TFAs组大鼠脑还原型谷胱甘肽(GSH)含量依次显著下降,差异有统计学意义(P<0.01);1% TFAs组大鼠血清谷胱甘肽过氧化物酶(GSH-PX)活力低于DIO组、CON组(P<0.05);与CON组相比,8% TFAs组大鼠脑核因子E2相关因子2(Nrf2)mRNA表达水平显著上调(P < 0.01);8% TFAs组血红素加氧酶-1(HO-1)蛋白表达水平显著高于CON组(P<0.05)、DIO组(P<0.05)及1% TFAs组(P<0.01)。结论:高含量TFAs摄入可引起肥胖大鼠血液和脑发生氧化损伤,上调氧化损伤相关基因和蛋白表达。
关键词:反式脂肪酸;氧化损伤;肥胖
大量研究表明,过多的摄入反式脂肪酸(TFAs)与心血管疾病[1-2]、2型糖尿病[3]、癌症[4-6]及婴儿发育不良[7]等慢性疾病的发生有一定关系。研究表明,TFAs能引起神经细胞氧化损伤,导致大脑认知功能衰退[8]。大量研究表明,中年超重或肥胖与老年痴呆、阿尔茨海默病及血管性痴呆风险增加独立相关[9]。而肥胖人群TFAs的摄入显著高于正常者,有研究显示,单饱和脂肪和多不饱和脂肪的摄入增加与体重增加无关,但动物脂肪、饱和脂肪和TFAs的增加与体重的变化有显著正相关[10-11]。TFAs的摄入增加,可能会加重肥胖人群机体氧化损伤,但具体机制还需要进一步探讨。因此,本实验通过建立肥胖大鼠模型,观察不同含量的TFAs的高脂肪饲料对大鼠脑和血液氧化损伤相关指标和核转录因子2(Nrf2)及血红素氧化酶(HO-1)信号通路分子的影响,探讨TFAs摄入对肥胖大鼠脑氧化损伤的影响机制。
1 材料与方法
1.1 试剂
丙二醛、谷胱甘肽過氧化氢酶、谷胱甘肽、BCA(Bicinchoninic acid)蛋白检测试剂盒,南京建成生物工程研究所;HO-1单克隆抗体,美国Abcam公司;二抗(Anti-mouse IgG,HRP-linked Antibody),美国CST公司;Nrf2单克隆抗体,美国CST公司;二抗(Anti-rabbit IgG,HRP-linked Antibody),美国CST公司;逆转录试剂盒,德国Thermo公司;通用型SYBR快速定量PCR试剂盒,美国KAPA公司;基因合成引物,由上海生工生物工程有限公司进行合成。
1.2 实验动物
1.2.1 动物及饲养 健康雄性SD大鼠40只,体重140~160g,SPF级别;动物饲养条件:动物饲养于SPF级实验动物中心,温度20~23℃,湿度50%~55%,自然采光。自由饮水及摄食,动物由北京维通利华试验动物技术有限公司提供,并通过首都医科大学伦理委员会审查。动物合格证编号:SCXK-(京)2016-0011,伦理审查编号:AEEI-2017-002 首都医科大学伦理委员会。SPF级别基础饲料和高脂肪饲料,北京科澳协力饲料有限公司,分别为:基础饲料,高脂饲料(脂肪供能比45%);1% TFAs,添加1% TFAs的高脂饲料;8% TFAs,添加8% TFAs的高脂饲料。
1.2.2 动物分组与处理 动物随机分为4组,对照组(CON,基础饲料)、肥胖组(DIO,高脂饲料)、1%反式脂肪酸组(1% TFAs,添加1%TFAs的高脂饲料)、8%反式脂肪酸组(8% TFAs,添加8%TFAs的高脂饲料)。动物喂养8周后,采用1%水合氯醛麻醉动物后,心脏取血,3 500r/min离心15min,留取血清。动物处死后,留取脑组织迅速转移至-80℃冰箱冻存,以检测相关指标。
1.3 方法
1.3.1 脑和血液氧化损伤指标的检测 将大鼠脑组织匀浆,用BCA检测试剂盒测定总蛋白含量。依照各个试剂盒说明书的步骤加样反应,使用多功能酶标仪(Infinite M200 PRO,奥地利Tecan公司)测定吸光度,根据标准曲线计算大鼠脑组织和血浆中还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)、丙二醛(MDA)含量、谷胱甘肽过氧化物酶(GSH-PX)活力及GSH与GSSG比值。
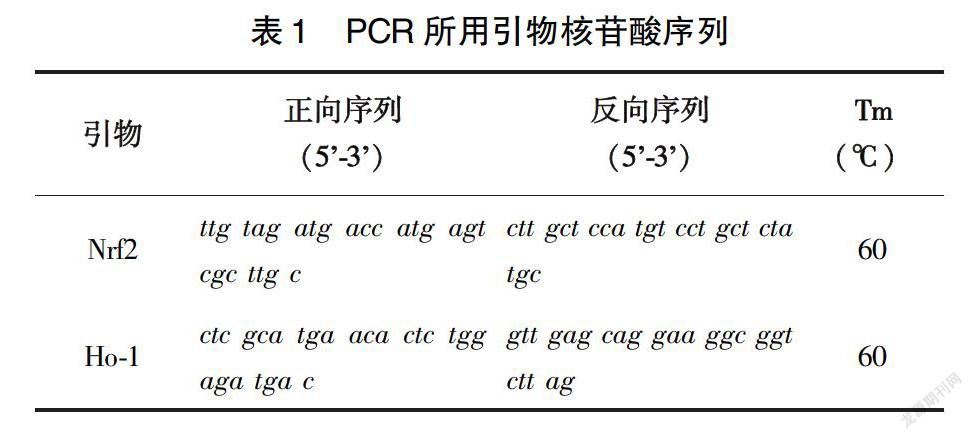
1.3.2 脑组织氧化损伤相关基因水平的检测 Real-time PCR法检测肺组织HO-1、Nrf2 mRNA的表达。提取和纯化大鼠脑组织中的总RNA,按逆转录试剂盒说明书对RNA进行逆转录,使用美国Bio-Rad公司PCR仪进行扩增,所用引物序列见表1。结果采用Bio-Rad分析软件进行半定量分析,以GAPDH作为内参基因,目标基因相对表达量=2^(Ct目标- Ct内参)。
1.3.3 脑组织蛋白氧化损伤相关蛋白水平的检测Western blot法检测大鼠脑组织中Nrf2 和HO-1 蛋白表达水平。提取大鼠脑组织的总蛋白,将等量的蛋白(40 μg)在12% 的SDS-PAGE 中电泳,切取目的条带。300 mA 低温条件下转膜。在5%脱脂奶粉封闭液中常温封闭1 h。分别用大鼠HO-1、Nrf2、β-actin抗体4℃孵育过夜。将膜在TBST 中充分洗涤后,分别加入HRP 标记的二抗(Nrf2为抗兔抗体、HO-1为抗鼠抗体),常温孵育1 h。将膜取出,在TBST 中洗涤后,使用ECL 发光法进行显色反应,化学发光成像系统(Fusion SL6,法国vilber公司产品)进行显影扫描。
1.4 统计学方法
实验结果以±s表示。采用SPSS 22.0统计软件包进行数据正态和单因素方差分析,组间比较采用LSD法或用Dunnett-T3法检验,P <0.05表示有统计学意义。
2 结果与分析
2.1 TFAs对肥胖大鼠一般生长发育的影响
CON组、DIO组、1% TFAs和8% TFAs组大鼠一般状况良好。第8周大鼠体重各组间差异显著(P < 0.01);与CON组比较,DIO组、1% TFAs组、8% TFAs组大鼠体重均显著升高(P<0.05)(表2)。
2.2 TFAs对肥胖大鼠抗氧化系统相关因子的影响
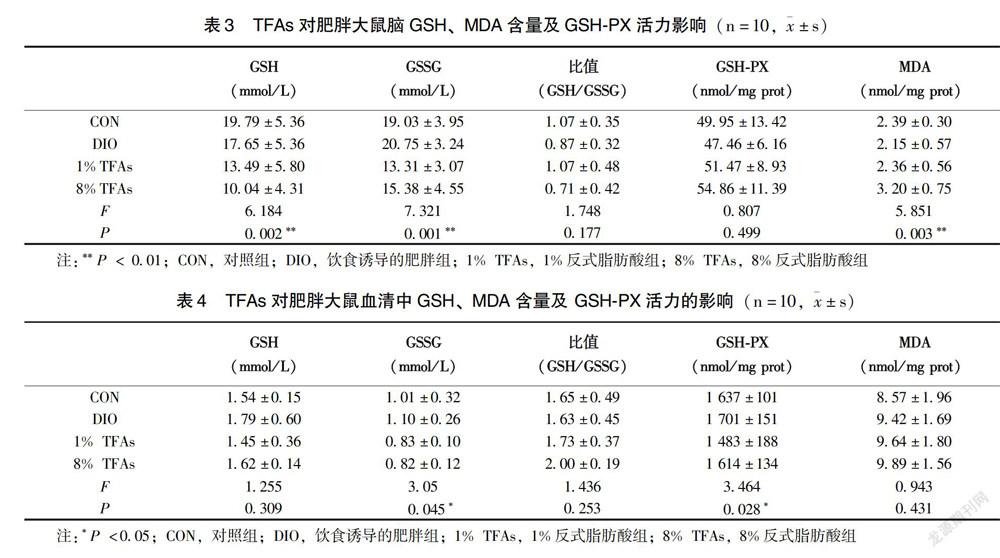
2.2.1 TFAs对肥胖大鼠脑GSH、MDA含量及 GSH-PX活力的影响 4组大鼠脑组织GSH水平呈下降趋势,差异具有统计学意义(P=0.002),其中CON组与1% TFAs组(P =0.016)、CON组与8% TFAs组(P< 0.001)、DIO组与8% TFAs组(P =0.004)之间有统计学差异;GSSG 4组间差异具有统计学意义(P=0.001),其中CON组与1%TFAs组(P=0.003)、CON
2.2.2 TFAs对肥胖大鼠血清GSH、MDA含量及GSH-PX活力的影响 表4显示,CON组、DIO组、1%TFAs组及8%TFAs各组大鼠血清GSH及MDA水平无明显差异;GSSG 4组间有统计学差异(P=0.045);GSH/GSSG比值4组间无明显差异;GSH-PX活力4组间有统计学差异(P=0.028),其中与CON组与1%TFAs组(P=0.034)、DIO组与1%TFAs组(P=0.004)之间有统计学差异,1%TFAs组GSH-PX活力低于CON组和DIO组。
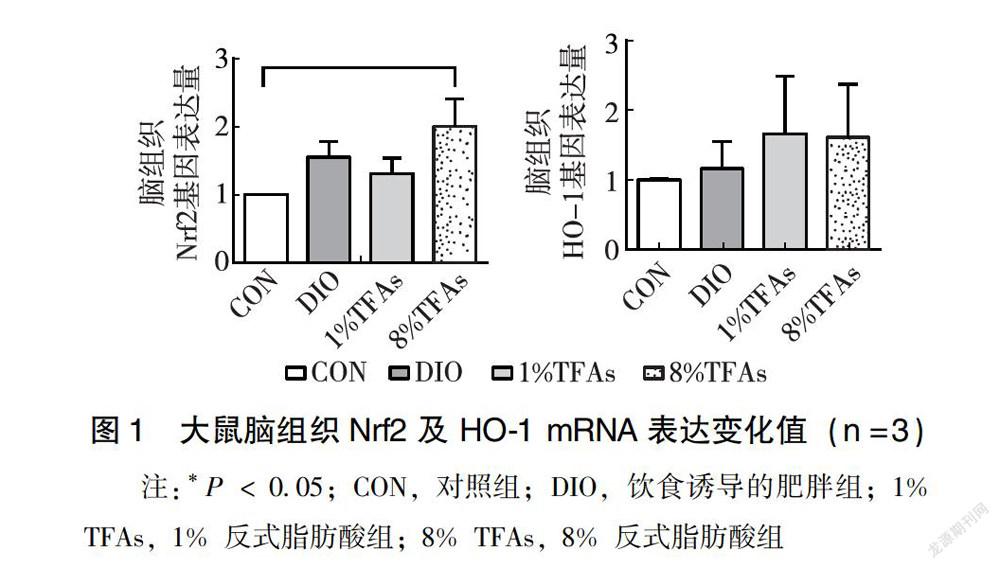
2.3.1 TFAs对肥胖大鼠脑组织Nrf2及 HO-1 mRNA表达情况的影响 PCR实验结果显示,与CON组比较,DIO组、1% TFAs组、8% TFAs组大鼠脑组织均上调Nrf2及HO-1RNA表达水平,其中8% TFAs组显著上调Nrf2 mRNA表达水平(P = 0.022),其余各组间增量不具有统计学意义(P>0.05)(图1)。
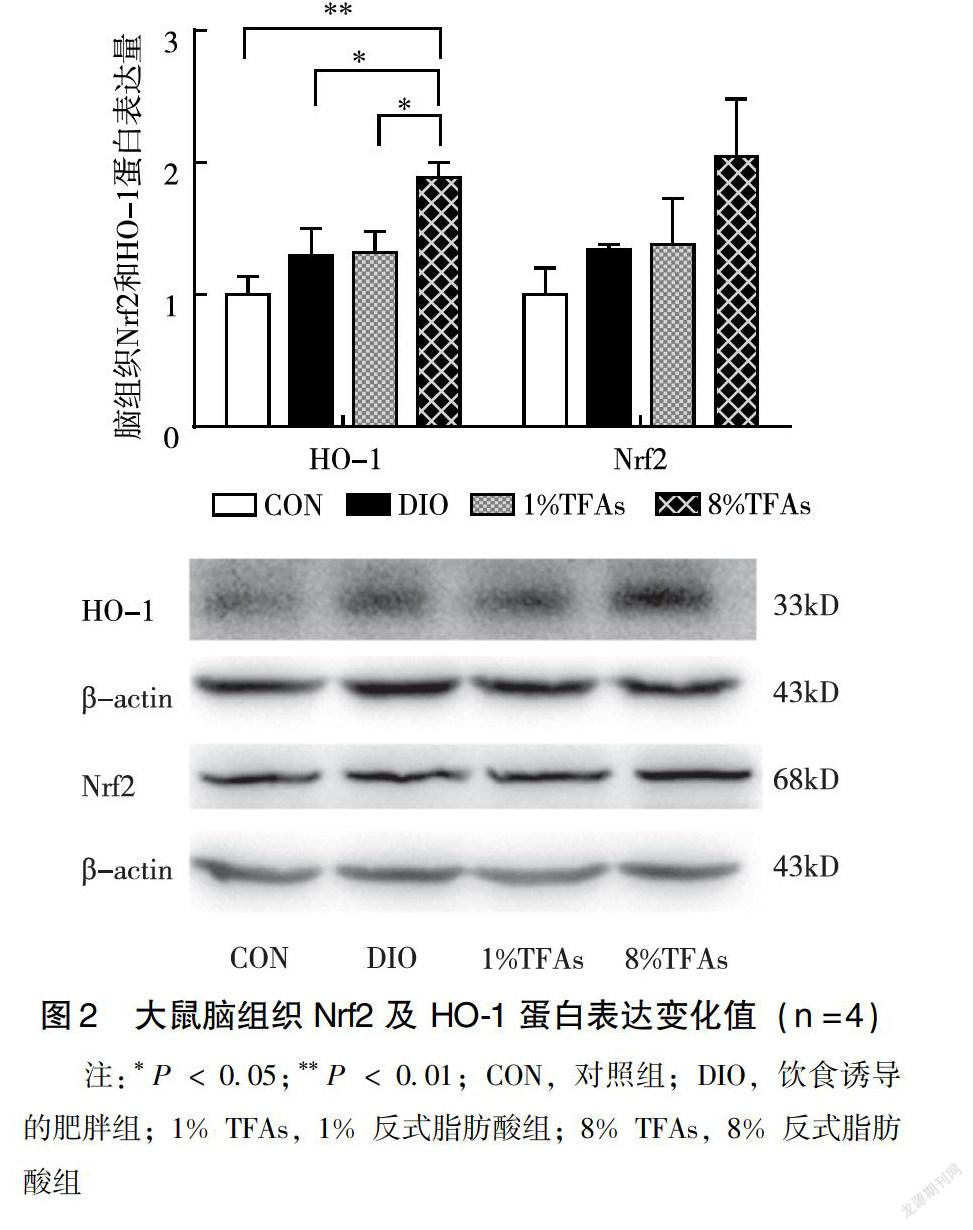
2.3.2 TFAs对肥胖大鼠脑组织Nrf2及 HO-1蛋白表达情况的影响 Western blot实验结果显示,与CON组比较,DIO、1% TFAs、8% TFAs组大鼠脑组织中Nrf2、HO-1蛋白表达水平均上调,其中8% TFAs组HO-1 蛋白表达水平显著高于CON组(P=0.002),8%TFAs组HO-1蛋白表达水平显著高于DIO组及1%TFAs组(P=0.021;P=0.024),其余各组间差异均不具有统计学意义(P>0.05)(图2)。
3 讨论
本实验以高脂肪饲料建立肥胖动物模型,结果显示,经过8周的饲料喂养,CON组及DIO组、1% TFAs、8% TFAs组大鼠一般生长发育状况良好,DIO组大鼠体重显著高于CON组,说明高脂肪饲料喂养建立的肥胖大鼠模型成功。
研究显示,MDA能间接反映氧自由基含量和氧化损伤的程度。GSH-PX是体内广泛存在的催化过氧化氢分解的酶,是内源性清除系统的抗氧化剂,是氧化损伤敏感的指标之一[12]。GSH作为GSH-PX的作用底物,可清除生物体内有害自由基或脂质过氧化物,使其轉换成脂肪酸和水,并转化成氧化型谷胱甘肽GSSG。GSH/GSSG 浓度比值受外界因素干扰少,能更准确地反映GSH/GSSG氧化还原对的还原能力[13]。
本研究表明,8周的不同饲料喂养条件下,CON组、 DIO组与1% TFAs 组在大鼠脑组织中的MDA含量无明显差异,8% TFAs组含量明显高于前3组,说明高含量TFAs(8% TFAs)摄入已导致健康及肥胖大鼠产生明显的氧化应激和脂质过氧化。CON组、DIO组、1% TFAs及8% TFAs组大鼠脑组织GSH含量依次显著下降,说明健康及肥胖大鼠脑组织中氧化损伤加重,而清除氧自由基的能力逐渐减弱。血清中1% TFAs 组GSH-PX活力低于DIO组、CON组,表示TFAs的摄入引起的氧化应激反应已在血液系统中有所体现。
Nrf2信号通路在调节细胞抗氧化应激反应中起着重要作用。HO-1是Nrf2调节的下游抗氧化酶基因的表达蛋白,近年来研究表明,HO-1 通过抗氧化损伤作用而发挥其神经保护作用[14-15]。本研究显示,在mRNA水平,与CON组比较,8% TFAs组显著上调Nrf2 mRNA表达水平。在蛋白水平,8% TFAs组HO-1 蛋白表达水平显著高于CON组、DIO组及1% TFAs组,说明HO-1被激活,诱导抗氧化物质的表达,起到细胞保护作用。这表明TFAs可能引起了肥胖大鼠脑氧化应激的发生,激活了Nrf2和HO-1的表达。
4 结论
本研究结果表明,高含量TFAs可能引起肥胖大鼠脑和血液的抗氧化能力损伤,清除自由基能力下降,发生氧化应激和脂质过氧化,其作用机制可能与上调Nrf2和HO-1基因和蛋白水平的表达有关,导致组织损伤,最后引发相关疾病的发生。
参考文献
[1]张艳,赵丽云.反式脂肪酸研究现状[J]. 卫生研究,2012,41(4):683-685.
[2]Stender S,Dyerberg J.Influence of trans fatty acids on health [J]. Ann Nutr Metab,2004,48(2):61-66.
[3]Thompson AK,Minihane AM,Williams CM.Trans fatty acids,insulin resistance and diabetes[J]. Eur J Clin Nutr,2011,65(5):553-564.
[4]King,I.B.Serum tans-fatty acids are associated with risk of prostate cancer in?-carotene and retinol efficacy trial [J]. Cancer Epidemiology Biomarkers Prev,2005,14(4):988-992.
[5]Slattery ML,Benson J,Ma KN,et al.Trans-fatty acids and colon cancer [J]. Nutr Caner,2001,39(2):170-175.
[6]Kohlmeier L,Simonsen N,van′t Veer P,et al.Adipose tissue trans fatty acids and breast cancer in the European community multicenter study on antioxidants,myocardial infarction,and breast Cancer [J]. Cancer Epidemiol Biomarkers Prev,1997,6(9):705-710.
[7]Sugano M,Ikeda I.Metabolic interactions between essential and trans-fatty acids [J]. Current Opinion in Lipidology,1996,7(1):38-42.
[8]秦書琪,麻微微.反式脂肪酸与老年痴呆症发病相关性的研究进展 [J]. 卫生研究,2015,44(1):143-146.
[9]Xu W L,Atti A R,Gatz M,et al.Midlife overweight and obesity increase late-life dementia risk A population-based twin study [J]. Neurology,2011,76(18):1568-1574.
[10]Koh-Banerjee P,Chu NF,Spiegelman D,et al.Prospective study of the association of changes in dietary intake,physical activity,alcohol consumption,and smoking with 9-y gain in waist circumference among 16 587 US men [J]. Am J Clin Nutr,2003,78(4):719-727.
[11]Field A E,Willett W C,Lissner L,et al.Dietary fat and weight gain among women in the nurses health study [J]. Obesity(sliver spring),2007,15(4):967-976.
[12]Valko M,Leibfritz D,Moncol J,et al.Free radicals and antioxidants in normal physiological functions and human disease [J]. International Journal of Biochemistry & Cell Biology,2007,39(1):44-84.
[13]Wu G,Fang YZ,Yang S.Glutathione metabolism in animals:nutritional regulation and physiological significance [J]. Trends in comparative Biochem Physiol,2002(9):217-227.
[14]Baird L,Dinkovakostova A T.The cytoprotective role of the Keap1-Nrf2 pathway [J]. Archives of Toxicology,2011,85(4):241-272.
[15]Jazwa A,Cuadrado A.Targeting heme oxygenase-1 for neuroprotection and neuroinflammation in neurodegenerative diseases [J]. Current Drug Targets,2010,11(12):1517-1531.

