桑毛色二孢根腐病菌遗传多样性的ISSR分析
谢红辉 王丽 萍黄显雅 李菊馨



摘要:【目的】明确来源于广西各地桑树根腐病病原菌可可毛色二孢(Lasiodiplodia theobromae Pat.)的遗传多样性特征,为桑树抗病育种提供参考依据。【方法】以从广西各桑树种植区采集、分离的44株L. theobromae菌株为材料,利用真菌基因组DNA提取试剂盒提取参试菌株的基因组DNA;从加拿大哥伦比亚大学公布的ISSR引物序列中随机选择60条引物先对8株菌株的DNA进行预扩增,选用扩增条带数量多、条带清晰的引物对所有参试菌株的DNA进行扩增,统计每条引物的扩增条带数形成0、1矩阵;利用NTSYSpc(Version 2.10e)计算不同菌株间的遗传相似系数,采用非加权组平均法构建系统发育聚类图,并进行聚类相关分析;利用PopGene(Version 1.32)分析不同地理来源和寄主来源菌株的遗传分化程度。【结果】ISSR分子标记结果显示,44株参试菌株(7个居群)的多态位点百分率在92.00%以上;7个居群的平均遗传一致度(IN)和平均遗传距离(D)分别为0.7363和0.3108;44株参试菌株的平均基因多样性指数(H)和Shannon’s信息指数(I)分别为0.3263和0.4841,均高于7个居群的平均值(0.1256和0.1796);对应的遗传分化系数(Gst)、基因流值(Nm)分别为0.6142和0.3141。【结论】广西地区桑毛色二孢根腐病菌菌株具有较高的多态性,菌株间的遗传多样性高于居群,遗传多样性与菌株的地理来源有关。
关键词: 桑树;根腐病;可可毛色二孢;ISSR;广西
0 引言
【研究意义】目前广西的桑树种植面积达20.06万ha,是我国蚕茧生产第一大省(区)和世界重要原料茧生产基地(何雪梅等,2017)。真菌类病害是我国桑树的主要病害,其中与子囊菌亚门真菌有关的真菌病害有50多种(蒲冠勤等,2012;谢红辉,2016)。可可毛色二孢(Lasiodiplodia theobromae Pat.)是一种多型性土传真菌,在全世界广泛分布(Sreerama and Singh,2009)。L. theobromae的寄主植物有500多种,在相同或不同植物上引起的病害症状多种多样(胡美姣等,2012;Safdar et al.,2015)。2014年,我国首次报道L. theobromae在广西横县侵染桑树根部引起根腐病(Xie et al.,2014),目前生产上尚缺乏防治桑毛色二孢根腐病的有效药剂。抗病育种是防治植物病害的一种有效途径,而研究病原菌的遗传多样性对于开展抗病育种工作具有重要意义。【前人研究进展】Nghia等(2012)利用ISSR分子标记研究来自橡胶树的20株Botryodiplodia theobromae(L. theobromae的异名)菌株的遗传多样性,发现参试菌株的ISSR类群划分与菌株的地理来源有关。Tan等(2012)利用筛选出的4条ISSR引物对20株L. theobromae菌株进行分子标记,共扩增出483条DNA条带,其中126条为多态性条带,多态率为29.9%;聚类分析结果显示,所有菌株被分为9个类群,基因型与地理来源无关。陈小莉(2015)研究了芒果蒂腐病菌的遗传多样性,发现群体间遗传多样性丰富,菌株的聚类与菌株的地理来源和致病力无关联。Qiu等(2015)利用ISSR分子标记研究了葡萄座腔菌科Diplodia seriata、Neofusicoccum parvum、Botryosphaeria dothidea和L. theobromae 4个种不同地理来源的171株菌株的遗传多样性和遗传分化,结果表明同一地理来源的菌株遗传差异明显。【本研究切入点】前人研究结果显示,L. theobromae菌株的遗传多样性或与菌株的地理来源有关。桑毛色二孢根腐病作为我国桑树生产上一种严重发生的新病害,但其病原菌的遗传多样性和遗传分化规律是否与菌株的地理来源有关尚需进一步验证。【拟解决的关键问题】采用ISSR分子标记分析来自广西不同桑树种植区的根腐病病菌L. theobromae菌株的遗传多样性,利用NTSYSpc和PopGene分析计算菌株的遗传相似系数和遗传分化相关参数值,采用非加权组平均法构建系统发育聚类图,并进行聚类相关分析,以明确菌株间的遗传分化情况及其与菌株地理来源间的关系,为开展桑树抗病育种等病害防治研究提供参考。
1 材料与方法
1. 1 供试菌株
菌株由本课题组从广西横县、鹿寨和宜州等地的桑毛色二孢根腐病病株根部组织分离,并通过柯赫氏法则验证、测定菌株的ITS序列和EF1-α序列鉴定所得(表1)。表1中L. theobromae菌株的ITS和EF1-α序列均已在NCBI中注册提交,且分别与已发表的L. theobromae代表菌株CBS 164.96(Phillips et al.,2005)的ITS序列(登录号AY640255)和EF1-α序列(登录号AY640258)同源性达99%。
1. 2 菌株DNA提取与检测
利用真菌基因组DNA提取试剂盒(E.Z.N.A.® Fungal DNA Min Kit,OMEGA公司生产)提取参试菌株的基因组DNA,按照试剂盒操作说明进行提取。用1.0%琼脂糖凝胶电泳检测所提取的菌株基因组DNA质量,并用核酸浓度测试仪测定其浓度后贮存于-20 ℃冰箱,备用。
1. 3 ISSR遺传多样性分析
1. 3. 1 ISSR引物筛选 从加拿大哥伦比亚大学公布的ISSR引物序列中随机选取60条引物(周延清,2005),并委托生工生物工程(上海)股份有限公司合成。先用60条ISSR引物对不同地理来源和不同寄主的8株菌株DNA模板进行扩增,以筛选出有较多条带、条带多态性及重复性好的引物。再用筛选出的引物对44株供试菌株进行ISSR PCR指纹图谱分析。
1. 3. 2 ISSR PCR反应及电泳 反应体系25.0 μL:30 ng/μL DNA模板1.0 μL,10 μmol/L引物1.0 μL,10 mmol/L dNTP 0.5 μL,Taq Buffer 2.5 μL,25 mmol/L MgCl2 2.0 μL,5 U/μL Taq酶0.2 μL,ddH2O 17.8 μL。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,退火温度42~48 ℃(退火温度根据引物设定),退火时间45 s,72 ℃ 2 min,进行45个循环;72 ℃延伸15 min。
PCR扩增产物检测:配制1.8%琼脂糖胶,待琼脂糖胶的温度冷却至60 ℃左右时,根据琼脂糖胶的体积按比例加入一定量的核酸染料,轻轻摇匀后倒入制胶板内。待胶板完全凝固后,取5.0 μL PCR反应产物点样。电泳(100 V,80 mA)3.5 h后,将胶板移至UVItec®凝胶成像系统上观察PCR产物电泳结果并拍照。
1. 4 数据处理
观察各引物对每株菌株的扩增电泳图谱,统计每条引物的扩增条带数,记录条带(有条带的记为1,无条带的记为0),形成0、1矩阵。利用NTSYSpc (Version 2.10e)计算不同菌株间的遗传相似系数,采用非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)构建系统发育聚类图,并进行聚类相关分析。利用PopGene(Version 1.32)分析不同地理来源和寄主来源菌株的遗传分化程度。多态率计算公式:
多态率(%)=多态性条带数扩增条带数×100
2 结果与分析
2. 1 引物筛选结果
利用60条ISSR引物扩增8株菌株的DNA模板,从中筛选出10条扩增条带清晰、条带数多、重复性好的引物(表2)。
2. 2 ISSR扩增结果
利用筛选出的10条引物对44株菌株DNA目标进行扩增,共标记出109条DNA条带,条带大小介于250~3000 bp,其中多态性条带有101条,多态率为83.33%~100.00%,平均多态率为92.66%。其中,以引物HBH(AG)7扩增的条带数最多(图1),达13条,多态性条带为12条,多态率92.31%。
2. 3 ISSR标记的菌株聚类分析结果
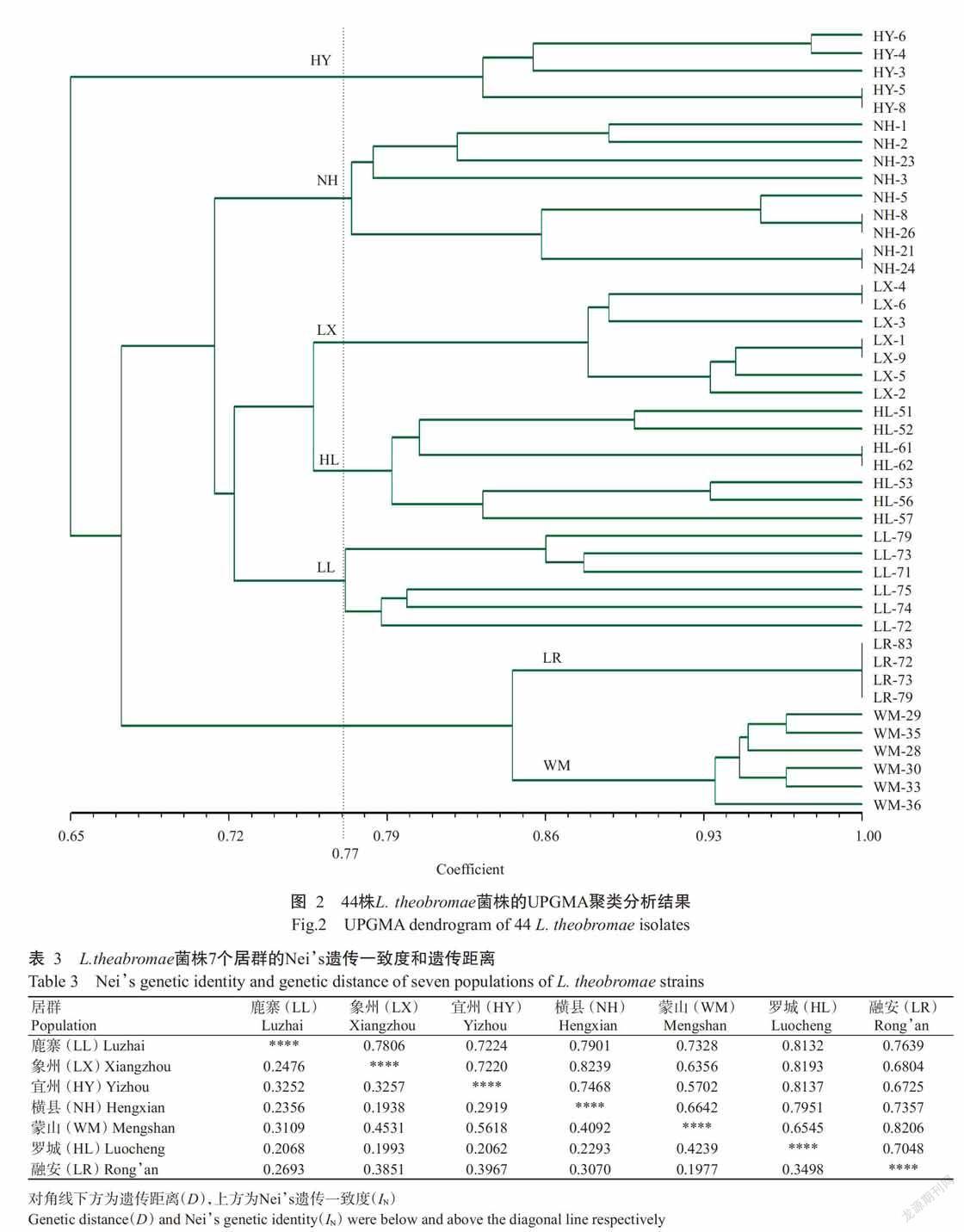
采用NTSYSpc 2.10e统计ISSR标记的数据,计算遗传相似系数,并用UPGMA构建系统发育聚类图(图2)。聚类图中,遗传相似系数越小,表明菌株间亲缘关系越远;遗传相似系数越大,表明菌株间亲缘关系越近。图2显示,来源于不同地理来源的44株L. theobromae菌株被划分为7个居群(表1),遗传相似系数在0.65~1.00,平均为0.83。当聚类图以遗传相似系数0.77(L虚线)为阈值时,所有菌株分别处在6个分支上。其中,来自融安(LR)和蒙山(WM)的菌株聚在一起,其他居群的菌株分别独立聚在一个分支上。44株L. theobromae菌株的ISSR标记聚类结果表明,参试菌株的遗传多样性水平与菌株的地理来源有很大的相关性,不同地理来源的菌株,其遗传相似性低,遗传分化程度高。
2. 4 基于ISSR标记的菌株群体遗传分化分析结果
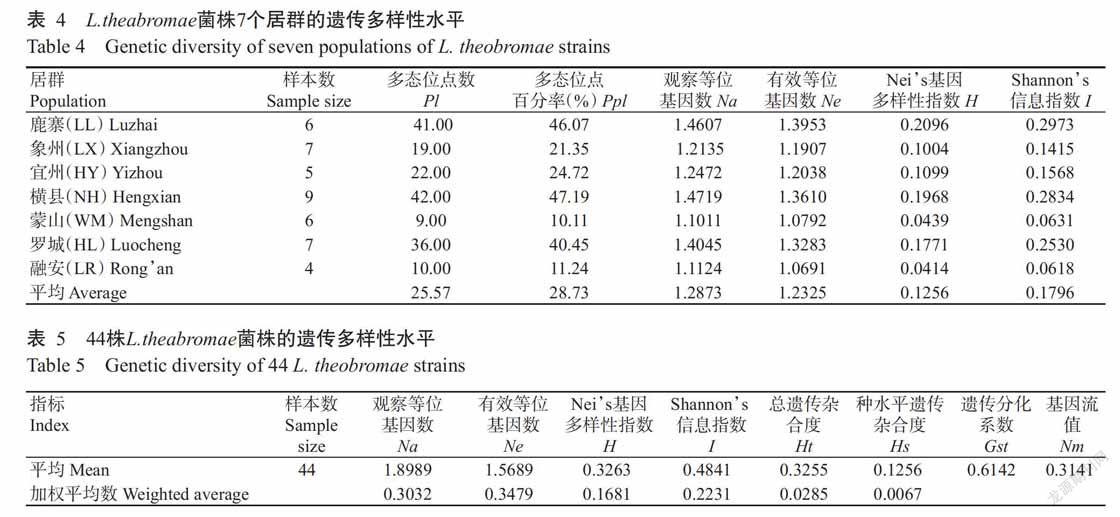
利用PopGene计算各居群的遗传距离(D)和Nei’s遗传一致度(IN),结果(表3)显示,7个居群的遗传一致度为0.5702~0.8239,平均为0.7363;遗传距离为0.1938~0.5618,平均为0.3108。7个居群中,宜州(HY)居群的L. theobromae菌株群体和蒙山(WM)居群的L. theobromae菌株群体的遗传距离最远(D为0.5618),遗传一致度最低(IN为0.5702),说明这2个居群间的遗传分化程度最高,亲缘关系较远;而横县(NH)居群的L. theobromae菌株群体和象州(LX)居群的L. theobromae菌株群体遗传一致度最高(IN为0.8239),遗传距离最短(D为0.1938),说明这2个居群间的遗传分化程度低,亲缘关系较近。
2. 5 基于ISSR标记的菌株群体多样性分析结果
利用PopGene对7个居群的遗传多样性参数进行分析,结果(表4)显示,7个居群的平均多态位点数(Pl)为25.57个,平均多态位点百分率(Ppl)为28.73%,平均观察等位基因数(Na)为1.2873,平均有效等位基因数(Ne)为1.2325,平均基因多样性指数(H)为0.1256,平均Shannon’s信息指数(I)为0.1796。其中,NH居群的Pl最多,达42.00个,Ppl为47.19%;WM居群的Pl和Ppl最低。居群内的遗传多样性以LL居群的菌株最高,其I为0.2973,LR居群的I最低,为0.0618。
由表5可知,参试的44株L. theobromae菌株在种级水平的Na为1.8989,Ne为1.5689,H为0.3263,I为0.4841,菌株的总杂合度(Ht)平均为0.3255,种水平遗传杂合度(Hs)为0.1256,遗传分化系数(Gst)平均为0.6142,基因流(Nm)为0.3141。
对经比表4和表5中各项遗传多样性参数可知,居群内菌株的平均H(0.3263)和I(0.4841)均高于居群间的平均H(0.1256)和I(0.1796),说明居群内的遗传丰富多样,遗传分化程度高于7个居群间的遗传分化程度,菌株的遗传多样性程度较高。
3 讨论
研究表明,部分真菌菌株的遗传多样性与菌株的地理来源无相关性,也有部分真菌的遗传多样性与菌株的地理来源间存在一定联系。Shah等(2010)研究了来源于印度梨树的30株L. theobromae菌株遗传多样性,发现来自不同地理来源的菌株间遗传多样性丰富,而来自同一地理来源的菌株遗传相似性高。Nghia等(2012)利用ISSR分子标记分析了来自橡胶树的20株B. theobromae菌株的遗传多样性,16条引物共标记出214条DNA条带,多态性条带为164条,平均多态率为76.6%;UPGMA聚类结果显示,20株菌株被分为4个不同类群,类群划分与菌株的地理来源有关。Prajapati和Patil(2015)的研究表明,9株来自印度不同麻风树栽培地区的L. theobromae菌株被分为两个类群,该类群划分与菌株的地理来源无显著联系。Qiu等(2015)利用ISSR分子标记研究了葡萄座腔菌科Diplodia seriata、Neofusicoccum parvum、B. dothidea和L. theobromae 4個种不同地理来源的171株菌株遗传多样性和遗传分化,结果发现同一地理来源的L. theobromae菌株间存在明显遗传变异。本研究中来源于广西不同桑树种植区的44株L. theobromae菌株被划分为7个居群,UPGMA聚类显示居群划分与地理来源有关,与Nghia等(2012)的研究结果相似;本研究ISSR分子标记结果显示菌株间的遗传多样性丰富,菌株间的遗传分化水平显著高于居群的遗传分化水平,与Qiu等(2015)的研究结果相似。
Burgess等(2003)研究了来自桉树、松树和麻黄属植物的L. theobromae菌株遗传多样性,发现菌株的SSR类群划分与寄主具有紧密关系。广西是我国的桑树种植大省(区),各市县种植的桑树品种较多且不尽相同(谢红辉等,2016)。本研究中的试验菌株主要在冬季采样分离获得,采样时桑树已经落叶完毕,很难辨认其品种,因此菌株的寄主必然包含有不同的桑树品种。但L. theobromae作为桑毛色二孢根腐病的病原菌,其遗传分化水平是否与不同桑树品种有关尚需进一步验证。
群体间的遗传变异程度用遗传变异系数(Gst)表示,当遗传变异系数值在0.15以上时,遗传分化主要表现于群体内(Chen et al.,2015)。基因流即基因在群体中运动,指某群体的部分个体迁移到另一群体时会把某基因带入新群体,从而产生基因流动,基因流越大,群体间的相似性越大;基因流动是影响群体与群体、群体内部不同个体间遗传变异水平的重要因素(曲若竹等,2004)。群体间的Nm小于1,有限的基因流会促使群体发生遗传分化;而Nm大于1,则会阻止群体间发生遗传分化(杨光伟等,2003)。Mohali等(2005)分析了来自不同地理和寄主的L. theobromae菌株的基因流动和种群遗传多样性,发现L. theobromae在针叶树和阔叶树的不同种寄主间有较强的基因流动,说明寄主间的菌株遗传相似性高,而来源于委内瑞拉、墨西哥和南非的L. theobromae种群具有一定遗传距离。墨西哥、委内瑞拉和南非居群的基因流动频繁,可能是由于委内瑞拉和南非等亚热带国家的松树种子来源于墨西哥,而墨西哥種子中的一些优势菌株的基因型在其他国家或地区广泛繁殖。Al-Sadi等(2013)研究了来自阿曼和阿联酋椰枣、柑橘和芒果树的64株L. theobromae菌株的遗传多样性,AFLP聚类分析结果显示所有菌株被分为4个类群,分子方差(AMOVA)分析结果显示来自芒果、柑橘和椰枣上的L. theobromae遗传分化程度低。这可能是由于阿曼和阿联酋两国间频繁交换种植材料,寄主上的L. theobromae菌随着种植材料的频繁交换而不断发生基因流动。本研究中,44株L. theobromae菌株间的Gst值(0.6142)大于0.15,而Nm(0.3141)小于1,进一步说明居群间的遗传变异程度低,而菌株间的遗传变异程度较高,遗传分化大,遗传多样性丰富。
4 结论
广西地区桑毛色二孢根腐病菌菌株具有较高的多态性,菌株间的遗传多样性高于居群,遗传多样性与菌株的地理来源有关。
参考文献:
陈小莉. 2015. 芒果采后蒂腐菌可可球二孢毒性分化与遗传多样性分析[D]. 海口:海南大学.[Chen X L. 2015. Preliminary study on the virulence variation and genetic diversity of Botryodiplodia theobromae to stem-end rots for the mango[J]. Haikou: Hainan University.]
何雪梅,孙健,梁贵秋,邱长玉,李丽,李昌宝,郑凤锦,盛金凤,李杰民,刘国明. 2017. 广西蚕区16个桑树品种的桑枝药用品质评价[J]. 蚕业科学,43(3):453-458. [He X M,Sun J,Liang G Q,Qiu C Y,Li L,Li C B,Zheng F J,Sheng J F,Li J M,Liu G M. 2017. Officinal quality evalua-tion of mulberry branches from 16 mulberry varieties grown in Guangxi sericultural areas[J]. Science of Sericulture,43(3): 453-458.]
胡美姣,杨冬平,杨波,李敏,高兆银,张正科,蒲金基. 2012. 芒果树回枯病病原菌鉴定及其生物学特性研究[J]. 热带作物学报,33(1):122-126. [Hu M J,Yang D P,Yang B,Li M,Gao Z Y,Zhang Z K,Pu J J. 2012. Identification and biological characteristics of the blight pathogen of mango tree[J]. Chinese Journal of Tropical Crops,33(1):122-126.]
蒲冠勤,黄艳君,毛建萍,张月季. 2012. 中国桑树病害名录(Ⅰ)[J].中国蚕业,33(2):21-24. [Pu G Q,Huang Y J,Mao J P,Zhang Y J. 2012. China mulberry diseasees (Ⅰ)[J]. China Sericulture,33(2):21-24.]
曲若竹,侯林,吕红丽,李海燕. 2004. 群体遗传结构中的基因流[J]. 遗传,26(3): 377-382. [Qu R Z,Hou L,Lü H L,Li H Y. 2004. The gene flow of population genetic structure[J]. Hereditas,26(3):377-382.]
谢红辉. 2016. 桑毛色二孢根腐病的病原、发生规律及其防治研究[D]. 南宁:广西大学. [Xie H H. 2016. Studies on the pathogen,occurrence pattern and control of mulberry Lasiodiplodia root rot[D]. Nanning: Guangxi University.]
謝红辉,韦继光,黄穗萍,陈潇航,磨长寅,罗基同,杨秀好,谭学锋. 2016. 一种新发现的桑树根腐病的发生规律及光照对病原菌生长的影响[J]. 蚕业科学,42(1):45-52. [Xie H H,Wei J G,Huang S P,Chen X H,Mo C Y,Luo J T,Yang X H,Tan X F. 2016. Occurrence regularity of mulberry root rot disease caused by a fungal pathogen and the effects of illumination on pathogen growth[J]. Science of Sericulture,42(1): 45-52.]
杨光伟,冯丽春,敬成俊,余茂德,向仲怀. 2003. 桑树种群遗传结构变异分析[J]. 蚕业科学,29(4):323-329. [Yang G W,Feng L C,Jing C J,Yu M D,Xiang Z H. 2003. Analy-sis of genetic structure variance among mulberry(Morus L.) populations[J]. Science of Sericulture,29(4):323-329.]
周延清. 2005. DNA分子标记技术在植物研究中的应用[M]. 北京:化学工业出版社. [Zhou Y Q. 2005. Application of DNA molecular marker technology in plant research[M]. Beijing:Chemical Industry Press.]
Al-Sadi A M,Al-Wehaibi A N,Al-Shariqi R M,Al-Hammadi M S,Al-Hosni I A,Al-Mahmooli I H,Al-Ghaithi A G. 2013. Population genetic analysis reveals diversity in Lasiodiplodia species infenction date palm,Citrus,and mango in Oman and the UAE[J]. Plant Disease,97(10): 1363-1369.
Burgess T I,Wingfield M J,Wingfield B D. 2003. Development and characterization of microsatellite loci for the tropical tree pathogen Botryosphaeria rhodina[J]. Molecu-lar Ecology Notes,3(1): 91-94.
Chen Z D,Huang R K,Li Q Q,Wen J L,Yuan G Q. 2015. Development of pathogenicity and AFLP to characterize Fusarium oxysporum f. sp. momordicae isolates from bi-tter gourd in China[J]. Journal of Phytopathology,163(3): 202-211.
Mohali S,Burgess T I,Wingfield M J. 2005. Diversity and host association of the tropical tree endophyte Lasiodiplodia theobromae revealed using simple sequence repeat markers[J]. Forest Pathology,35(6): 385-396.
Nghia N A,Chi V T Q,Dong N X. 2012. Molecular analysis of Botryodiplodia theobromae isolates from rubber in Vietnam using rDNA ITS sequencing and ISSR markers[C]//IRRDB International Rubber Conference:28-31.
Phillips A,Alves A,Correia A,Luque J. 2005. Two new species of Botryosphaeria with brown,1-septate ascospores and Dothiorella anamorphs[J]. Mycologia,97(2):513-529.
Prajapati H N,Patil R K. 2015. Diversity analysis of Lasiodiplodia theobromae inciting root and collar rot of Jatropha curcas using molecular tools[J]. Indian Phytopatho-logy,68(3): 305-310.
Qiu Y,Steel C C,Ash G J,Savocchia S. 2015. Hierarchical genetic variation of Botryosphaeriaceae species associa-ted with decline and dieback of grapevine in south eas-tern Austria[J]. Australian Journal of Grape and Wine Research,21(3):1-10.
Safdar A,Khan S A,Safdar M A. 2015. Pathogenic association and management of Botryodiplodia theobromae in guava orchards at Sheikhupura District,Pakistan[J]. International Journal of Agriculture and Biology,17(2):297-304.
Shah M U D,Verma K S,Singh K,Kaur R. 2010. Morpholo-gical,pathological and molecular variability in Botryodiplodia theobromae(Botryosphaeriaceae) isolates associa-ted with die-back and bark canker of pear trees in Punjab,India[J]. Genetics and Molecular Research,9(2): 1217-1228.
Sreerama K P,Singh L. 2009. Lasiodiplodia theobromae is a mycoparasite of a powdery mildew pathogen[J]. Mycobio-logy,37(4):308-309.
Tan Y H,Vadamalai G,Wong M Y,Naderali N. 2012. Inter simple sequence repeat(ISSR) primers for effective genetic polymorphism determination in Lasiodiplodia theobromae infecting Jatropha curcas in Malaysia[C]//International Conference on Science,Technology & Social Scien-ces(ICSTSS),Kuantan,Pahang,Malaysia:737-741.
Xie H H,Wei J G,Liu F,Pan X H,Yang X B. 2014. First report of mulberry root rot caused by Lasiodiplodia theobromae in China[J]. Plant Disease,98: 1581.
(責任编辑 麻小燕)

