银黄—聚乙烯醇注射液稳定性研究
伍涛 李茂婷 邓余 曹政 闫志强 朱买勋


摘 要:通过添加稳定剂聚乙烯醇(Polyvinyl alcohol,PVA),有效解决银黄注射液的稳定性问题。通过影响因素试验和加速试验对银黄注射液的性状、pH、鉴别及含量进行稳定性考察。结果表明:在高温(60℃)、低温(4℃)和强光照射(4500±500 lx)的影响因素试验和6个月的加速试验(温度40±2℃、湿度75%±5%)条件下,按药典标准制备银黄注射液(对照组)的黄芩苷含量虽变化不显著,性状和鉴别也符合要求,但pH值和绿原酸含量均不稳定,呈显著性变化;而银黄聚乙烯醇注射液(试验组)的pH值、绿原酸、黄芩苷含量稳定,变化均不显著,性状和鉴别也符合要求。這说明在银黄注射液配方中加入质量比为2%的PVA,再调整注射液pH值至5.5~7.0,所制备得到的银黄聚乙烯醇注射液,比药典标准银黄注射液更加稳定有效。
关键词:银黄注射液;聚乙烯醇;绿原酸;稳定性
中图分类号:R283.1 文献标志码:A 文章编号:0253-2301(2019)11-010
DOI: 10.13651/j.cnki.fjnykj.2019.11.010
Study on the Stability of Yinhuangpolyvinyl alcohol Injection
WU Tao1, LI Maoting2, DENG Yu1, CAO Zheng1, YAN Zhiqiang1, ZHU Maixun1
Abstract: The stability of yinhuang injection was effectively solved by adding the stabilizer polyvinyl alcohol. The stability of yinhuang injection was investigated through the influencing factor test and accelerated test. The results showed that under the conditions of influence factor test with high temperature (60℃), low temperature (4℃) and strong light exposure (4500±500 lx), and accelerated test of 6 months (with temperature of 40±2℃ and humidity of 75%±5%), the change of baicalin content in yinhuang injection prepared according to pharmacopeia standards (control group) was not significant, and the traits and identification also met the requirements, while the pH value and chlorogenic acid content were not stable with significant changes. However, the pH value, chlorogenic acid and baicalin content of yinhuangpolyvinyl alcohol injection (treatment group) were stable with no significant changes, and the traits and identification were also in line with the requirements. This indicated that the yinhuangpolyvinyl alcohol injection by adding 2% PVA in the formula and adjusting the pH value of the injection to 5.5-7.0 was more stable and effective than the yinhuang injection prepared according to pharmacopoeia standard.
Key words: Yinhuang injection; Polyvinyl alcohol; Chlorogenic acid; Stability
银黄注射液主要由金银花提取物绿原酸和黄芩提取物黄芩苷制成。黄芩苷化学性质较稳定,但绿原酸在提取和入药后容易因水解和分子内酯基迁移发生异构或氧化降解而影响疗效[1],这主要是因为绿原酸是由咖啡酸和奎尼酸形成的酯[2],其分子结构中有酯键、不饱和双键和多元酚3个不稳定部分[3]。近年来,一些科研人员在研究绿原酸稳定性时发现,绿原酸在加入亚硫酸氢钠、L半胱胺酸盐、铜离子络合物[4]、氢氧化钙[5]、β环糊精[6]等物质以及在酸性条件下较稳定,因此可以通过添加适当的稳定剂或抗氧化剂到银黄注射液中,并调整pH值,以确保绿原酸不降解,提高银黄注射液的稳定性。聚乙烯醇(Polyvinyl alcohol,简称PVA)是一种富含羟基的高分子聚合物,具有多元醇的典型化学性质,能进行酯化、醚化及缩醛化等反应,PVA常作为水溶性缓释载体材料广泛用于制药行业[7],但作为稳定剂用于中药注射液却未见报道。本试验通过将PVA作为稳定剂加入到银黄注射液中,利用PVA含有的OH基团抑制绿原酸酯键水解和分子内酯基迁移,提升银黄注射液中绿原酸含量的稳定性。
1 材料与方法
1.1 试验材料
1.1.1 标准品 黄芩苷对照品,95.9%,中国兽医药品监察所提供,批号Z0271404;绿原酸对照品,97.3%,中国兽医药品监察所提供,批号Z0261407。
1.1.2 对照组供试品 按照《兽药质量标准》(2017年版,中药卷)银黄注射液制法[8]分别制作3批对照组供试品(每批20瓶),自编批号2018071302、2018071401和2018071701。
1.1.3 试验组供试品 在前期研究基础上,按表1配方制备试验组供试品。
制备工艺为:(1)取适量注射用水,加入氢氧化钠溶解后,加入黄芩提取物溶解,并调节pH<8.0,过滤备用;(2)在适量注射用水加入配方量聚乙烯醇并充分溶解,再加入金银花提取溶解,过滤备用;(3)合并(1)(2)液,用注射用水定容至1000 mL,调节pH至5.5~7.0,过滤,分装至安瓶中,灭菌即得,自编批号为2018071201。最后再按此配方工艺,再配制2个批次试验品(每批20瓶),自编批号2018071202、2018071301。
1.2 试验仪器
PHS3C型精密pH计(上海雷磁仪器厂);269524872475高效液相色谱仪[沃特世科技(上海)Waters有限公司];ZF2型三用紫外仪(上海市安亭电子仪器厂);YB2型澄明度检测仪(天津大学精密仪器厂);DHG9240A电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司);SHH100GD药品强光照射试验箱(重庆市永生试验仪器厂);LSC528BW立式冷藏陈列柜(浙江星星家电股份有限公司)。
1.3 试验方法
1.3.1 影响因素试验 为减小试验误差,将同1 d制备的2种供试品[编号为2018071302(对照组)和2018071301(供试组)]放置于高温(60℃)、低温(4℃)和强光照射[(4500±500)lx]条件下,开展影响因素试验。分别于第0、5、10 d取样,考察各组供试品性状、pH值、鉴别、含量。
1.3.2 加速试验 取全部批次供试品,放置于温度(40±2)℃、湿度(75±5)%条件下,于第0、1、2、3、6个月末取样,考察各组供试品性状、pH值、鉴别、含量。
1.4 检测指标
对照组供试品和试验组供试品的性状、pH值、鉴别和含量4种主要质量控制项目均参考《兽药质量标准》(2017年版,中药卷)银黄注射液项下标准[8]进行考察。(1)性状。为棕黄色至棕红色的澄明液体。(2)pH值。应为5.5~7.0。(3)鉴别。取供试品1mL,加75%乙醇9mL,摇匀,作为供试品溶液。另取黄芩苷标准品与绿原酸标准品,分别加甲醇制成每1mL含1.0、0.3mg的溶液,作为标准品溶液。吸取上述3种溶液各2 μL,分别点于同一聚酰胺薄膜上,以醋酸为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。供试品色谱中,在与黄芩苷标准品色谱相应的位置上,显相同颜色的斑点;在与绿原酸标准品色谱相应的位置上,显相同颜色的荧光斑点,记录结果。(4)含量测定。均采用高效液相色谱法测定。本试验参考国家标准[8]并结合临床使用效果,每毫升供试品绿原酸和黄芩苷含量分别不少于1.7mg和18.0mg视为合格。金银花提取物色谱条件与系统适用性试验:以十八烷基硅烷键合硅检为填充剂;以乙腈0.4%磷酸溶液(10∶90)为流动相;检测波长为327nm。理论塔板数按绿原酸峰计算应不低于2000。黄芩提取物色谱条件与系统适用性试验:以十八烷基硅烷键合硅检为填充剂;以甲醇水磷酸(50∶0.2)为流动相;检测波长为274nm。理论塔板数按黄芩苷峰计算应不低于2500。
1.5 数据统计方法
用SPSS15.0软件对试验数据进行单因素方差分析。
2 结果与分析
2.1 影响因素试验
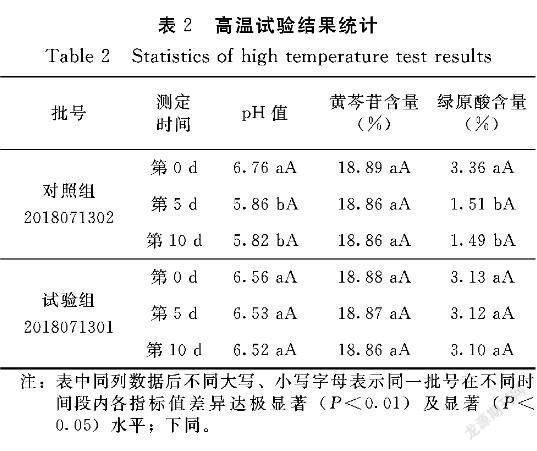
2.1.1 高温试验 从表2可以看出,供试品在第0d、第5d和第10d的鉴别均符合标准,外观性状均为棕红色澄明液体,黄芩苷含量差异均不显著。在高温(60℃)试验条件下,随时间推移,对照组pH值和绿原酸含量出现显著性变化,不稳定,而黄芩苷含量变化不显著,性状和鉴别符合要求;试验组pH值、绿原酸、黄芩苷变化不显著,性状和鉴别符合要求。因此说明,试验组pH值、绿原酸含量比对照组更稳定。
注:表中同列数据后不同大写、小写字母表示同一批号在不同时间段内各指标值差异达极显著(P<0.01)及顯著(P<0.05)水平;下同。
2.1.2 低温试验 从表3可以看出,供试品在第0d、第5d和第10d的鉴别均符合标准,外观性状均为棕红色澄明液体,黄芩苷含量差异均不显著。在低温(4℃)试验条件下,随时间推移,对照组pH值和绿原酸含量出现显著性变化,不稳定,而黄芩苷含量变化不显著;试验组pH值、绿原酸、黄芩苷变化不显著,性状和鉴别符合要求。因此说明,试验组pH值、绿原酸含量比对照组更稳定。
2.1.3 强光照射试验 从表4可以看出,供试品在第0d、第5d和第10d的鉴别均符合标准,外观性状均为棕红色澄明液体,黄芩苷含量差异均不显著。在强光照射[(4500±500)lx]试验条件下,随时间推移,对照组pH值和绿原酸含量出现显著性变化,不稳定,而黄芩苷含量变化不显著,性状和鉴别符合要求;试验组pH值、绿原酸、黄芩苷变化不显著,性状和鉴别符合要求。因此说明,试验组pH值、绿原酸含量比对照组更稳定。
2.2 加速试验
从表5可以看出,供试品性状无明显变化,均为棕红色澄明液体,鉴别均符合标准,黄芩苷含量稳定。在6个月的加速试验条件下,对照组pH和绿原酸含量出现显著性变化,不稳定,而黄芩苷含量变化不显著,性状和鉴别符合要求;试验组pH值、绿原酸、黄芩苷变化不显著,性状和鉴别符合要求。因此说明,试验组pH值、绿原酸含量比对照组稳定。
3 结论与讨论
在高温(60℃)、低温(4℃)和强光照射[(4500±500)lx]的影响因素试验和6个月的加速试验[温度(40±2)℃、湿度75%±5%]条件下,按药典标准制备的银黄注射液黄芩苷含量虽变化不显著,性状和鉴别也符合要求,但pH值和绿原酸含量均不稳定,呈显著性变化;而银黄聚乙烯醇注射液pH值、绿原酸、黄芩苷含量稳定,变化均不显著,性状和鉴别也符合要求。这说明在银黄注射液配方中加入质量比为2%的PVA,再调整注射液pH值至5.5~7.0,所制备得到的银黄聚乙烯醇注射液,比药典标准银黄注射液更加稳定有效。
黄芩提取物不溶于水,溶于氢氧化钠试液,化学稳定性较好[9-10]。金银花提取物易溶于水,但有效成分绿原酸仅在pH<4.0环境中较稳定(pH=3.0稳定性最好),随pH值上升绿原酸则快速降解[11]。此外,绿原酸具有酯键和多元酚结构,酯键易水解形成咖啡酸和奎宁酸,多元酚中的酚羟基又易被氧化致使绿原酸含量下降[12],因此银黄注射液pH值和绿原酸的稳定性是影响银黄注射液稳定性的关键。鉴于银黄注射液质量标准要求和黄芩稳定性(随pH降低黄芩溶解度降低,导致黄芩析出),因此将银黄注射液pH值控制在6.5~7.0范围[13-14],即可有效抑制绿原酸结构中的酯键水解和多元酚氧化,又可保证黄芩不析出。PVA是富含OH基团的多羟基聚合物,能有效抑制酯键的水解反应和降低多元酚酚羟基的氧化几率,因此将PVA作为稳定剂加入到银黄注射液中,对其pH值和绿原酸的稳定性具有良好作用。同时,将本试验结果与其他研究结果对比发现[4-6],本试验制备的银黄聚乙烯醇注射液更加稳定,而且生产工艺简单可行,所涉及原辅料成本低廉易得,通过验证,各方面指标都能够达到理想要求,具有良好的开发前景。参考文献:
[1]李云,周明眉,邢丽娜,等.绿原酸的肠道菌群代谢研究进展[J].中草药,2015,46(4):610-614.
[2]SATO Y,ITAGAKI S,KUROKAWA T,et al.In vitro and in vivo antioxidant properties of chlorogenic acid and caffeic acid[J].International Journal of Pharmaceutics,2011,403(1-2): 136-138.
[3]张英锋,张立艳,马子川,等.植物绿原酸的研究进展[J].化学教育,2011,4(2):1-6.
[4]涂北平,赖卫平.高纯度绿原酸的稳定性研究[J].江西化工,2011,4(50):52-54.
[5]CHEN G,HOU S X,HU P,et a1.Studies on stability of chlorogenic acid in extract of Flos lonicerae[J].China Journal of Chinese Materia Medica,2003,28(3):223-226.
[6]孙健,陆彦,吴国娟,等.绿原酸注射剂的稳定性试验[J].黑龙江畜牧兽医(科技版),2013,9(5):127-129.
[7]余磊,李银保,张剑.水溶性聚乙烯醇在药物缓释中应用进展[J].赣南医学院学报,2016,6(36):975-979.
[8]中国兽药典委员会.兽药质量标准[M].中药卷.北京:中国农业出版社,2017:257-258.
[9]TRINH H,YOO Y,WON K H,et al.Evaluation of invitro antimicrobial activity of Artemisia apiacea H.and Scutellaria baicalensis G.extracts[J].Journal of Medical Microbiology,2018,67(4):489-495.
[10]LIU R .WaterInsoluble Drug Formulation[M].Second Edition.Boca Raton:CRC Press,2008:1-3.
[11] 朱鵬,苗潇磊,陈勇.绿原酸、隐绿原酸和新绿原酸在中性和碱性pH条件下的降解动力学[J].药学学报,2016,51(1):122.
[12]宁正祥,赵谋明.食品生物化学[M].第2版.广州:华南理工大学出版社,2006:356.
[13]陈 刚,侯世祥,胡平,等.金银花提取物中绿原酸的稳定性研究[J].中国中药杂志,2003,3(28):223-226.
[14]林冠雄,廖荣寿.银黄注射液制剂工艺对pH最佳值选择的研究[J].海峡药学,2006,18(2):31-32.
(责任编辑:柯文辉)
收稿日期:2019-10-28
作者简介:伍涛,男,1982年生,硕士,助理研究员,主要从事兽医药理与药剂研究。
基金项目:重庆市畜牧科技研究与推广项目(19532)。

