番茄根内生细菌的促生及其优势种群的筛选和分析
黎烨 熊娟 张婷 金玲月 桂楚伊 田宝玉

摘 要:以從番茄植株分离出的46株内生细菌为研究对象,采用番茄根内生细菌单独侵染番茄种子,并研究其对番茄植株生长的影响,进一步利用测试内生细菌的16S rDNA序列结合之前公开番茄根内核心OTU(Operational Taxonomic Unit)序列构建系统发育树,分析主要促生长内生细菌的种类与丰度。促生试验表明,测试内生细菌均对番茄植株鲜重均有促进作用,其中芽孢杆菌(3株)、假单胞菌(2株)、黄单胞菌(1株)以及根瘤菌(2株)对番茄植株的鲜重具有显著性促进(P<0.05),而GF12与对照相比对鲜重的促进最为显著(P<0.01),GF12内生细菌对番茄植株鲜重的增加为对照的1.69倍;对株高具有显著性促进的内生菌株共有9株,分属芽孢杆菌(5株)、假单胞菌(2株)、黄单胞菌(1株)以及根瘤菌(1株),与对照相比CZ29在促进株高伸长极显著(P<0.01),CZ29侵染后番茄株高为对照组的1.46倍;此外,测试内生细菌中8株促进番茄根的伸长,其中MR56、GF12和CZ29侵染后的番茄根长比对照组根长超出15%以上。对46株内生细菌16S rDNA序列与番茄根内生细菌前100核心OTU序列进行系统发育分析结果表明,测试内生细菌聚类到假单胞菌目、肠杆菌目、根瘤菌目、伯克氏菌目、芽孢杆菌目、黄单胞菌目以及黄杆菌目。此外聚类到假单胞菌目和根瘤菌目的内生细菌分别与番茄根内高丰度的OTU_3(Pseudomonas)和OTU_23(Rhizobium)聚在一起,表明测试假单胞菌以及根瘤菌是番茄根内主要促生效果的核心类微生物。分离到的具有促生的芽孢杆菌种类最多,但假单胞菌和根瘤菌在根内丰度较高,作为健康番茄根内生微生物组中最主要的群体,因此芽孢杆菌、假单胞菌以及根瘤菌具有巨大促生潜力,可以作为生物菌肥探索为宿主提供营养,并合理开发利用微生物资源以更好发展农业。
关键词:番茄;内生细菌;盆栽;促生长;优势种群
中图分类号:S476 文献标志码:A 文章编号:0253-2301(2019)11-003
DOI: 10.13651/j.cnki.fjnykj.2019.11.003
Screening and Analysis on the Growth Promotion of Endophytic Bacteria in Tomato Roots and its Dominant Population
LI Ye, XIONG Juan, ZHANG Ting, JIN Lingyue, GUI Chuyi, TIAN Baoyu*
Abstract: By taking 46 endophytic bacteria isolated from tomato plants as the research objects, the endophytic bacteria from tomato roots were used to infect the tomato seeds to study the effects on tomato plant growth. Then, the phylogenetic trees were further constructed by using the sequences of the 16S rDNA combined with the previously open OTU (Operational Taxonomic Unit) sequence of tomato root to analyze the species and abundance of major growthpromoting endophytic bacteria. The results of the experiment showed that the tested endophytic bacteria could promote the fresh weight of tomato plants. Bacillus (3 strains), Pseudomonas (2 strains), Xanthomonas (1 strain) and Rhizobium(2 strains) could significantly promoted the fresh weight of tomato plants (P<0.05), while compared with the control group, GF12 has promoted the fresh weight most significantly (P<0.01), and the increase of endophytic bacteria of GF12 on the fresh weight of tomato plants was 1.69 times that of the control group. There were 9 endophytic strains with significant promotion of the plant height, including Bacillus (5 strains), Pseudomonas (2 strains), Xanthomonas (1 strain) and Rhizobium (1 strain). CZ29 significantly promoted the plant height and elongation compared with the control group (P<0.01), and the tomato plant height after the infection of CZ29 was 1.46 times that of the control group. In addition, the tested 8 endophytic bacteria promoted the elongation of tomato roots, among which the tomato root length after the infection of MR56, GF12 and CZ29 was more than 15% longer than that of the control group. The phylogenetic analysis of the 16S rDNA sequence of 46 endophytic bacteria and the first 100 core OTU sequences of endophytic bacteria in tomato roots showed that the tested endophytic bacteria were clustered into Pseudomonadales, Enterobacteriales, Rhizobiales, Burkholderiales, Bacillales, Flavobacteriales and Xanthomanadales. In addition, the endophytic bacteria clustered into Pseudomonas and Rhizobium were clustered together with OTU_3 (Pseudomonas) and OTU_23 (Rhizobium) with high abundance in tomato roots, indicating that Pseudomonas and Rhizobium were the core microorganisms for the main growth promoting effect in tomato roots. There were the most types of probiotic Bacillus isolated which had the effect of promoting growth, but Pseudomonas and Rhizobium were abundant in roots, which were the most important groups in the endophytic microbiome of healthy tomato roots. Therefore, Bacillus, Pseudomonas and Rhizobium had great potential to promote growth, which could be used as biological fertilizer to provide nutrition for the host, and rationally develop and utilize microbial resources to better develop the agriculture.
Key words: Tomato; Endophytic bacteria; Potting; Growthpromoting; Dominant population
植物微生物组作为植物的第二基因组,其在植物的生长发育以及生理活动中发挥的作用受到广泛的关注和研究。植物内生细菌可以从植物周围组织环境中吸取营养来进行生长繁殖,同时也可以通过菌株生长、生理代谢活动等影响植物宿主的生长和发育[1]。由于植物与内生细菌以及内生菌群之间复杂的互作关系,内生细菌在植物促生长以及病害生物防治方面具有较好应用潜力。基于传统的微生物纯培养技术,内生细菌与植物的相互作用,国内外学者已做了大量的研究[2],研究报道内生细菌可以增加宿主抗逆性[3]、分泌生长素[4]、固氮[5]等促进植物生长的作用,并且诸多学者已从许多作物中分离出多种内生细菌,其中以芽孢杆菌Bacillus、假单胞菌Pseudomonas和肠杆菌Enterobacteria最为常见[6]。近年来,随着高通量测序技术的发展,Bulgarelli等[7-8]通过16S扩增子测序揭示拟南芥根的微生物群落结构和核心微生物组,进一步了解植物和核心微生物组之间的互作。结果表明,放线菌、假单胞菌、根瘤菌以及芽孢杆菌是植物根占据较高丰度的主要菌群,并且与宿主的互作机制中表现出特定生态位功能[9]。同样,对一些重要经济作物,如番茄和甘蔗根内细菌群落分析也出现相似的群落组成结构[10-12]。但是,通过宏基因组方法对植物内生细菌的多样性和功能分析大部分是基于整体群落水平以及较高分类水平,很少有工作将内生菌菌群与具体某个种或者植物互作发挥特定功能分析相联系。因此,在植物相关的内生菌群中,很难界定具体哪些菌群对植物发育是有益的,哪些菌群是有害以及哪些菌群处于中立的。
番茄是世界上最主要的果蔬之一。本研究在前期对番茄根内生菌菌群分析和内生菌菌株分离鉴定的基础上,通过在盆栽试验中定量添加内生细菌与番茄生长指标间的相互关系,界定在盆栽试验中对番茄生长具有促进作用的相关内生菌株,筛选对番茄具有促生长作用的内生菌菌株,并通过与番茄根微生物组优势OTUs的聚类和系统发育分析,鉴定具有促生长功能的内生菌是否为番茄根内生菌优势种群。对植物内生菌关键细菌群的功能探索将有助于了解特定内生菌是否对宿主植物有益,以及植物-微生物组-病原体之间的互作机制。此外,这些研究将有助于发现新的内生微生物,可加以开发利用作为潜在的生物防治剂资源,为植物病原体的防治奠定材料和理论基础。
1 材料与方法
1.1 试验材料
番茄品种选用新中蔬4号。将购买的番茄种子用纱布包裹并用75%乙醇溶液消毒1 min,无菌蒸馏水洗涤多次后,再用5%次氯酸钠对番茄种子侵泡10 min,灭活种子表面附着微生物,无菌蒸馏水再次洗涤多次,最后无菌滤纸吸干水分备用。
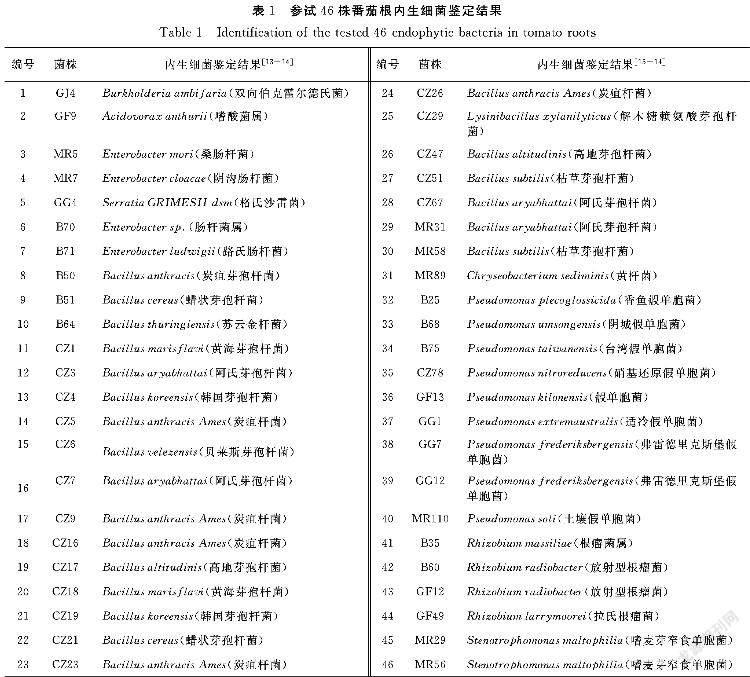
用于盆栽试验的46株番茄根内生细菌(按菌株保藏者姓氏进行编号,如CZ1、GG1等)来自实验室已分离保藏菌株(表1)[13-14]。
1.2 细菌LB培养基
培养基为胰蛋白胨10g,酵母浸出粉5g,NaCl10g,pH值自然,以蒸馏水定容至1L,按每瓶100mL分装于250mL三角瓶中,121℃高压灭菌30 min备用。固体培养基按每100 mL加2 g琼脂粉灭菌后,制备固体培养基平板。
1.3 试验方法
1.3.1 番茄根内生细菌的活化与菌液制备 用接種针分别挑取保藏的菌液少许,在LB固体培养基平板上划线,并于37℃培养箱中培养过夜进行菌株活化。菌株活化后,挑取单克隆分别接种到装有2 mL液体培养基试管中,于37℃、120 r·min-1过夜培养,并通过分光光度计在600 nm条件下测量各菌株的菌浓度,并将各浓度等量化稀释(均稀释到OD600=0.5)备用。
1.3.2 番茄内生细菌对植物促进生长效果的盆栽试验 番茄根内生菌处理种子和植株方法的选择。先采用平板试验筛选6株促生试验效果好的内生菌菌株进行预试验。用以下4种单独或者混合处理测试内生菌对番茄的促生效果:处理(1)菌液浸种;处理(2)种子播下后菌液洒在种子周围土壤中;处理(3)发芽后将菌液洒在芽周围土壤中;处理(4)番茄苗3~4片真叶时将菌液洒在芽周围土壤中,以及处理(1)+(2),处理(1)+(3),处理(1)+(4)进行处理,自然生长1个月,期间分别观察植株生长状态、统计并测量不同方式处理后植株的鲜重、株高以及根长,从而判断不同处理方式的促生效果,对照组,不作任何处理。
基于预试验的结果,选取促生试验效果好的(1)+(2)方案,将发酵培养的46株内生菌菌液等浓度微生物菌悬液分别浸泡10粒番茄种子,每盆种子播下后并将菌液均匀洒在种子周围土壤中,最后在种子上面覆盖薄土层。1个处理3个平行,以鉴定微生物的促生效果;对照组(3盆),不添加任何微生物。按常规方法进行水肥和自然光照与温度管理,待种子发芽出现真叶时,去除多余的幼苗(每盆仅保留3棵植株),后期根据土壤干湿程度进行水分给予,维持土壤良好的湿度环境。整个番茄植株生长的过程中都要定期观察、拍照并做好统计记录,1个月后检查促生效果。
1.3.3 番茄促生长效果的测量与数据统计分析 对完成生长后的番茄植株进行收集,利用金属锹将番茄从盆栽盒拔出,并轻轻抖动防止根毛断裂除去大部分根部散土,随后利用毛刷轻轻除去根部附着较为紧密的土壤,最后利用自来水清洗植株根部并用吸水纸吸干,分别测量番茄植株的株高(顶端到根部的长度),植株根长(根部到根尖的长度)与鲜重,并利用软件SPSS对各试验组的株高、根长以及鲜重与对照组进行显著性检验以判断试验组与对照组是否存在明显差异。
1.3.4 番茄根内生菌和番茄根内优势核心OTU的系统树构建 为了确定促生内生菌在番茄根内的丰度占比与亲缘关系,选取涵盖番茄的主要内生菌群前100个最丰富的OTU序列(V3~V4可变区)与促生细菌的16S rDNA序列(约1500 bp)进行系统发育和聚类分析,其中OTU序列从先前发表的健康番茄根内微生物组数据集提取[10]。使用ClustalX2.1[15]将所有序列通过默认参数进行比对,并在SeaView 4中进行序列编辑[16],使用Mega7构建邻接法系统发育树[17]。
2 结果与分析
2.1 添加根内生细菌与番茄共培养盆栽方案选择
通过用7种不同的处理方法来测试不同的根内生细菌对番茄的促生效果,经试验后最终选择接下来的试验处理方法为菌液浸种,随后将浸泡后的番茄种子播种于盆栽盒里,并用相应的菌液洒在种子附近的土壤中,最后在种子上面覆盖一薄层土。待种子发芽生长至具有2~4片真叶时,去除多余的苗(每盆保留3株同样的植株),再洒相应的菌液(每株番茄苗根部土周围洒1 mL菌液),之后放在室外自然光照条件下培养。
2.2 盆栽条件下添加根内生细菌对番茄生长的促生效果
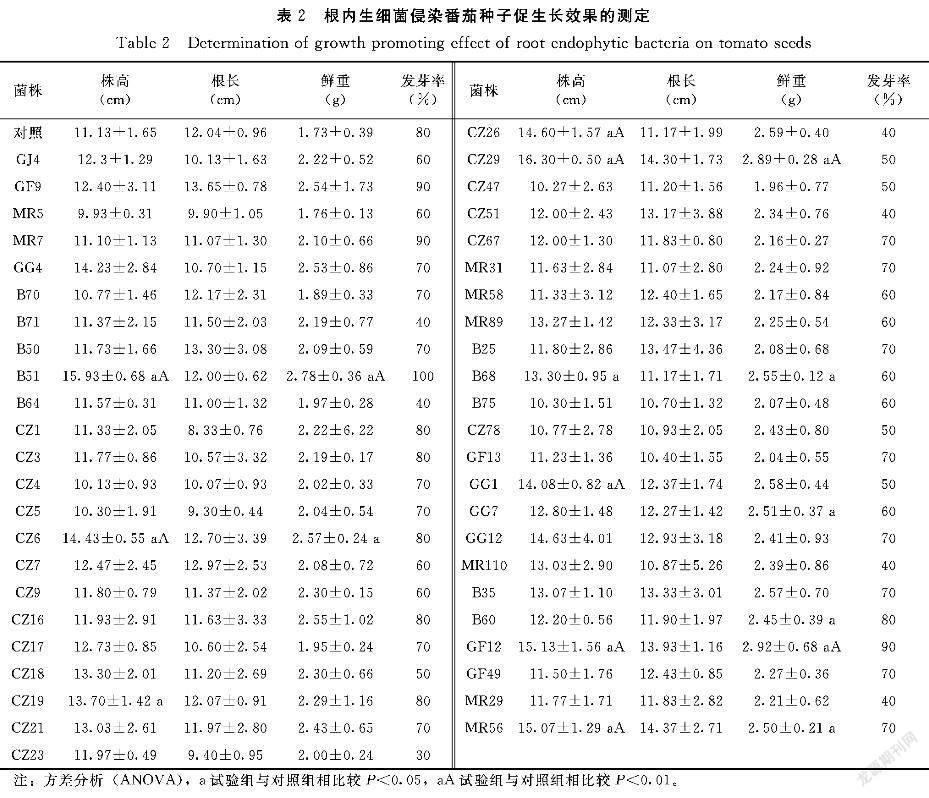
番茄播种并接种相应的内生细菌后将盆栽置于室外自然环境萌发生长,整个生长过程中定期检查番茄植株生长状况、拍照(图1)并做好统计记录(表2),1个月后检查促生效果。
由表2结果可知,盆栽条件下添加不同根内生细菌对番茄的促生长作用不同。(1)所有测试内生细菌均使得番茄植株鲜重增加,与对照相比较CZ6、B68、GG7、B60、MR56、B51、CZ29以及GF12对植株鲜重增加具有显著性促进(P<0.05),包含芽孢杆菌(3株)、假单胞菌(2株)、黄单胞菌(1株)以及根瘤菌(2株),部分内生细菌促进番茄植株鲜重增加极显著(P<0.01),如B51、GF12、CZ29等菌株侵染的植株比对照组的重量高出60%以上(表2),其中GF12(2.92±0.68)g内生细菌对番茄植株鲜重的增加为对照(1.73±0.39)g的1.69倍。(2)有10株内生细菌侵染的番茄植株与对照组相比高出20%以上,其中B51、CZ6、CZ19、CZ26、CZ29、B68、GG1、GF12以及MR56等9株内生细菌对株高伸长具有显著性促进(P<0.05),对株高具有显著促进的内生细菌分属芽孢杆菌(5株)、假单胞菌(2株)、黄单胞菌(1株)以及根瘤菌(1株),促进株高伸长最为显著的为芽孢杆菌CZ29(16.30±0.50cm),侵染后番茄株高为对照组(11.13±1.65cm)的1.46倍,比对照组高出46.45%。(3)有8株内生细菌促进番茄根的伸长,其中接种MR56、GF12和CZ29等3株内生细菌的植物根长比对照组根长超出15%以上。从试验结果发现测试的根内生细菌
侵染的番茄植株与对照组相比部分具有显著性促进植株生长的能力,各内生细菌对植物的促生长作用表现主要体现为促进植株根的伸长、植株整体高度的增加、植株茎秆的加粗以及重量的增加。
2.3 番茄根内生菌和番茄根内优势核心OUT的聚类分析
对测试的46株番茄根内生菌进行系统发育分析,推测这些内生菌在番茄根内生菌中的丰度和所处的地位。聚类结果(图2)显示,46株内生细菌共聚类到3个门7个菌目,分别为伯克氏菌目(2株)、肠杆菌目(5株)、芽孢杆菌目(23株)、黄杆菌目(1株)、假单胞菌目(9株)、根瘤菌目(4株)以及黄单胞菌目(2株)。其中测试芽孢杆菌目内生细菌主要与两类OTU亲缘关系较近,CZ16、B50、CZ21、CZ23、CZ26、CZ59、CZ64以及B51与OTU_14(Bacillus)聚到一支,而CZ29与OTU_80(Planococcaceae)聚为一支,表明分离的番茄根内生芽孢杆菌所属类别较为集中。另外的23株内生细菌主要为肠杆菌目、假单胞菌目以及根瘤菌目,其中,B70、B71、MR5、MR7和GG4与属于肠杆菌目的OTU_35(Salmomella)聚为一支,同样,在根瘤菌目和假单胞菌目的聚类也出现类似结果,测试的4株内生细菌B35、B60、GF12以及GF49与OTU_23(Rhizobium)聚到一块,而同属根瘤菌目的OTU_67(Bosea)、OTU_86(Devosia)、OTU_197(Hyphomicrobium)和OTU_1044(Aurantimonadaceae)聚到另外一支,GG1、CZ78、MR10、B75、B25、GG7、GG12、GF13和B68與OTU_167(Pseudomonas)、OTU_549(Pseudomonas)和OTU_3(Pseudomonas)聚到一支,其中OTU_3(Pseudomonas)在番茄根内丰度较高(高通量测序数据显示OTU_3的在假单胞菌目中归属于优势种群),而OTU_1015(Psychrobacter)和OTU_147(Acinetobacter)等假单胞菌未能和测试假单胞菌聚到一支,表明分离的测试根瘤菌和假单胞菌虽属于高丰度菌类但多样性较低,还有很多根瘤菌以及假单胞菌未能成功分离验证。
3 讨论
据报道,植物根内生细菌可以通过生物合成吲哚乙酸(IAA)促进宿主植物的生长或者调解其生理代谢活动,在内生细菌中主要合成IAA的途径有吲哚3丙酮酸(IPyA)、吲哚3乙酰胺(IAM)、吲哚3乙腈(IAN)和色胺(TAM)等,并且在先前的番茄根微生物组分析中发现大部分核心种群都具有不完整的IAA生物合成途径,只有少数种群具有一个完整的IAA合成途径[10]。通过研究发现,在所测试的番茄根内生细菌中对番茄株高伸长促进极显著(P<0.01)的内生细菌有CZ6、CZ26和CZ29等3株芽孢杆菌、GG1(假单胞菌)以及GF12(根瘤菌),而促进番茄鲜重增加极显著的内生细菌有B51(芽孢杆菌)、CZ29(芽孢杆菌)和GF12(根瘤菌),表明假单胞菌,芽孢杆菌和根瘤菌可能是番茄根内主要的促生菌群。将筛选的内生细菌16S rDNA序列与之前[10]番茄根内100个最丰富的OTU序列进行比对和聚类分析,对番茄株高具有极显著促进作用的根瘤菌菌株GF12,以及假单胞菌菌株GG1分别与番茄根内生菌优势种群的较高丰度OTUs(OUT_23和OTU_3)聚为同一个分支。但是,并不是所有与这些较高丰度OTUs聚在一起的内生细菌都具有显著性促生长作用,例如与根瘤菌GF12聚在同一分支的其他根瘤菌B35、B60和GF49的促生活性相对较低,另外,部分具有显著性促进番茄植株生长的芽孢杆菌在番茄根内生细菌中的丰度较假单胞菌和根瘤菌低,表明内生细菌的促生长与其在植物根内的丰度无正负相关性,并且分离的测试内生细菌多样性仍较低,例如测试芽孢杆菌目主要与OTU_14(Bacillus)聚到一支,根瘤菌主要和OTU_23(Rhizobium)聚到一块,并未聚类到同属根瘤菌目的Bosea、Devosia、Hyphomicrobium以及Aurantimonadaceae,同样假单孢菌主要和OTU_3(Pseudomonas)聚到一支,而Psychrobacter和Acinetobacter等假单胞菌未能和测试假单胞菌聚到一支,还有很多根内生细菌未能成功分离验证,因此持续验证多样内生细菌的功能特征及其在内生细菌中的生态地位,将为合理利用微生物发展生物肥料和生防制剂提供理论基础。
参考文献:
[1]刘丽.小麦内生菌的分离与鉴定[J].沈阳师范大学学报(自然科学版),1998(4):41-46.
[2]CAPPER A L,HIGGINS K P.Application of Pseudomonas fluorescens isolates to wheat as potential biological control agents against takeall[J].Plant Pathology,2007,42(4):560-567.
[3]BENSALIM S,NOWAK J,ASIEDU S K.A Plant Growth Promoting Rhizobacterium and Temperature Effects on Performance of 18 Clones of Potato[J].American Journal of Potato Research,1998,75(3):145-152.
[4]朱笃,罗菲,张志斌,等.东乡野生稻根际可培养细菌多样性及其植物促生活性分析[J].生物多样性,2011,19(4):476-484.
[5]WEBSTER G,GOUGH C,VASSE J,et al.Interactions of rhizobia with rice and wheat[J].Plant and Soil,1997,194(1-2):115-122.
[6]COOMBS J T,FRANCO C M M.Visualization of an Endophytic Streptomyces Species in Wheat Seed[J].Appl Environ Microbiol,2003,69(7):4260-4262.
[7]LUNDBERG D S,LEBEIS S L,PAREDES S H,et al.Defining the core Arabidopsis thaliana root microbiome[J].Nature,2012,488(7409):86-90.
[8]BULGARELLI D,ROTT M,SCHLAEPPI K,et al.Revealing structure and assembly cues for Arabidopsis rootinhabiting bacterial microbiota[J].Nature,2012,488:91-95.
[9]BAI Y,MLLER D B,SRINIVAS G,et al.Functional overlap of the Arabidopsis leaf and root microbiota[J].Nature,2015,528(7582):364-369.
[10]TIAN B Y,CAO Y,ZHANG K Q.Metagenomic insights into communities, functions of endophytes,and their associates with infection by rootknot nematode,Meloidogyne incognita,in tomato roots[J].Scientific Reports,2015,5:17087.
[11]YEOH Y K,PAUNGFOOLONHIENNE C,DENNIS P G,et al.The core root microbiome of sugarcanes cultivated under varying nitrogen fertilizer application[J].Environ Microbiol,2016,18:1338-1351.
[12]DE SOUZA R S C,OKURA V K,ARMANHI J S L,et al.Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome[J].Scientific Reports,2016,6:28774.
[13]马荣琴,曹毅,周俊雄,等.番茄根内生假单胞菌的分离与鉴定[J].生物技术,2015, 25(6):564-580.
[14]程志強,雷少楠,熊娟,等.番茄根内生芽孢杆菌的多样性和系统发育研究[J].中国农学通报,2018,34(8):37-45.
[15]LARKIN M A,BLACKSHIELDS G,BROWN N P,et al.ClustalW and ClustalX version 2[J].Bioinformatics,2007,23:2947-2948.
[16]GOUY M,GUINDON S,OLIVIER G.SeaView Version 4:A Multiplatform Graphical User Interface for Sequence Alignment and Phylogenetic Tree Building[J].Mol Biol Evol,2010,27:221-224.
[17]KUMAR S,STECHER G,TAMURA K.MEGA7:Molecular Evolutionary Genetics Analysis Version 7.0 for Bigger Datasets[J].Mol Biol Evol,2015,33:1870-1874.
(责任编辑:柯文辉)
收稿日期:2019-11-05
作者简介:黎烨,男,1994年生,硕士研究生,主要从事植物微生物组研究。
通信作者:田宝玉,男,1973年生,教授,主要从事环境微生物和微生物组学研究(Email:tianby@fjnu.edu.cn)。
基金项目:国家自然科学基金项目(31670125);福建省自然科学基金项目(2017J01625)。

