低温对结球甘蓝幼叶氮代谢活性及光合色素的影响
山溪 秦文斌 张振超 姚悦梅 肖燕 朱建飞 戴忠良



摘要:【目的】探讨不同耐寒性甘蓝品系在低温胁迫下氮代谢相关指标及色素含量间的差异,为甘蓝品系筛选和耐寒性栽培提供理论依据。【方法】以2个耐寒(231、235)和2个不耐寒(161、163)甘蓝品系为材料,测定分析低温胁迫下其硝态氮(NO3--N)、铵态氮(NH4+-N)、硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸合酶(GOGAT)、谷氨酸脱氢酶(GDH)活性和光合色素的变化情况。【结果】随着低温胁迫时间的延长,耐寒甘蓝品系中可溶性蛋白呈增加趋势,低温胁迫3 d时,耐寒甘蓝品系中可溶性蛋白含量显著增加(P<0.05,下同),品系231和235分別增加15.79%和12.70%,不耐寒甘蓝品系中蛋白含量趋于平稳,在常温恢复2 d后(处理5 d),各处理的可溶性蛋白含量略有降低;NO3--N含量、氮代谢相关酶活性和光合色素含量在低温胁迫期间均呈降低趋势,胁迫5 d时变化不显著(P>0.05,下同);NH4+-N含量则呈增加趋势,胁迫5 d时,品系231和235幼叶的NH4+-N含量不再显著增加,而品系161和163幼叶的NH4+-N含量依然呈显著增加趋势,分别增加27.05%和20.85%。【结论】在低温胁迫下,耐寒甘蓝品系能在一定程度上维持氮代谢关键酶的活性和光合色素含量,以促进氮代谢和光合作用,从而增加其对低温的适应性。
关键词: 结球甘蓝;低温胁迫;氮代谢;光合色素
中图分类号: S635.1 文献标志码: A 文章编号:2095-1191(2019)12-2728-06
Effects of low temperature on nitrogen metabolism activities and photosynthetic pigments in different cabbage seedlings
SHAN Xi, QIN Wen-bin, ZHANG Zhen-chao, YAO Yue-mei, XIAO Yan,
ZHU Jian-fei, DAI Zhong-liang*
(Zhenjiang Institute of Agricultural Sciences of the Ning-Zhen Hilly District, Jurong, Jiangsu 212400, China)
Abstract:【Objective】The differences of nitrogen metabolism related indexes and photosynthetic pigments among cabbage lines with different chilling tolerance under low temperature stress were studied in order to provide theoretical basis for selection and chilling tolerance cultivation of cabbage varieties. 【Method】Changes of nitrate nitrogen(NO3--N),ammonium nitrogen(NH4+-N) and nitrate reductase(NR), glutamine synthetase(GS), glutamic acid synthase(GOGAT) and glutamate dehydrogenase(GDH) activities and photosynthetic pigments were measured and analyzed in two chilling-tole-rant(231, 235) and two chilling-sensitive(161, 163) cabbage strains under chilling stress. 【Result】With the extension of low-temperature stress time, the soluble protein in chilling-tolerant cabbages increased, and it reached significant level on day 3 of low temperature stress(P<0.05, the same below), with increase of 15.79% and 12.70% in 231 and 235, respectively. The protein content of chilling-sensitive cabbages stabilized on day 3 of low-temperature stress, and after 2 d of normal temperature recovery(5 d after treatment), the protein content of the treatment was slightly reduced. NO3--N content, nitrogen metabolism-related enzyme activities and photosynthetic pigment content all showed a decreasing trend during low-temperature stress, and did not change significantly after 5 d of treatment(P>0.05,the same below). The NH4+-N content showed an increasing trend, on day 5, NH4+-N in cabbages 161 and 163 still showed a significant increase, with an increase of 27.05% and 20.85% in 161 and 163, respectively, while those in 231 and 235 were no longer significantly increased. 【Conclusion】Under low-temperature treatment, the chilling-tolerant cabbage lines can maintain the activities of key enzymes of nitrogen metabolism and photosynthetic pigments to promote nitrogen metabolism andphotosynthesis, thereby increasing their adaptability to chilling stress.
Key words: cabbage; low temperature stress; nitrogen metabolism; photosynthetic pigments
0 引言
【研究意义】结球甘蓝(Brassica oleracea var. capitata)是十字花科芸薹属的一个变种,在世界范围内广泛种植。结球甘蓝喜冷凉气候,春季反季节栽培的结球甘蓝若在结球之前遭遇低温,或在幼苗期遇到低温而完成春化,则无法形成叶球,造成产量降低,甚至绝收,从而影响经济效益。低温会破坏植株幼苗氮代谢相关酶的活性,还会影响植物叶绿体的功能,使光合组织的活性和结构发生改变,影响光合色素合成,进而影响光合作用。因此,探讨低温对甘蓝氮代谢及光合色素的影响,对耐寒结球甘蓝品系的选育及种植具有重要意义。【前人研究进展】氮元素形态会影响植物的光合机构、氮素代谢、呼吸代谢及能量分配等,最终引起植株生物量和形态上的差异(刘晓静等,2015)。硝酸盐可在细胞液泡内大量积累,是植物储存氮源的主要形式,而铵盐则不同,植物细胞若碳源不足,无法为氮同化提供足够的碳骨架和能量,铵盐过度积累会对细胞造成毒害(刘婷和尚忠林,2016)。各种非生物胁迫中,低温是影响植物生长发育和地理分布的重要因子之一(丁红映等,2019)。低温破坏叶绿体结构,叶绿素合成受抑制,从而降低光合作用(王兆等,2015;任延靖等,2019)。植物的呼吸代谢也会受到影响,蛋白质和糖类物质分解代谢过程中会产生有毒物质,而植株对氮的吸收需要呼吸作用提供能量(马月花等,2015)。目前,在番茄(刘国英,2014)、甜瓜(高青海等,2016)和山定子(李玲等,2017)等作物的相关研究发现,低温会降低植株氮代谢相关酶的活性及总氮和硝态氮(NO3--N)含量,但增加铵态氮(NH4+-N)含量,使植株的生长受到抑制。【本研究切入点】目前,国内关于低温胁迫对不同品系甘蓝幼苗氮代谢影响的研究鲜见报道。【拟解决的关键问题】选择耐寒和不耐寒甘蓝品系各2个为试验材料,通过研究低温胁迫及低温胁迫后恢复常温下甘蓝幼叶氮代谢相关指标的动态变化,以期为甘蓝品系筛选和耐寒性栽培提供理论依据。
1 材料与方法
1. 1 试验材料
供试材料为高代自交系耐寒的甘蓝品系(231和235)及不耐寒的甘蓝品系(161和163),均由镇江农业科学研究院蔬菜花卉研究室提供。
1. 2 试验方法
1. 2. 1 试验设计 试验于2018年5月在镇江农业科学研究院的行香试验基地进行,待幼苗长至四叶一心时,选取长势基本一致的幼苗移至人工气候箱(昼夜温度为25 ℃/20 ℃,12 h光/12 h暗),待幼苗适应2 d后进行低温胁迫处理(昼夜温度为10 ℃/5 ℃,12 h光/12 h暗)。胁迫时间分别为0、1和3 d,并恢复常温(22 ℃/15 ℃)处理2 d,整个试验过程为5 d。分别取植株从外围数第4片功能叶迅速置于液氮中冷冻,置于-80 ℃冰箱保存,以备后续测定。试验设3个生物学重复,每处理选择9株幼苗。
1. 2. 2 測定指标及方法 使用考马斯亮蓝G-250法测定甘蓝幼叶可溶性蛋白含量;NO3--N含量参照李合生(2000)的方法进行测定;NH4+-N含量参照马月花等(2015)的方法进行测定;NR活性参照Cervilla等(2009)的方法进行测定;GS和GOGAT活性参照Cervilla等(2009)、Gangwar和Singh(2011)的方法进行测定;GDH活性参照Debouba等(2007)的方法进行测定;光合色素含量参照尚丽娜等(2019)的方法进行测定。
1. 3 统计分析
用SPSS 19.0进行数据统计分析,利用Duncan’s新复极差法进行差异显著性检验。
2 结果与分析
2. 1 低温胁迫期间甘蓝幼叶可溶性蛋白及不同形态氮含量的变化
由图1可知,与低温胁迫0 d相比,低温胁迫1 d时各甘蓝品系幼叶的可溶性蛋白含量均显著增加(P<0.05,下同);胁迫3 d时,耐寒甘蓝品系中可溶性蛋白含量较胁迫1 d时显著增加,品系231和235分别增加15.79%和12.70%,不耐寒甘蓝品系则趋于平稳;常温恢复2 d后(处理5 d时),各处理的可溶性蛋白含量略有降低,但耐寒甘蓝品系中可溶性蛋白含量高于不耐寒甘蓝品系,品系231比品系161和163分别高1.53和1.43倍;品系235比品系161和163分别高1.63和1.52倍。在低温胁迫期间,可溶性蛋白含量呈增加趋势,耐寒甘蓝品系中蛋白含量始终高于不耐寒甘蓝品系,可溶性蛋白含量增加能使叶片细胞内的渗透调节物质增加,维持较高水平,从而维持细胞渗透平衡。
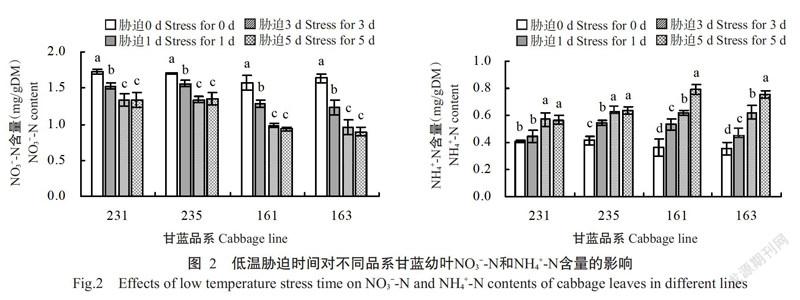
由图2可看出,低温胁迫1 d,品系231和235幼叶的NO3--N含量高于品系161和163,其中,品系231分别是161和163的1.19和1.24倍,品系235分别是161和163的1.21和1.26倍;随着低温胁迫时间的延长,品系161和163幼叶的NO3--N含量持续降低,与低温胁迫3 d相比,胁迫5 d时品系161和163幼叶的NO3--N含量略有降低,分别减少4.85%和6.47%。对于NH4+-N的变化,随着低温胁迫时间的延长,4个品系幼叶的NH4+-N含量均呈上升趋势,但品系231和235幼叶的NH4+-N含量低于品系161和163;胁迫5 d时,品系231和235幼叶的NH4+-N含量不再增加,而品系161和163幼叶的NH4+-N含量依然呈显著增加趋势,较胁迫3 d时分别增加27.05%和20.85%。说明低温胁迫降低甘蓝幼叶NO3--N含量,增加NH4+-N含量,但耐寒甘蓝品系中NO3--N含量依然高于不耐寒甘蓝品系,NH4+-N含量却低于不耐寒甘蓝品系。
2. 2 低温胁迫期间甘蓝幼叶氮代谢相关酶的变化
由图3可知,低温胁迫下甘蓝幼叶的氮代谢相关酶活性受到不同程度的影响。低温胁迫1 d时,品系231和235幼叶的NR活性高于品系161和163,4个品系幼叶的GS、GOGAT和GDH活性均显著降低。与低温胁迫1 d相比,低温胁迫3 d时品系231、161和163幼叶的NR活性均显著降低(分别降低16.30%、27.45%和29.82%);品系231和235幼叶的GS活性显著降低(分别降低21.09%和16.76%),品系161和163幼叶的GS活性略有升高,但差异不显著(P>0.05,下同);品系231幼叶的GOGAT活性有所降低但变化不显著,其他3个品系幼叶的GOGAT活性均显著降低(分别降低25.53%、29.37%和36.51%);4个品系幼叶的GDH活性则继续降低,与胁迫1 d时差异显著。低温胁迫5 d时,品系231、161和163幼叶的NR活性变化不显著,但品系235幼叶的NR活性显著降低,降幅为23.60%;品系231和161幼叶的GS活性略有增加,品系235和163幼叶的GS活性则降低;各甘蓝品系幼叶的GOGAT活性均有所增加;品系231幼叶的GDH活性略有降低,品系235则呈增加趋势,品系161和163的变化不明显。说明随着低温胁迫时间的延长,甘蓝幼叶中氮代谢相关酶活性呈降低趋势,但在相同时间下耐寒甘蓝品系中氮代谢相关酶活性高于不耐寒甘蓝品系。
2. 3 低温胁迫期间甘蓝幼叶光合色素含量的变化
低温胁迫条件下,植物光合作用的降低与光合色素含量变化相关。由图4可知,与胁迫0 d相比较,低温胁迫1 d时甘蓝幼叶中叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素含量均降低,但耐寒植株中光合色素含量仍高于不耐寒植株,其中,品系231中叶绿素总量分别是品系161和163的1.02和1.75倍,品系235中叶绿素总量分别是161和163的1.02和1.61倍。随着低温胁迫时间的延长,色素含量均呈降低趋势;胁迫3 d时,品系231和235幼叶光合色素均显著降低(叶绿素总量分别降低26.91%和37.29%),而品系163中叶绿素a含量变化不显著;胁迫5 d时,品系231幼叶的叶绿素总量和叶绿素a含量略有增加,品系235幼叶的叶绿素a、叶绿素b和叶绿素总量增加,品系161幼叶绿素a、叶绿素b和叶绿素总量略有降低、类胡萝卜素含量则略有增加,品系163幼叶的叶绿素a、叶绿素b和叶绿素总量略有增加,但其类胡萝卜素含量降低。说明低温胁迫促使光合色素降解,但耐寒甘蓝品系中光合色素的降解速率低于不耐寒甘蓝品系,从而维持植株叶片的光合进程。
3 讨论
低温引起植物外部形态和生理代谢的变化,导致植物体蛋白变性、氨毒害及光合作用下降等一系列情况发生,从而造成植株饥饿伤害(高青海等,2016;秦文斌等,2018)。土壤中NO3--N和NH4+-N是植物氮吸收的主要形式(彭亚静等,2015)。NR是氮同化的限速酶,活性与光照、温度、硝酸盐等多种因素有关(徐亚会等,2016)。本研究中,低温胁迫抑制了甘蓝幼叶的NR活性,4个甘蓝品系幼叶的NO3--N含量均出现不同程度的降低,与亚低温胁迫下甜瓜叶片中的变化趋势相似(高青海等,2016)。说明低温胁迫早期,植株根系降低了对NO3--N的吸收,同时降低NR活性。但随着低温胁迫时间的延长,耐寒植株能维持较高水平的NR活性,有助于NO3--N的转化,从而使植株中的NO3--N能在叶片中被转化吸收。
NO3--N转化为NH4+-N只是一种暂时的状态,长时间积累会造成氨毒害。在高等植物中95%以上的无机氮均通过GS\GOGAT循环进行。本研究结果表明,低温胁迫下甘蓝幼叶中的GS和GOGAT活性均呈下降趋势,与刘国英(2014)在亚低温胁迫下对番茄的研究结果相似,表明耐寒品系能及时调节植株体内的代谢机制,维持较高水平的酶的催化活性。较高水平的GS可加速叶片NO3--N经还原产生的NH4+-N向有机态氮转化,从而抑制耐寒品系幼叶中NH4+-N的增加,維持植株氮代谢的平衡(韩敏等,2018)。而不耐寒甘蓝幼叶中的NH4+-N呈显著增加趋势,可能是由于GS活性显著性降低,使得NH4+-N转化为谷氨酰胺受到抑制。一些学者认为,在胁迫条件下植株的氮同化过程中,GDH在维持碳氮平衡方面发挥着重要作用,GDH在氨同化过程中具有双重功能(Dubois et al.,2003)。低温胁迫下,耐寒品系中GDH活性显著高于不耐寒品系,可能是因为低温胁迫促进了GDH在蛋白降解方面的活性,从而释放出大量NH4+-N。有研究表明,当氨水平上升到一定程度时,GDH上调,说明GDH在同化过多的氨及防止氨毒害方面起重要作用(Tercé-Laforgue et al.,2004a,2004b)。盐胁迫下,GDH在氨同化中也有重要作用(Skopelitis et al.,2006),分离的马铃薯线粒体中GDH活性增加(Aubert et al.,2001)。上述研究结论均表明,在胁迫条件下,碳源受到限制,GDH可能会催化谷氨酸为TCA循环提供碳骨架。
光合作用是能量产生的第一步,低温胁迫通过影响叶绿素和类胡萝卜素而抑制光合作用(Gong et al.,2017)。低温胁迫加剧叶绿素的降解,叶绿素含量的变化可衡量植株的伤害程度,而类胡萝卜素是植物在非生物胁迫中信号传递的前体物质,能保护膜免受氧化损伤(杜琪等,2019)。低温胁迫下,耐寒的甘蓝幼叶中光合色素含量高于不耐寒的甘蓝幼叶,表现出对低温的耐受性。
4 结论
在低温胁迫下,耐寒甘蓝品系能在一定程度上维持氮代谢关键酶的活性和光合色素含量,以促进氮代谢和光合作用,从而增加其对低温的适应性。
参考文献:
杜琪,王宁,赵新华,沙德剑,张艳正,赵凯能,党现什,于海秋. 2019. 低钾胁迫对玉米苗期光合特性和光系统Ⅱ性能的影响[J]. 核农学报,33(3): 592-599. [Du Q,Wang N,Zhao X H,Sha D J,Zhang Y Z,Zhao K N,Dang X S,Yu H Q. 2019. Effects of potassium deficiency on photosynthesis and performance of photosystem Ⅱ in maize seedling stage[J]. Journal of Nuclear Agricultural Scien-ces,33(3): 592-599.]
丁红映,王明,谢洁,熊兴耀,胡新喜,秦玉芝.2019. 植物低温胁迫响应及研究方法进展[J]. 江苏农业科学,47(14):31-36. [Ding H Y,Wang M,Xie J,Xiong X Y,Hu X X,Qin Y Z. 2019. Response to low temperature stress in plants and advances in research methods[J]. Jiangsu A-gricultural Sciences,47(14):31-36.]
高青海,贾双双,苗永美,陆晓民,李慧敏. 2016. 亚低温条件下外源褪黑素对甜瓜幼苗氮代谢及渗透调节物质的影响[J]. 应用生态学报. 27(2): 519-524. [Gao Q H,Jia S S,Miao Y M,Lu X M,Li H M. 2016. Effects of exogenous melatonin on nitrogen metabolism and osmotic adjustment substances of melon seedlings under sub-low temperature[J]. Chinese Journal of Applied Ecology,27(2): 519-524.]
韓敏,曹逼力,刘树森,徐坤. 2018. 低温胁迫下番茄嫁接苗根穗互作对叶片光合作用及氮代谢的影响[J]. 园艺学报,45(5): 87-97. [Han M,Cao B L,Liu S S,Xu K. 2018. Effects of rootstock and scion interaction on photosynthesis and nitrogen metabolism of grafted tomato seedlings leaves under low temperature stress[J]. Acta Horticulturae Sinica,45(5): 87-97.]
李合生. 2000. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社: 220-223. [Li H S. 2000. Principles and techniques of plant physiology and biochemistry experiment[M]. Beijing: Higher Education Press: 220-223.]
李玲,陆晓晨,马怀宇,吕德国. 2017. 亚低温下不同外源氮对山定子根系氮代谢活性的影响[J]. 湖北农业科学,56(13): 2471-2475. [Li L,Lu X C,Ma H Y,Lü D G. 2017. Effects of different exogenous nitrogen on nitrogen metabolism of Malus baccata Borkh. roots under mild hypothermia[J]. Hubei Agricultural Sciences,56(13): 2471-2475.]
刘国英. 2014. 亚低温胁迫下氮素形态对番茄幼苗生理特性和根系形态的影响[D]. 杨凌:西北农林科技大学. [Liu G Y. 2014. Effects of nitrogen forms on physiological and root morphology of tomato seedlings under sub-low temperature[D]. Yangling: Northwest A & F University.]
刘婷,尚忠林. 2016. 植物对铵态氮的吸收转运调控机制研究进展[J]. 植物生理学报,52(6):799-809. [Liu T,Shang Z L. 2016. Research progress on molecular regulation of ammonium uptake and trans-port in plant[J]. Plant Physio-logy Journal,52(6):799-809.]
刘晓静,张进霞,叶芳,齐鹏. 2015. 施氮对紫花苜蓿氮代谢及氮积累的影响[J]. 核农学报,29(7): 1399-1405. [Liu X J,Zhang J X,Ye F,Qi P. 2015. Effects of nitrogen application on nitrogen metabolism and nitrogen accumulation of Alfalfa(Medicago sativa)[J]. Journal of Nuclear Agricultural Sciences,29(7): 1399-1405.]
马月花,郭世荣,杜南山,山溪,孙锦,王磊,王颖,束胜. 2015. 外源24-表油菜素内酯对低氧胁迫下黄瓜幼苗氮代谢的影响[J]. 南京农业大学学报,38(4): 538-545. [Ma Y H,Guo S R,Du N S,Shan X,Sun J,Wang L,Wang Y,Shu S. 2015. Effect of exogenous 24-epibrassinolide on nitrogen assimilation of cucumber seedlings under hypoxia stress[J]. Journal of Nanjing Agricultural University,38(4): 538-545.]
彭亚静,郝晓然,吉艳芝,王琳,任翠莲,巨晓棠,张丽娟. 2015. 填闲种植对棚室菜田累积氮素消减及黄瓜生长的影响[J]. 中国农业科学,48(9): 1774-1784. [Peng Y J,Hao X R,Ji Y Z,Wang L,Ren C L,Ju X T,Zhang L J. 2015. Effects of catch crops on reducing soil nitrate accumulation and cucumber growth in greenhouse vegetable production system[J]. Scientia Agricultura Sinica,48(9): 1774-1784.]
秦文斌,山溪. 张振超,姚悦梅,肖燕,戴忠良. 2018. 低温胁迫对甘蓝幼苗抗逆生理指标的影响[J]. 核农学报,32(3): 576-581. [Qin W B,Shan X,Zhang Z C,Yao Y M,Xiao Y,Dai Z L. 2018. Effect of low temperature stress on anti-stress physiological indexes of cabbage seedlings[J]. Journal of Nuclear Agricultural Sciences,32(3): 576-581.]
任延靖,郭怡婷,赵孟良. 2019. 植物应答低温胁迫的研究进展[J/OL]. 分子植物育种. http://kns.cnki.net/kcms/detail/46.1068.S.20190719.1019.002.html. [Ren Y J,Guo Y T,Zhao M L. 2019. Research progress of response to low temperature stress in plant[J/OL]. Molecular Plant Brea-ding. http://kns.cnki.net/kcms/detail/46.1068.S.20190719. 1019. 002.html.]
尚麗娜,陈新龙,米胜男,委刚,王玲,张雅怡,雷霆,林永鑫,黄兰杰,朱美丹,王楠. 2019. 水稻温敏型叶片白化转绿突变体tsa2的表型鉴定与基因定位[J]. 作物学报,45(5): 662-675. [Shang L N,Chen X L,Mi S N,Wei G,Wang L,Zhang Y Y,Lei T,Lin Y X,Huang L J,Zhu M D,Wang N. 2019. Phenotypic identification and gene mapping of temperature-sensitive green-revertible albino mutant tsa2 in rice(Oryza sativa L.)[J]. Acta Agronomica Sinica,45(5): 662-675.]
王兆,刘晓曦,郑国华. 2015. 低温胁迫对彩叶草光合作用及叶绿素荧光的影响[J]. 浙江农业学报,27(1):49-56. [Wang Z,Liu X X,Zheng G H. 2015. Effects of low temperature stress on the photosynthesis and chlorophyll fluorescence of Solenostemon scutellarioides[J]. Acta A-griculturae Zhejiangensis,27(1):49-56.]
徐亚会,董守坤,李雪凝,高鑫宇,王利彬,刘丽君. 2016. 干旱胁迫对春大豆氮代谢关键酶活性的影响[J]. 核农学报,30(1): 164-170. [Xu Y H,Dong S K,Li X N,Gao X Y,Wang L B,Liu L J. 2016. Effect of progressive drought stress on the key enzyme activities of nitrogen metabolism of spring soybean[J]. Journal of Nuclear Agricultu-ral Sciences,30(1): 164-170.]
Aubert S,Bligny R,Douce R,Gout E,Ratcliffe R G,Roberts J K M. 2001. Contribution of glutamate dehydrogenase to mitochondrial glutamate metabolism studied by 13-C and P-31 nuclear magnetic resonance[J]. Journal of Experimental Botany,52(354): 37-45.
Cervilla L M,Blasco B,Ríos J J,Rosales M A,Rubio-Wilhelmi M M,Sánchez-Rodríguez E,Romero L,Ruiz J M. 2009. Response of nitrogen metabolism to boron toxicity in tomato plants[J]. Plant Biology,11(5): 671-677.
Debouba M, Maâroufi-Dghimi H,Suzuki A,Ghorbel M H,Gouia H. 2007. Changes in growth and activity of enzymes involved in nitrate reduction and ammonium assimilation in tomato seedlings in response to NaCl stress[J]. Annals of Botany,99(6): 1143-1151.
Dubois F,Tercé-Laforgue T,Begoña M G-M,Estavillo J-M,Sangwan R S,Gallais A,Hirel B. 2003. Glutamate dehydrogenase in plants: Is there a new story for an old enzyme?[J]. Plant Physiology and Biochemistry,41(6): 565-576.
Gangwar S,Singh V P. 2011. Indole acetic acid differently changes growth and nitrogen metabolism in Pisum sativum L. seedlings under chromium(VI) phytotoxicity: Implication of oxidative stress[J]. Scientia Horticulturae,129(2): 321-328.
Gong D H,Wang G Z,Si W T,Zhou Y,Liu Z,Jia J. 2017. Effects of Salt Stress on photosynthetic pigments and activity of ribulose-1,5-bisphosphate carboxylase/oxygenase in Kalidium foliatum[J]. Russian Journal of Plant Physio-logy,65(1): 98-103.
Skopelitis D S,Paranychianakis N V,Paschalidis K,Pliakonis E D,Delis I D,Yakoumakis D I,Kouvarakis A N,Papadakis A K,Stephanou E G,Roubelakis-Angelakis K A,Stephanou E G,Roubelakis-Angelakis K. 2006. Abiotic stress generates ROS that signal expression of anionic glutamate dehydrogenases to form glutamate for proline synthesis in tobacco and grapevine[J]. The Plant Cell,18(10): 2767-2781.
Tercé-Laforgue T,Dubois F,Ferrario-Méry S,Pou de Crecenzo M-A,Sangwan R,Hirel B. 2004a. Glutamate dehydrogenase of tobacco is mainly induced in the cytosol of phloem companion cells when ammonia is provided either externally or released during photorespiration[J]. Plant Physiology,136(4): 4308-4317.
Tercé-Laforgue T,Mäck G,Hirel B. 2004b. New insights towards the function of glutamate dehydrogenase revealed during source-sink transition of tobacco(Nicotiana tabacum) plants grown under different nitrogen regimes[J]. Physiologia Plantarum,120(2): 220-228.
(責任编辑 邓慧灵)

