急性A型主动脉夹层的累及特性与术后重度急性肾损伤的关系
赵明明 郭子健 孙雨薇 张宏凯 李宇 金沐 程卫平
急性A型主动脉夹层(acute stanford type A aortic dissection,AAAD)发病率为 5~10/10 万,临床表现危重且紧急,死亡率高[1],此类患者如不进行治疗病死率可达30%[2]。急性肾损伤(acute kidney injury,AKI)是AAAD的常见并发症之一,发生率为20%~67%[3-4],远高于心脏外科的其他手术,其中2%~8%的患者需要连续肾脏替代疗法(continuous renal replacement therapy,CRRT)[5-7], 重度 AKI的患者住院死亡率明显增加,进行肾脏替代治疗患者短期死亡率可高达64%[8],远期死亡率较非AKI的患者也明显增加,AKI患者ICU住院时间更长,医疗花费也更高[9-10]。近些年,很少有研究关注影像学的特性对术后重度AKI的影响,本研究的目的是探讨AAAD术后发生重度AKI的围术期危险因素,为围术期预防急性肾损伤提供影像学证据。
资料与方法
1.研究对象 收集2015年1月至2019年1月期间,于北京安贞医院行手术治疗的AAAD患者为研究对象。(1)纳入标准:①年龄18~80岁;②术前保存完整的主动脉CTA影像学资料并诊断为Standford A型急性主动脉夹层的患者;③发病到手术时间<14 d。(2)排除标准:①既往有肾功能异常、术前需要血液透析的患者;②曾行心血管或泌尿系统的手术患者;③围术期肌酐值缺失以及相关临床资料不完整的病例。
2.AKI的诊断标准 AKI诊断标准是根据2015年KDIGO制定的标准和分类(表1),本研究将患者入院时血肌酐浓度作为基线值,术后7 d内肌酐峰值为肌酐升高值,进行AKI分期。

表1 KDIGO制定的急性肾损伤分期标准
3.数据收集 收集患者基本资料、既往史、实验室检查、影像学检查结果。术前实验室指标收集以入手术室前最后一次检查结果为准,术后实验室指标收集以出手术室后第一次检查结果为准。
4.主动脉CTA重建图像分析 由擅长血管疾病诊断工作的高级职称影像科医生进行观察测量,①通过重建主动脉CTA图像,选取升主动脉平面(选择窦管交界以上2 cm左右),胸主动脉平面(选择平主动脉瓣环水平),膈水平面,腹腔干水平面对真腔弧度,假腔弧度长度测量,计算假腔长度/主动脉周长×100%,取其四个平面的平均值评估假腔撕裂的大小。测量肾动脉平面真腔弧度和假腔弧度长度,计算假腔长度/主动脉周长×100%评估肾动脉假腔的大小。测量真腔弧度长度和假腔弧度长度的可行性在于避免了内膜片随心动周期的摆动对测量假腔和真腔面积大小的影响(图1)。②测量双侧肾动脉,双侧髂动脉的受累情况,对血管受累程度进行分级:“1级”是指该分支血管无受累或血管起始端少量假腔供血,“2级”是指该分支血管由真假腔供血,“3级”是指该分支血管完全由假腔供血(图2)。③测量主动脉长度,主动脉夹层累及长度。④假腔内是否有血栓。⑤双肾是否低灌注。
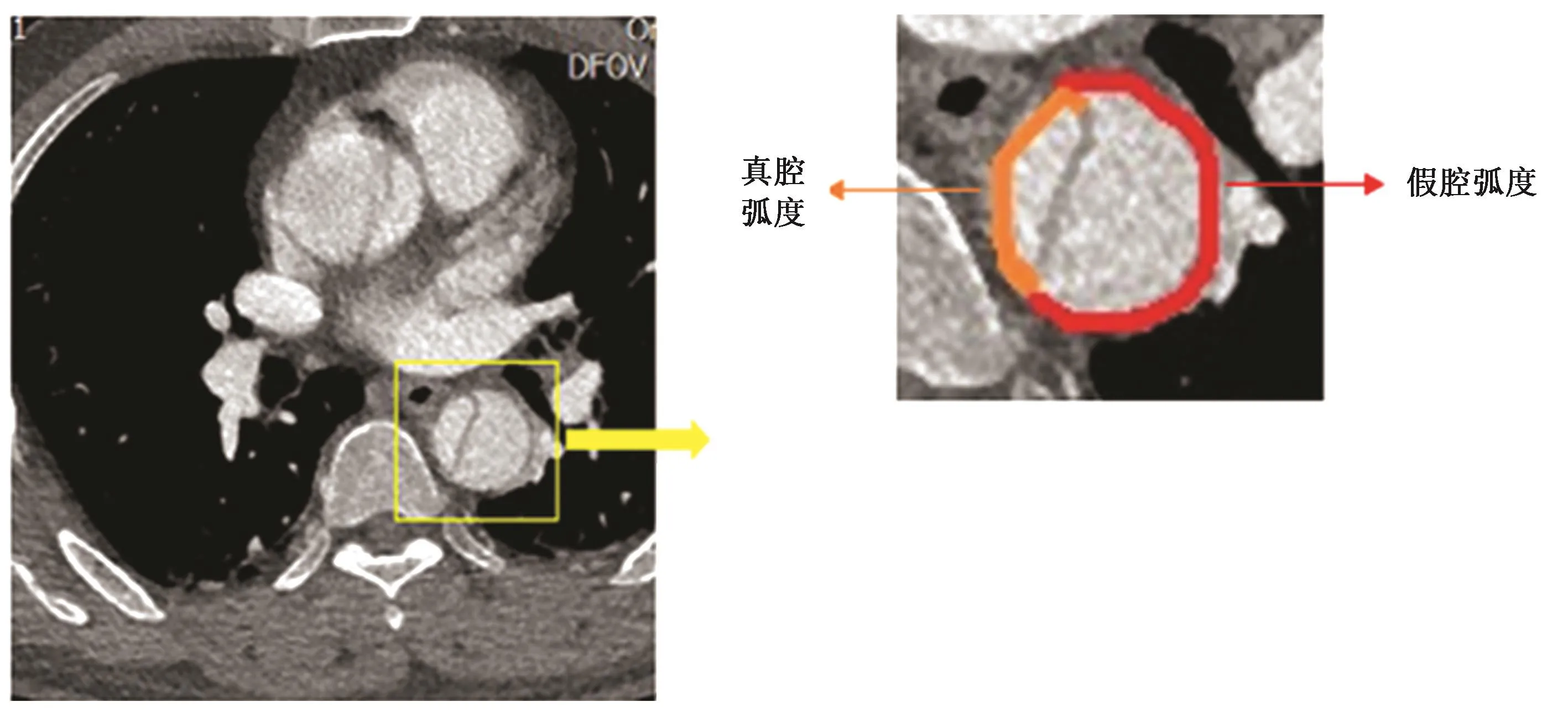
图1 夹层假腔撕裂大小计算的图示

图2 血管累及程度的划分
5.统计学方法 采用SPSS20.0统计学软件进行分析。正态分布计量资料以均数±标准差表示,比较采用t检验或方差分析,非正态分布资料采用中位数(M)及四分位数间距(P25,P75)表示,组间比较采用非参数检验或作对数转进行换后进行分析。计数资料以例数(构成比)表示,比较采用χ2检验或Fisher’s确切概率检验。采用ROC曲线下面积评价AAAD术后重度AKI模型的预测能力。以P<0.05为差异有统计学意义。
结 果
1.研究对象分组及基线特征 纳入研究的174例患者平均年龄为49岁(18~68岁),其中133例(76.4%)为男性患者,术后7 d内,共101例患者发生了 AKI。根据 KDIGO标准,AKI 1期 51例(29.3%),AKI 2期例18例(10.3%),AKI 3期 32例(18.4%)。其中15例(8.6%)需要进行连续肾脏替代治疗。
2.临床资料单因素分析结果 术前肌红蛋白、术后肌红蛋白、术前肌钙蛋白、术后PLT计数、术中输注血浆量,术后24 h引流量、术后24 h PLT输注量、股动脉插管,差异有统计学意义(P<0.05,表2~3)。
3.CTA基线特征单因素分析结果 术前肾脏低灌注、肾动脉假腔比例、双侧肾动脉累及程度、双侧髂动脉累及程度差异有统计学意义(P<0.05,表4)
4.多因素Logistic回归分析 术前肌红蛋白、术中输注血浆量、术前肾脏低灌注、股动脉插管、双侧肾动脉累及程度是术后重度AKI的危险因素(表5)。发生重度AKI的ROC曲线下面积为0.853,95%CI:0.768~0.939。
5.重度AKI患者的预后转归 重度AKI组机械通气时间(P<0.001)、ICU 停留时间(P<0.001)、住院时程(P=0.009)、死亡率(P=0.025)、CRRT(P<0.001)均高于非重度AKI组,出院生活质量评分低于非重度AKI组(P=0.001),术后并发症发生率重度AKI组明显高于非重度AKI组,包括:呼吸系统并发症(62.5%vs.35.2%,P=0.004)、消化系统并发症(34.4%vs.12.0%,P=0.002)、神经系统并发症(18.8%vs.6.3%,P=0.006,表6)。
表2 两组临床资料单因素分析[±s,n(%),M(QR)]
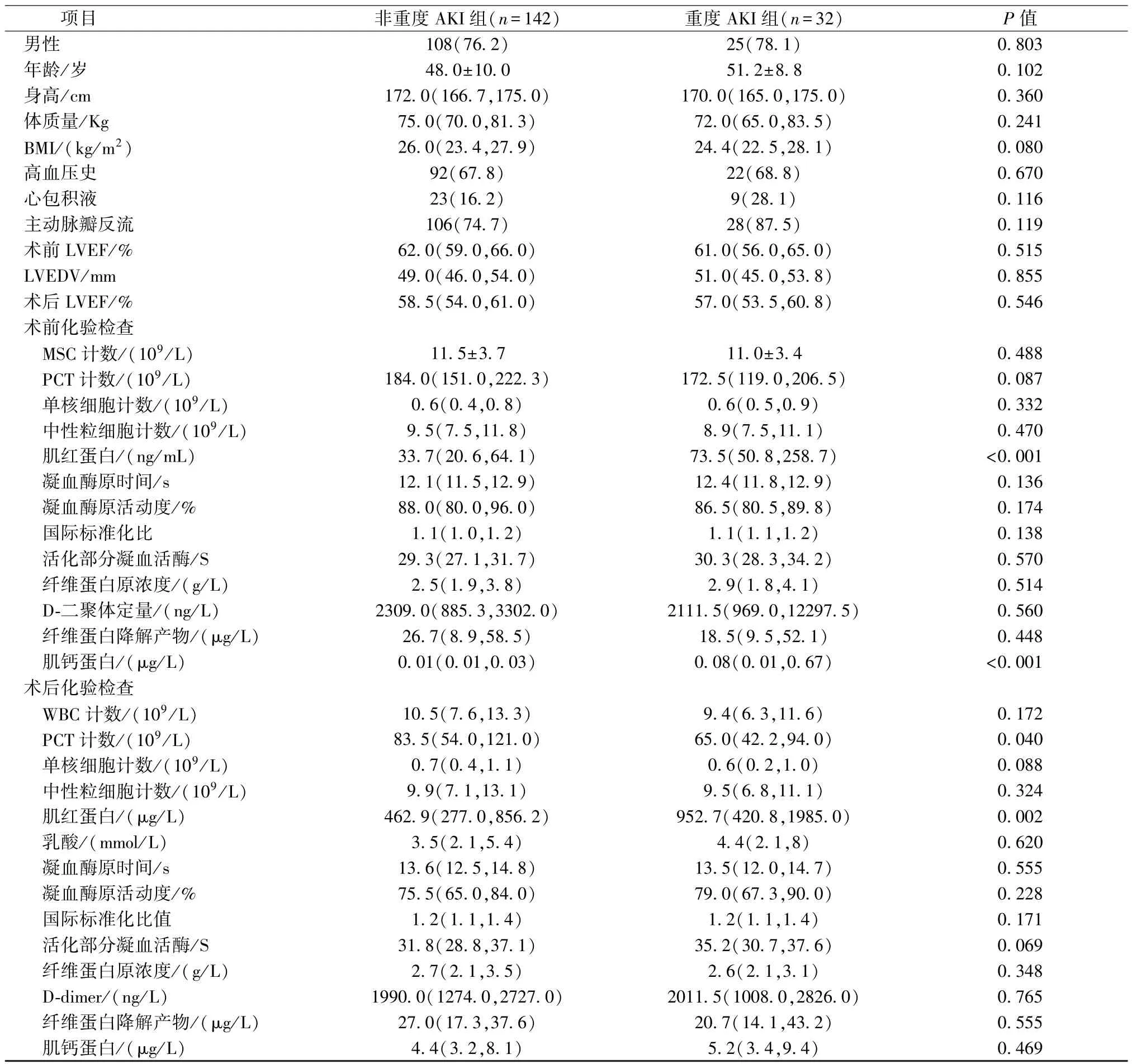
表2 两组临床资料单因素分析[±s,n(%),M(QR)]
项目 非重度AKI组(n=142) 重度AKI组(n=32) P值男性108(76.2) 25(78.1) 0.803年龄/岁 48.0±10.0 51.2±8.8 0.102身高/cm 172.0(166.7,175.0) 170.0(165.0,175.0) 0.360体质量/Kg 75.0(70.0,81.3) 72.0(65.0,83.5) 0.241 BMI/(kg/m2) 26.0(23.4,27.9) 24.4(22.5,28.1) 0.080高血压史 92(67.8) 22(68.8) 0.670心包积液 23(16.2) 9(28.1) 0.116主动脉瓣反流 106(74.7) 28(87.5) 0.119术前 LVEF/% 62.0(59.0,66.0) 61.0(56.0,65.0) 0.515 LVEDV/mm 49.0(46.0,54.0) 51.0(45.0,53.8) 0.855术后 LVEF/% 58.5(54.0,61.0) 57.0(53.5,60.8) 0.546术前化验检查MSC 计数/(109/L) 11.5±3.7 11.0±3.4 0.488 PCT 计数/(109/L) 184.0(151.0,222.3) 172.5(119.0,206.5) 0.087单核细胞计数/(109/L) 0.6(0.4,0.8) 0.6(0.5,0.9) 0.332中性粒细胞计数/(109/L) 9.5(7.5,11.8) 8.9(7.5,11.1) 0.470肌红蛋白/(ng/mL) 33.7(20.6,64.1) 73.5(50.8,258.7) <0.001凝血酶原时间/s 12.1(11.5,12.9) 12.4(11.8,12.9) 0.136凝血酶原活动度/% 88.0(80.0,96.0) 86.5(80.5,89.8) 0.174国际标准化比 1.1(1.0,1.2) 1.1(1.1,1.2) 0.138活化部分凝血活酶/S 29.3(27.1,31.7) 30.3(28.3,34.2) 0.570纤维蛋白原浓度/(g/L) 2.5(1.9,3.8) 2.9(1.8,4.1) 0.514 D-二聚体定量/(ng/L) 2309.0(885.3,3302.0) 2111.5(969.0,12297.5) 0.560纤维蛋白降解产物/(μg/L) 26.7(8.9,58.5) 18.5(9.5,52.1) 0.448肌钙蛋白/(μg/L) 0.01(0.01,0.03) 0.08(0.01,0.67) <0.001术后化验检查WBC 计数/(109/L) 10.5(7.6,13.3) 9.4(6.3,11.6) 0.172 PCT 计数/(109/L) 83.5(54.0,121.0) 65.0(42.2,94.0) 0.040单核细胞计数/(109/L) 0.7(0.4,1.1) 0.6(0.2,1.0) 0.088中性粒细胞计数/(109/L) 9.9(7.1,13.1) 9.5(6.8,11.1) 0.324肌红蛋白/(μg/L) 462.9(277.0,856.2) 952.7(420.8,1985.0) 0.002乳酸/(mmol/L) 3.5(2.1,5.4) 4.4(2.1,8) 0.620凝血酶原时间/s 13.6(12.5,14.8) 13.5(12.0,14.7) 0.555凝血酶原活动度/% 75.5(65.0,84.0) 79.0(67.3,90.0) 0.228国际标准化比值 1.2(1.1,1.4) 1.2(1.1,1.4) 0.171活化部分凝血活酶/S 31.8(28.8,37.1) 35.2(30.7,37.6) 0.069纤维蛋白原浓度/(g/L) 2.7(2.1,3.5) 2.6(2.1,3.1) 0.348 D-dimer/(ng/L) 1990.0(1274.0,2727.0) 2011.5(1008.0,2826.0) 0.765纤维蛋白降解产物/(μg/L) 27.0(17.3,37.6) 20.7(14.1,43.2) 0.555肌钙蛋白/(μg/L) 4.4(3.2,8.1) 5.2(3.4,9.4) 0.469
表3 两组术中临床资料比较[±s,n(%),M(QR)]

表3 两组术中临床资料比较[±s,n(%),M(QR)]
项目 非重度AKI组(n=142) 重度AKI组(n=32) P值手术时间/h 8.0(7.0,8.0) 8.0(7.3,9.0) 0.059转机时间/min 199.7±38.7 212.1±46.3 0.117阻断时间/min 109.5(90.8,132.0) 118.5(99.3,143.0) 0.112低流量时间/min 22.0(18.0,28.0) 23.5(18.3,30.0) 0.293股动脉插管 34(23.9) 17(53.1) 0.001术中尿量/mL 1800.0(1200.0,2200.0) 1700.0(850.0,2000.0) 0.103术中输液量/mL 2400.0(1875.0,2825.0) 2500.0(2000.0,2975.0) 0.162术中输注血浆量/mL 0.0(0.0,400.0) 400.0(0.0,800.0) 0.001术中输注红细胞量/U 0.0(0.0,4.0) 2.0(0.0,4.0) 0.077术中输注血小板量/U 0.2±0.5 0.2±0.7 0.373术后 24 h 输液量/mL 2790.0(2100.0,3410.0) 2080.0(2080.0,3461.3) 0.972术后 24 h 引流量/mL 600.0(365.0,900.0) 780.0(492.5,1325.0) 0.044术后24 h输注血浆量/mL 103.5±235.3 134.4±245.8 0.393术后24 h输注红细胞量/U 0.0(0.0,2.0) 1.0(0.0,4.0) 0.057术后24 h输注血小板量/U 0.1±0.3 0.3±0.7 0.002
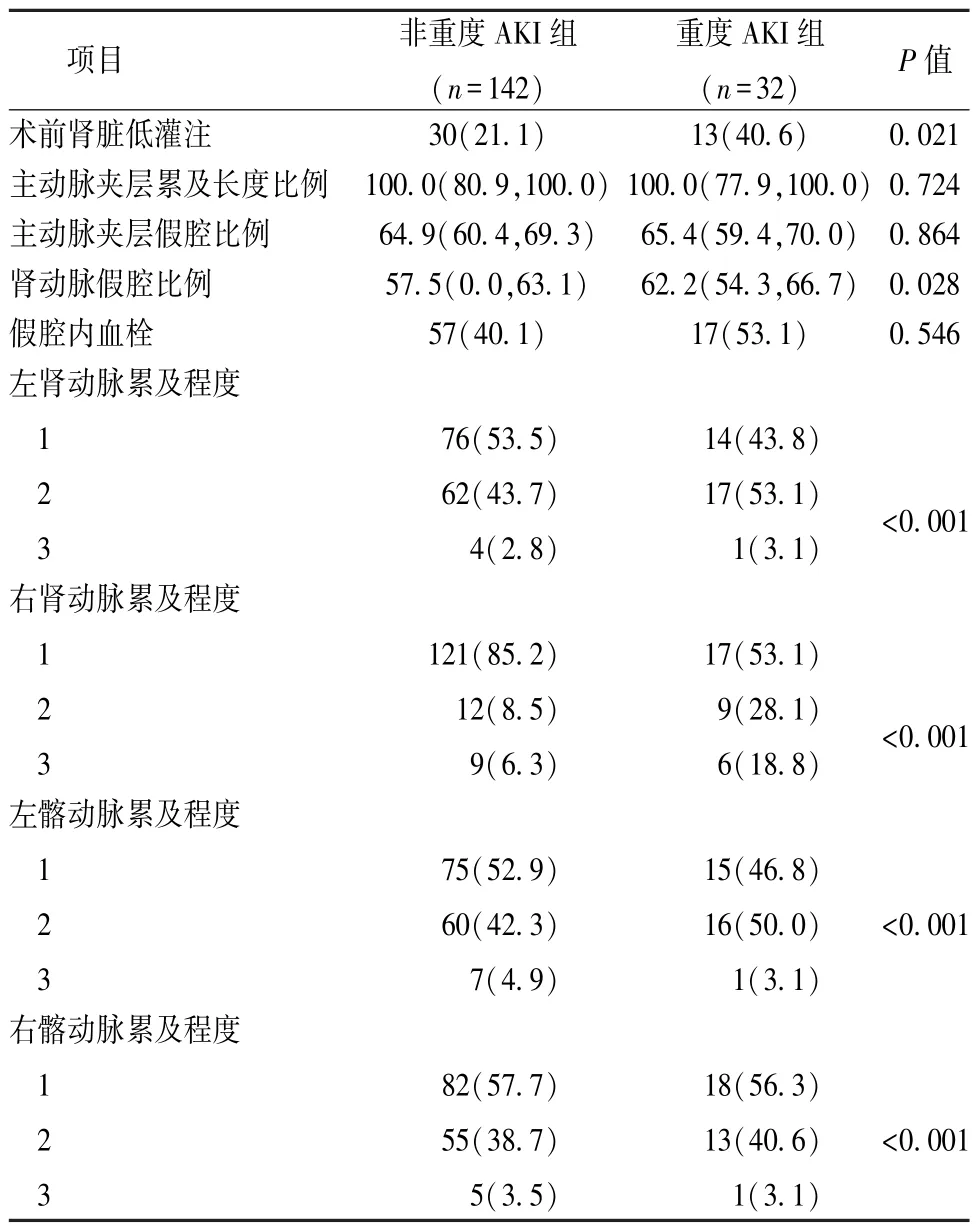
表4 两组术前影像学资料比较[n(%),M(QR)]
讨 论
急性肾损伤是AAAD术后最常见并发症之一,急性A型夹层手术所致AKI患者的病死率为15%~30%,是未发生AKI患者的10~20倍。患者的病死率与其分期密切相关,AKI 3期患者的长期生存率显著降低[11],需要肾脏替代治疗者往往病死率更高。本研究发现58.0%的患者术后发生急性AKI,重度AKI发生率为18.3%,其中死亡率为15.6%,重度急性肾损伤的患者有较长的ICU和住院时长,与以前的研究结果一致[12-13]。
本研究的创新性在于我们用主动脉夹层撕裂长度、夹层假腔撕裂大小、肾动脉假腔的大小和肾动脉累及程度综合评判主动脉夹层的累及特性对术后急性重度肾损伤的影响,我们通过重建主动脉CTA图像,选取升主动脉平面,胸主动脉平面,膈水平面,腹腔干水平面,肾动脉水平面对真腔弧度,假腔弧度长度进行测量,计算假腔长度/主动脉周长×100%评估假腔撕裂的程度,我们通过测量真腔弧度长度和假腔弧度长度,这样避免了内膜片随心动周期的摆动对测量真假腔面积的影响。我们通过对肾动脉累及程度进行量化和计算肾动脉假腔的大小综合评估肾动脉累及的严重程度。尽管主动脉夹层的DeBakey分类和Stanford分类普遍应用,但它是定性的分类,而不是定量的分类。Kurabayashi等[14]研究通过计算主动脉假腔的容积占整个主动脉容积来评估夹层的撕裂程度。Zhang研究[15]计算假腔的体积占体表面积评估夹层的撕裂程度。Wang等[16]仅仅将肾动脉受累分成了单侧和双侧肾动脉累及,并未把肾动脉累及程度进行量化。
研究结果发现影响重度AKI的危险因素有:术前肌红蛋白、术中输注血浆量、术前肾脏低灌注、股动脉插管、双侧肾动脉累及程度。
主动脉夹层的延展可能累及一侧或两侧肾动脉引起肾缺血,肾缺血和再灌注损伤是AKI的常见原因,我们研究发现:术前肾脏低灌注,肾动脉血管累及程度是发生重度AKI的危险因素,这与 Wang等[16]研究结果一致。肾动脉受累会引起肾脏血流灌注量减少、肾小球滤过减少。也可能由于肾动脉受累激活了肾素一血管紧张素一醛固酮系统致使血压升高,导致假腔持续扩张,肾脏血流进一步减少,导致了肾脏组织细胞氧气、营养输送障碍,局部组织氧供需不平衡,由于这种不平衡,管状上皮细胞受损,严重者可出现细胞凋亡和坏死,进而导致AKI的发生。
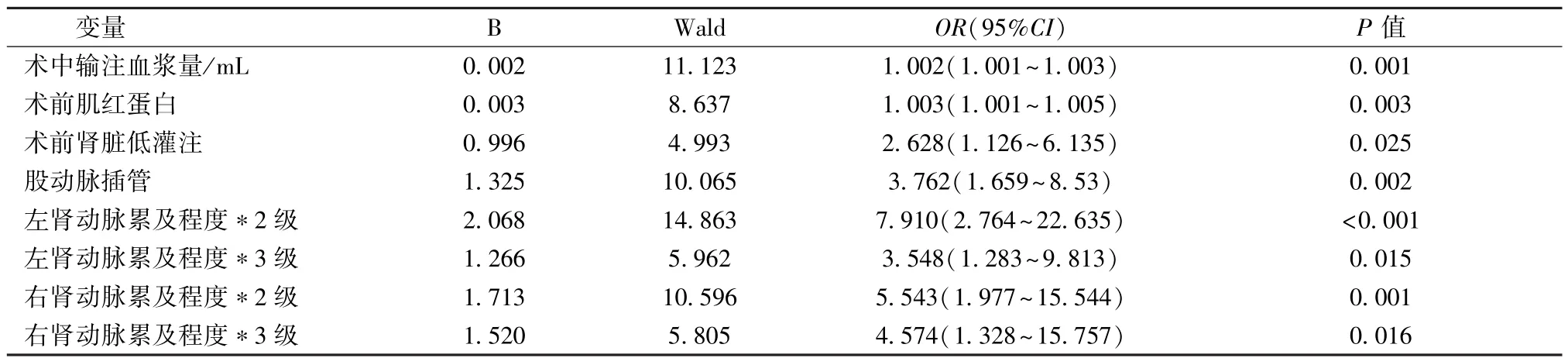
表5 AAAD患者术后并发重度AKI二元Logistic回归分析结果

表6 AAAD患者术后并发重度AKI转归情况[n(%),M(QR)]
我们研究发现股动脉插管增加了术后AKI的发生率,这与Yusuke1等[11,17]研究一致,原因可能为通过股动脉插管导致逆行灌注加剧了撕裂内膜片的损伤,以前的研究报道肾动脉插管增加了内脏低灌注的发生率[18],均导致了肾脏灌注不良。
由于主动脉夹层手术操作复杂,吻合难度高,导致术后止血困难,被迫增加了手术时间,增加了输血量。我们研究发现术中血浆输注量是术后重度AKI的危险因素。有研究表明:围术期使用异体血制品可显著增加心脏术后AKI以及血液透析治疗的发生率[7,19]。可能是因为输注血浆后血浆内的生物活性物质如组胺、蛋白、纤溶酶原抑制剂增加免疫应答,导致了急性肾衰竭[20]。
术前肌红蛋白升高是术后重度急性肾损伤的危险因素,目前较为公认的观点:①肌红蛋白管型阻塞肾小管:肌红蛋白经过肾小球滤过[21],肾小管内肌红蛋白浓度升高,超过肾脏排泄的阈值,形成管型阻塞肾小管,引起管腔内压力增高从而阻碍肾小球的滤过。②肌红蛋白的直接肾毒性:尿液酸性环境下,肌红蛋白分解为珠蛋白和亚铁血红素,后者可诱发氧自由基的形成,二价铁离子血红素在脂质过氧化酶的作用下氧化为三价铁离子,血红素其通过氧化还原作用能够发挥极强的诱导脂质过氧化反应,对肾脏造成很强的氧化损伤[22-23]。
总之,本研究是一个单中心回顾性研究,研究结果是否与其他研究中心一致,尚需要大样本、前瞻性、多中心研究证实。AKI在AAAD患者中发病率高,死亡率高,本研究重在探讨术后重度急性肾损伤与AAAD的累及特性之间的关系,与既往研究相比,为AAAD患者并发重度AKI提供了影像学证据。

