活化转录因子3基因Cas9编辑慢病毒载体的构建及鉴定
周绍酉 周宁 张魁 李扬 赵洋 宋邦荣 郑居兵 刘涛帅 董然
冠状动脉旁路移植术(coronary artery bypass graft,CABG)后静脉桥血管再狭窄严重影响冠心病患者预后,目前尚无有效治疗手段[1]。活化转录因子3(activating transcription factor 3,ATF3)是参与静脉桥血管再狭窄的一个重要因子,在血管炎症反应中起重要作用[2]。CRISPR/Cas9是一种能够对任何物种基因组的特定位点进行精确编辑的技术。使用该技术能够进行细胞水平单基因或多基因敲除。其原理是核酸内切酶 Cas9蛋白通过向导RNA(guide RNA,gRNA)识别特定基因组位点并对双链DNA进行切割[3]。本研究通过构建靶向ATF3基因Cas9编辑下慢病毒载体,并转染人微血管内皮细胞(human microvascular endothelial cell, HMEC)后观察其对ATF3基因表达的抑制作用。
材料与方法
1.一般材料 HMEC,293T cells,U6-sgRNAEF1a-Cas9-FLAG-P2A-EGFP载体(上海吉凯基因化学技术有限公司),Oligo引物(上海捷瑞生物工程有限公司),限制性内切酶BsmBI(Thermo公司),T4 DNA连接酶(Thermo公司),TaqPlusDNA polymerase(Vazyme 公司),移液器(1 000 μL,200 μL,Gilson。 100 mL,BIOHIT)、CO2 培养箱、倒置显微镜、生物安全柜、-80℃低温冰箱、普通冰箱、温度计(0-100℃)、离心机、液氮罐、BCA Protein Assay Kit、RIPA 裂解液、Prestained protein marker、NP-40裂解液、医用X射线光片、X线胶片显影粉、ECLPLUS/Kit。
2.方法 (1)ATF3基因 sgRNA处理:根据GeneBank提供的ATF3基因cDNA编码序列NM_001674为模板,参照sgRNA原则设计,使用BLAST进行同源性分析,设计三条sgRNA靶点序列(GGTGTCCATCACAAAAGCCG, TGTCAGCGACAGACCCCTCG,AAAGTGCCGAAACAAGAAGA),同时设计一条无意义对照sgRNA序列(CGCTTCCGCGGCCCGTTCAA),上游引物 5′-CACCG-3′,下游引物 5′-GTTT-3′,把引物干粉溶解于退火缓冲液中,95℃水浴15 min,然后自然冷却至室温,将退火产物稀释200倍后使用,上下游引物中此时引入限制性内切酶BsmBI结合位点,带有内切酶黏性末端的向导RNA备置完成。PCR反应条件:95℃水浴15 min,然后自然冷却至室温,将退火产物稀释200倍后备用。
(2)ATF3基因Cas9慢病毒载体构建:根据3条连接限制性内切酶黏性末端的向导RNA以及一条无意义序列,分别设计合成双链oligoDNA,与限制性内切酶BsmBI双酶切载体U6-EF1a-Cas9-FLAGP2A-EGFP 进行连接,PCR 鉴定,98℃,5min,1个循环。 98 ℃,10 s,55 ℃,10 s,72 ℃,90 s,30 个循环。72℃,8min,1个循环。4℃保存。退火温度依据引物或基因GC含量而定,退火温度一般设定比引物的温度低5℃。挑选重组阳性克隆,进行测序鉴定。连入sgRNA片段的阳性克隆得到大小为343 bp的条带。
(3)慢病毒包装:转染前用胰蛋白酶消化293T细胞。调整细胞密度为5×106/15 mL,重新接种于10 cm细胞培养皿,37℃、5%CO2培养箱内培养。24 h待细胞密度达70%~80%时用于转染。2 h后更换为无血清培养基。向一灭菌离心管中加入所制备的 DNA 溶液(GV 393质粒 20 μg、pHelper1.0载体质粒 15 μg、pHelper2.0 载体质粒 10 μg),调整总体积为1 ml,在室温下温育15 min。混合液缓慢滴加至293T细胞的培养液中,混匀,于37℃、5%CO2细胞培养箱中培养。培养6 h后弃去含有转染混和物的培养基,加入10 ml的PBS液清洗一次,轻柔晃动培养皿以洗涤残余的转染混和物后倒弃。缓慢加入含10%血清的细胞培养基20 ml,于37℃、含5%CO2培养箱内继续培养48~72 h。根据细胞状态,收集转染后48 h(转染即可为0 h计起)的293T细胞上清液。浓缩病毒并分装保存。
(4)慢病毒滴度测定:测定前一天,使用293T贴壁细胞铺板,96孔板,每孔4×104个细胞,体积100 μL。根据病毒的预期滴度,准备7~10个无菌的EP管,每管中加入90 μL的无血清培养基。取待测定的病毒原液10 μL加入到第一个管中,混匀后,取10 μL加入到第二个管中,继续相同的操作直到最后一管。选取所需的细胞孔,弃去90 μL培养基,加入90 μL稀释好的病毒溶液,培养箱培养。4 h后,加入完全培养基100 μL,4 d后,观察荧光表达情况,荧光细胞数随稀释倍数的增加而减少。
(5)慢病毒转染HMEC:使用感染液将细胞制成3~5×105/mL悬液,接种相应的细胞数到培养板中。铺板后参照预实验确定的MOI加入最适病毒量感染。8~12 h将各孔中细胞收集到干净的1.5 mL EP管中,以2 000 r/min离心2 min,去掉上清液,更换为完全培养基,轻轻混匀后继续培养。
(6)Western blot检测ATF3抑制率:取细胞样品,PBS洗涤两次后,适量预冷的Lysis Buffer裂解,将细胞刮刮下细胞转移入EP管中,冰上裂解10~15 min后超声破碎细胞(200 W共4次,每次5 s,间隔2 s)。 4℃、12 000 min,离心15 min,取上清BCA法测定蛋白浓度,调整每个样品蛋白浓度为2μg/μL,-80℃保存备用。根据 ATF3分子量大小(23kDa)配制相应浓度的胶,胶凝固后,拔去梳子,电泳缓冲液清洗上样孔,将准备好的样品上样。浓缩胶80 mA,20 min。分离胶120 mA,1h。电泳结束后,使用转移电泳装置,在4℃、300 mA恒流条件下电转150 min,将蛋白转移到PVDF膜上。用封闭液(含5%脱脂牛奶的TBST溶液)室温封闭PVDF膜1 h或4℃过夜。封闭液稀释抗体,然后不封闭好的PVDF膜室温孵育2 h,并用TBST洗膜4次,每次8 min。用封闭液稀释相应的二抗,室温下孵育PVDF膜1.5 h,并用TBST洗膜4次,每次8 min。PVDF膜置于平铺好的保鲜膜上,以1:40的比例混合A液和B液,混合液均匀滴加在PVDF膜上,避光反应5 min。将膜取出,稍微沥干多余的ECL底物反应液,放入暗盒,铺上保鲜膜(避免产生气泡),放上X光片(避免 X光片的移动),关上暗盒,曝光1~2 min。取出X光片,放入显影液中,约1 min后取出,在清水中漂洗几秒钟,后放入定影液中2 min。取出X光片,晾干,分析。
3.统计学处理 应用SPSS20.0统计软件进行数据处理。计量资料以均数±标准差表示,两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
结 果
1.ATF3在Cas9干扰下载体构建 (1)基因信息见表1。

表1 基因信息与基因ID
(2)sgRNA序列见表2。

表2 向导RNA信息
(3)目的慢病毒载体::载体名称:GV393,元件顺序:U6-sgRNA-EF1a-Cas9-FLAG-P2A-EGFP,对照编号:CON251,对照插入序列:CGCTTCCGCGGCCCGTTCAA(图1)。

图1 目的病毒载体示意图 注:BsmBI为限制性核酸内切酶,由sgRNA引导内切靶点
(4)合成oligo信息:PCR阳性克隆进行DNA测序,结果与设计序列一致,Cas9载体构建成功 (表 3)。
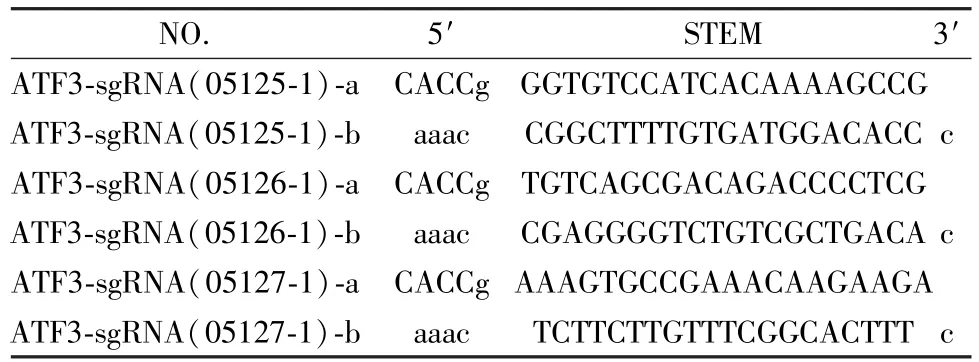
表3 合成核苷酸链信息
2.病毒包装及滴度测定 转染96 h后在荧光倒置显微镜下观察绿色荧光表达,表达GFP的293T细胞数随病毒稀释倍数增加而减少(图2~4,表4)。

表4 三组oligo病毒浓度测定

图2 LV-ATF3-sgRNA(05125-1)细胞免疫荧光照片 注:b和g分别表示明视野和荧光视野

图3 LV-ATF3-sgRNA(05126-1)细胞免疫荧光照片 注:b和g分别表示明视野和荧光视野

图4 LV-ATF3-sgRNA(05127-1)细胞免疫荧光照片 注:b和g分别表示明视野和荧光视野
3.慢病毒转染HMEC 倒置荧光显微镜荧光视野和明视野进行对比,感染可达到80%转染率,在KO1、KO2、KO3组细胞感染及生长状态良好,GFP可持续稳定表达。细胞感染及生长状态良好,GFP可持续稳定表达。如图5所示。
4.错配酶切检测 本实验阳参的扩增片段大小为456 bp,酶切片段大小分别为 151 bp、303 bp,用来作为实验对比,验证实验操作结果准确性,本实验错配酶中,阳参酶切结果正常。酶切反应体系为:纯化产物 2~3 μL,Detecase Buffer2μL,加入 ddH2O 10 μL。在45℃反应20 min后立即向上述10 μL体系内加入2 μL Stop Buffer。Cas9-ATF3基因片段下方杂带通过升高退火温度来降低。
如图6所示,PCR检测到目的大小条带。KO1、KO2、KO3靶点均有活性。将活性检测中有效的靶点的PCR产物切胶回收后构建T载体,蓝白斑筛选,每个靶点测30个单克隆进行测序,运用软件对测序结果进行分析,对比靶点的有效突变率。测序结果分析:本实验中PCA05125靶点,共测通30个克隆,5个插入缺失突变,3个无插入缺失突变,4个插入突变,10个缺失突变,6个大片段缺失突变,2个双峰,可以得出该靶点的突变率达到80%以上。Cas9对ATF3基因突变有效。
根据酶切片段,三个靶点均有正常切割条带,根据灰度分析情况,如图7,KO3组细胞错配酶差异性最大,碱基突变率明显,因此本实验选择 KO3(PCA05127)做慢病毒载体鉴定试验。

图5 慢病毒转染细胞 注:b和g分别表示明视野和荧光视野

图6 混合克隆错配酶筛靶 注:左侧为酶切前,右侧为酶切后。PC:阳性条带对照。M:Ladder Marker(条带从小到大分别为100 bp,250 bp,500 bp,750 bp,1 000 bp,1 500 bp, 2 000 bp, 3 000 bp, 5 000 bp)。 KO1、KO2、KO3:实验组对应的3个靶点。NC:各实验组对应的阴性对照

图7 错配酶灰度分析 注:KO1、KO2、KO3:实验组对应的3个靶点。PC:阳性条带对照。M:Ladder Marker(条带从小到大分别;100 bp, 250 bp,500 bp,750 bp,1 000 bp,15 00 bp, 2 000 bp, 3 000 bp, 5 000 bp)。 KO1、KO2、KO3:实验组对应的3个靶点。NC:各实验组对应的阴性对照
5.Western blot检测ATF3抑制率 其引物信息如下:内参基因 GAPDH,其上游引物序列为TGACTTCAACAGCGACACCCA,下游引物序列为CACCCTGTTGCTGTAGCCAAA,扩增片段大小为121 bp。目的基因为ATF3,其上游引物序列为GCTAAGCAGTCGTGGTATG,下游引物序列为CTGGAGTTGAGGCAAAGAT,扩增片段大小为225 bp(图8)。

图8 Western blot筛选有效靶点电泳图 MOCK:空细胞。NC:阴性对照病毒感染组。KO:sgRNA病毒感染组。H:高曝光,L:低曝光,目的细胞为人微血管内皮细胞,GAPDH:甘油醛-3-磷酸脱氢酶
在阳参细胞中检测到目的条带,大小与预期相符,表明此次WB实验体系工作正常。在目的细胞HMEC中检测到目的条带,KO组相对NC明显下调。即sgRNA对ATF3基因的编辑在蛋白水平观察到表达量的改变。ATF3基因在Cas9干扰下简表达载体构建成功(图9)。

图9 Western blot灰度分析图MOCK:空细胞。NC:阴性对照病毒感染组。KO:sgRNA病毒感染组
讨 论
CABG是治疗重症冠心病的有效方法,大隐静脉是常用静脉桥血管,但静脉桥血管远期通畅率低于乳内动脉,静脉桥血管再狭窄影响患者术后生存质量[4]。研究结果表明,内皮功能失调是CABG术后静脉桥血管再狭窄的始动环节。术后静脉桥血流压力突然增高,血管过度扩张引起管壁损伤,导致内皮结构及功能变化,内皮细胞增生,PCT和WBC迅速黏附,加速急性血栓形成,导致内膜增生[5]。同时,炎性细胞与内皮细胞黏附后进入内皮,在细胞因子和生长因子影响下,移行为巨噬细胞,吞噬脂质后转化为泡沫细胞,引进粥样斑块形成,中膜平滑肌细胞增殖并向内层迁移,多种因素共同作用,最终导致桥血管再狭窄[6]。
CRISPR/Cas9是一种能够对任何物种基因组的特定位点进行精确编辑的技术。使用该技术能够进行细胞水平单基因或多基因敲除。其机制是核酸内切酶Cas9蛋白通过向导RNA识别特定基因组位点并对双链 DNA进行切割。相较于 RNA干扰(RNA interference,RNAi)技术来讲,更加精确特异性下调细胞目的基因的表达。
转录激活因子3是ATF/CREB转录因子家族的成员,ATF/CREB家族包括一系列分子,它们的共同特点是都具有亮氨酸拉链结构,通过与cAMP反应元件的启动子共同序列“TGACGTCA”相结合来调控基因的转录[7]。大量的证据表明,在正常条件下稳定表达,但是在应激条件下ATF3的mRNA的表达水平大大增加(如:活性氧,紫外刺激,心肌缺氧,药物影响等)。在动物模型中,在心肌缺血和心肌缺血再灌注,肝缺血,肝部分切除,化学物质如乙醇、四氯化碳、对乙酰氨基酚作用,癫痫发作,在肾脏的肾缺血再灌注损伤,皮肤受创,外周神经损伤,激活胸腺细胞CD31诱导ATF3[8]。在培养的细胞,ATF3是由多种信号诱导的,包括细胞活素类,遗传毒物如紫外线和电离辐射和已知诱导细胞死亡的药物或JNK/SAPK信号转导通路,如茴香霉素,环己酰胺、阿霉素。由此表明ATF3是一个应激诱导性基因[9]。
本研究中,通过构建慢病毒载体,并包装获得有感染能力的慢病毒颗粒,成功转染HMEC,转染率>80%。正常状态下ATF3低表达或不表达,验证3个不同序列的抑制效果,避免了低表达基因的检测困难,并寻找到一条既高效、且确切稳定阻断ATF3表达的序列(LV-ATF3-sgRNA(05127-1)。
Cas9编辑慢病毒与一般载体相比,慢病毒载体可感染分裂期与非分裂期细胞,其整合到基因组中可实现长时间稳定表达,且滴度较反转录病毒体系更好。同时,慢病毒属缺陷病毒,不会对细胞的连续传代产生不良影响。从免疫印迹检测该载体构建结果来看,在目的细胞载体细胞中检测到目的条带,KO组相对NC明显下调(P<0.05)。
近年的研究发现,ATF3在心血管系统的含量与各种心血管疾病相关,如缺血再灌注损伤,心肌肥厚,心力衰竭和血管系统疾病等[10]。本研究成功构建了靶向ATF3基因敲除慢病毒载体,成功找到一个高效 抑制ATF3表达的质粒。为进一步研究ATF3在静脉桥血管再狭窄中早期内皮功能失调作用机制奠定了基础,并为探索桥血管再狭窄基因治疗提供实验依据。

