巨噬细胞特异性敲除一磷酸腺苷激活依赖性蛋白激酶基因的小鼠模型构建
郑帅 刘燕 朴春梅 刘婷婷 王吉静 王绿娅 杜杰
高血压是最常见的心血管疾病之一,我国18岁以上人群患病率约为23%[1];高血压也是导致中风、心梗、主动脉瘤等诸多心脑血管疾病的重要危险因素[2]。巨噬细胞参与调节钠敏感性的血压变化[3],更广泛参与高血压状态下的心脏、肾脏、脑等靶器官的炎症反应和病理生理改变[4],但其作用机制尚不完全清楚。一磷酸腺苷激活依赖性蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)是调节细胞能量代谢和功能的核心激酶,其催化亚单位(α subunit)在巨噬细胞中主要表达为α1型(PRKAA1)。既往报道中,AMPK信号通路能够抑制巨噬细胞的致炎功能,使之更多的表现为抗炎表型[5]。因此,AMPK可能是介导巨噬细胞对于血压调节和高血压条件下靶器官损伤的重要调控分子。故本研究采用Cre/loxP重组酶系统,构建和培育巨噬细胞特异性敲除AMPKα1基因的小鼠,在此基础上初步检测这种敲除对于血压的影响,为进一步研究巨噬细胞AMPK信号通路在高血压疾病损伤中的作用和机制奠定基础。
材料与方法
1.仪器和试剂 电加热模块(美国 Thermo Fisher公司),凝胶电泳仪、凝胶成像仪、Real-time PCR仪(美国Bio-Rad公司),核酸荧光定量仪(美国Thermo Fisher-Invitrogen公司),小动物血压心电系统(国产森西公司)。他莫昔芬(美国Sigma公司),鼠尾消化液DirectPCR(美国VIAGEN公司),蛋白酶K和Taq-Master Mix 2X(康为公司),TRIzol试剂(美国Thermo Fisher-Invitrogen公司),反转录试剂盒(美国Promega公司),SYBR聚合酶链反应(PCR)试剂盒(日本TaKaRa公司),基因型鉴定和Real-time PCR检测用的引物对(北京诺赛基因组研究中心有限公司)。
2.实验动物及分组 AMPKα1-loxP转基因小鼠(AMPKα1fl/wt),以及集落刺激因子受体的启动子(colony stimulating factor 1 receptor,Csf1r)驱动表达雌激素受体-Cre融合蛋白的转基因小鼠(Csf1r-MeriCre-Mer),均购自美国 Jackson实验室,均为C57BL/6 J品系背景。两种小鼠杂交繁育,子代进一步杂交,培育携带纯合型AMPKα1-loxP和Cre(或不携带 Cre)的转基因小鼠(AMPKα1fl/fl/Csf1r-MerCre及 AMPKα1fl/fl/WT)。实验小鼠均饲养于SPF级环境,恒温恒湿,12 h明-暗昼夜节律。本实验得到北京安贞医院伦理委员会批准。
3.培育条件诱导的组织特异性敲除AMPK的小鼠 将AMPKα1-loxP转基因小鼠相互交配,得到AMPKα1fl/fl转基因小鼠,再与Csf1r-MerCre转基因小鼠杂交,得到AMPKα1fl/fl/Csf1r-MerCre转基因小鼠,以及AMPKα1fl/fl/WT转基因小鼠,两种子代小鼠进一步交配,繁育更多具备两种基因型其中之一的小鼠。对于AMPKα1fl/fl/Csf1r-MerCre小鼠,腹腔注射他莫昔芬,激活Cre酶,剪切掉AMPKα1第3外显子,破坏AMPKα1的基因(Prkaa1)结构,使之无法正常表达。该过程如图1所示。对照小鼠为AMPKα1fl/fl/WT小鼠。
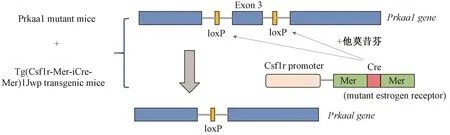
图1 转基因小鼠培育过程
4.小鼠基因型的鉴定 将各杂交繁育阶段的4周龄子代小鼠,剪取鼠尾末梢组织,用鼠尾消化液:蛋白酶K为100∶1比例的混合液100 μL浸泡,56℃加热并间断振摇使鼠尾组织完全消化溶解,之后85℃加热40 min变性,提取的DNA溶液进一步进行PCR扩增,扩增产物用琼脂糖凝胶电泳鉴定分子量大小,从而确定小鼠基因型。用于AMPKα1基因型鉴定的 PCR引物序列为:上游引物5′-CCCACCATCACTCCATCTCT-3′,下游引物 5′-AGCCTGCTTGGCACACTTAT-3′,PCR 条件为:94℃3 min,然后按94℃30秒、62℃30秒、72℃30秒的步骤循环35次,接72℃2 min,10℃保持。用于MerCre基因型鉴定的PCR引物序列为:上游引物5′-AGATGCCAGGACATCAGGAACCTG-3′,下 游 引 物 5′-ATCAGCCACACCAGACACAGAGATC-3′,PCR 条件为:94℃ 1.5 min,然后按94℃30秒、62℃45秒、72℃45秒的步骤循环35次,接72℃2 min,10℃保持。
5.他莫昔芬诱导敲除目的基因 给8周龄的小鼠腹腔注射他莫昔芬溶液(浓度为20 mg/mL,溶于食用玉米油),每天注射1次,每次注射0.1 mL(即2 mg/d),连续注射5 d,以诱导Mer-Cre融合蛋白转入细胞核,剪切目标基因的 loxP位点,敲除AMPKα1基因。在开始注射的第6天开展各项实验检测。
6.骨髓细胞AMPKα1基因mRNA表达水平的检测 8周龄的 AMPKα1fl/fl/Csf1r-MerCre鼠和AMPKα1fl/fl/WT鼠各取6只,连续注射他莫昔芬5 d,在第6天将小鼠使用戊巴比妥钠麻醉处死后,分离右后肢胫骨,剪开两端,用1 mL注射器灌注0.9%氯化钠液冲洗骨髓腔,用Ep管收集冲洗下来的细胞悬液,5 000 rpm离心5 min,弃上清,加1 mL的Trizol裂解骨髓细胞,之后用 0.2 mL氯仿抽提RNA,接着用0.5 mL异丙醇沉淀RNA,再用0.5 mL的75%乙醇清洗RNA沉淀两遍,最后用15 μL的DEPC水溶解RNA。RNA溶液使用Qubit 3 Fluorometer测定浓度,取 2 μg 总量的 RNA,使用Promega公司逆转录试剂盒,按标准反应体系和流程条件反转录得到 cDNA。各样本的 cDNA按SYBR(II)PreMix酶20 μL反应体系条件进行Realtime PCR检测,得到的Ct值计算 ΔΔ-Ct,用于统计目标RNA水平的组间差异。AMPKα1的引物序列为: 上游 5′-TACTCAACCGGCAGAAGATTCG-3′, 下游 5′-AGACGGCGGCTTT CCTTTT-3′;内参基因 βactin的引物序列为:上游5′-GGCTGTATTCCCCTCCATCG-3′,下游 5′-CCAGT TGGTAACAATGCCAT GT-3′。 Real-time PCR 反应条件为:94℃2 min,然后按94℃5秒、60℃34秒、72℃30秒并拍照荧光信号的步骤反应40个循环,最后10℃保持。
7.小鼠血压的测定 使用国产森西公司的BP2 010 A系统,将未麻醉的小鼠诱导进拘束笼中,留鼠尾在外。拘束笼放在恒温套管内,保证37℃恒温环境。将袖套式血压探头套在鼠尾根部,固定位置,待小鼠平静、血压监测曲线稳定后,记录连续五次测定的血压值,取平均值作为当次的小鼠血压。首先取8周龄AMPKα1fl/fl/WT鼠10只,随机分为两组,其中一组注射他莫昔芬5 d,第6天检测两组血压。再取 8周龄 AMPKα1fl/fl/Csf1r-MerCre鼠 13只,AMPKα1fl/fl/WT鼠10只,均注射他莫昔芬5 d,第6天检测两组血压。
8.统计学方法 统计数据使用Graphpad Prism 5.0软件进行分析。计量资料以均数±标准差表示,计量资料间两组均数比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1.巨噬细胞特异性敲除AMPKα1的转基因小鼠的基因型鉴定 剪取4周龄小鼠的鼠尾,提取DNA,对目标片段进行PCR扩增后,跑1%浓度琼脂糖凝胶电泳进行鉴定。代表性结果如图2所示,2 A为对AMPKα1-loxP片段区域扩增的结果,野生型AMPKα1该区域片段为334 bp,而AMPKα1-loxP片段为450 bp,可见样本1~5均为纯合型AMPKα1-loxP阳性转基因鼠(AMPKα1fl/fl);2B为对 Csf1r-Mer-Cre片段区域扩增的结果,该片段为236 bp,可见样本1、2、5为Cre阳性,而样本3、4为 Cre阴性。综合起来,样本 1、2、5为成功构建的 AMPKα1fl/fl/Csf1r-MerCre小鼠,而样本 3、4为 AMPKα1fl/fl/WT对照小鼠。
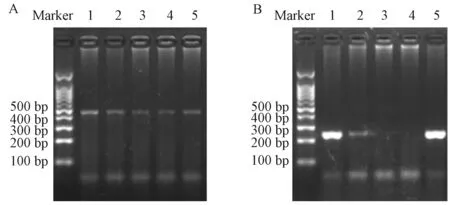
图2 转基因小鼠子代基因型鉴定结果 A:AMPKα1-loxP基因片段的条带;B:Csf1r-Mer-Cre基因片段的条带
2.PCR检测他莫昔芬诱导敲除巨噬细胞AMPK的效果 对 AMPKα1fl/fl/Csf1r-MerCre小鼠和AMPKα1fl/fl/WT对照小鼠注射他莫昔芬5 d,提取骨髓细胞RNA,进行Real-time PCR检测AMPKα1表达水平,结果如图3所示,可见相比野生型小鼠,AMPKα1敲除鼠的目标基因RNA水平显著降低,相对表达量只有野生对照的1/2左右[(0.9263±0.1293)vs.(0.47±0.04657),P <0.01],证明诱导敲除巨噬细胞中的AMPK是成功的。
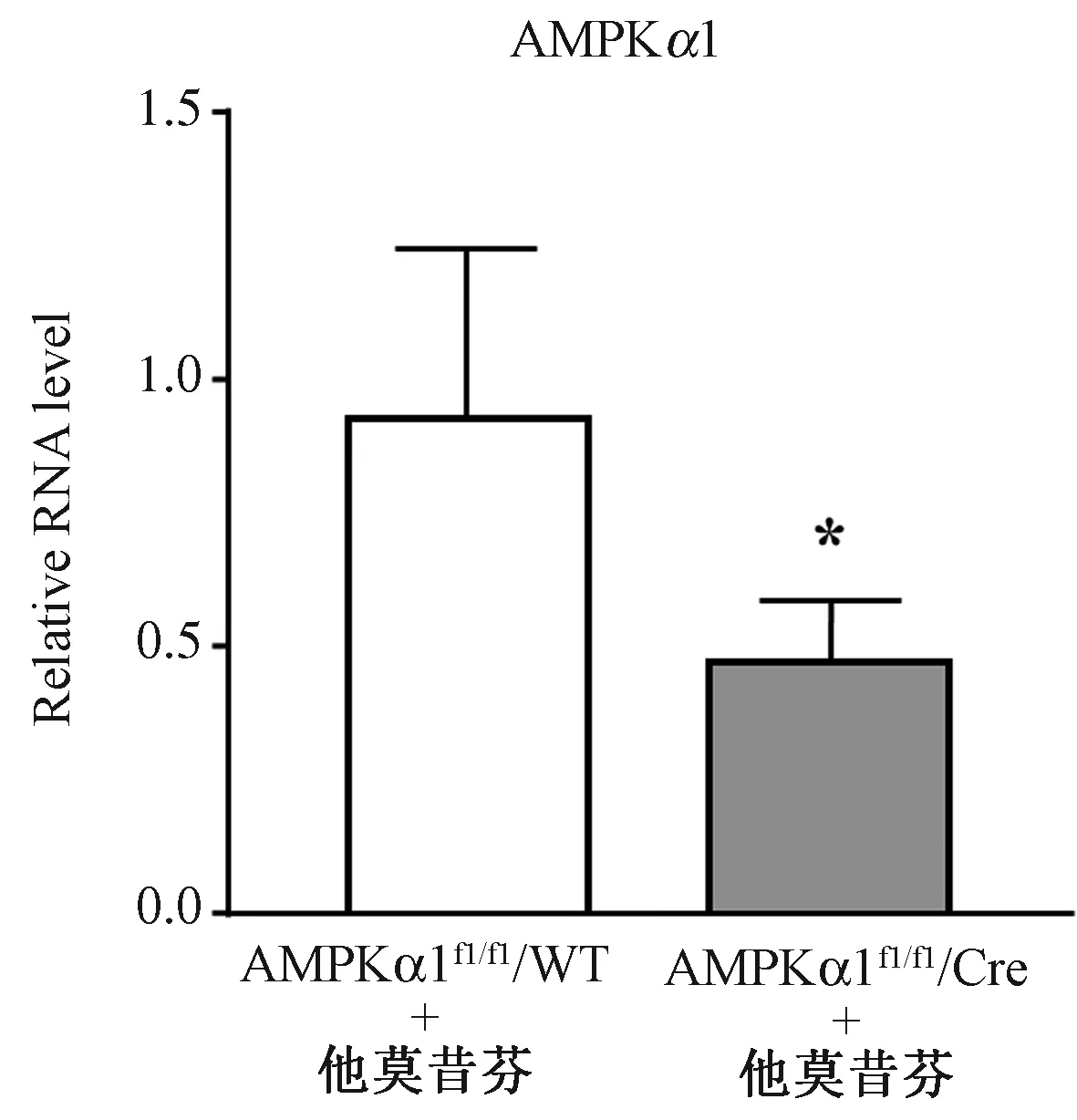
图3 Real-time PCR检测 AMPKα1基因的表达量(与Cre野生型对照鼠相比,∗P<0.01)
3.检测敲除巨噬细胞AMPKα1对于小鼠基础血压的影响 我们首先检测了他莫昔芬对于基础血压的影响,结果如图4 A所示,可见该药物腹腔注射对基础收缩压的影响很小[Cre野生鼠,不注射 vs.注射,收缩压(122.9±3.183)vs.(124±6.878)mm-Hg,1 mmHg=0.133 kPa,P=0.427],同时两组小鼠的舒张压和体质量差异无统计学意义[不注射 vs.注射,舒张压(72.48±1.686)vs.(75.86±2.502)mmHg,P=0.31];体质量[(25.3±1.02)vs.(25±1.19)g,P>0.999]。 进一步检测 AMPKα1敲除鼠和野生型对照鼠在注射他莫昔芬5 d之后,各自的血压水平,结果如图4B所示,可见特异性敲除巨噬细胞AMPKα1会导致基础水平的收缩压显著降低(对照鼠 vs敲除鼠[收缩压(123.5±3.577)vs.(107.5±4.814)mmHg, P=0.037],而两组小鼠的舒张压和体质量差异无统计学意义[(对照 vs.敲除,舒张压(74.17±1.53)vs.(70.88±3.61)mmHg,P=0.17;体质量(5±0.74)vs.(23.86±0.48)g,P=0.15]。
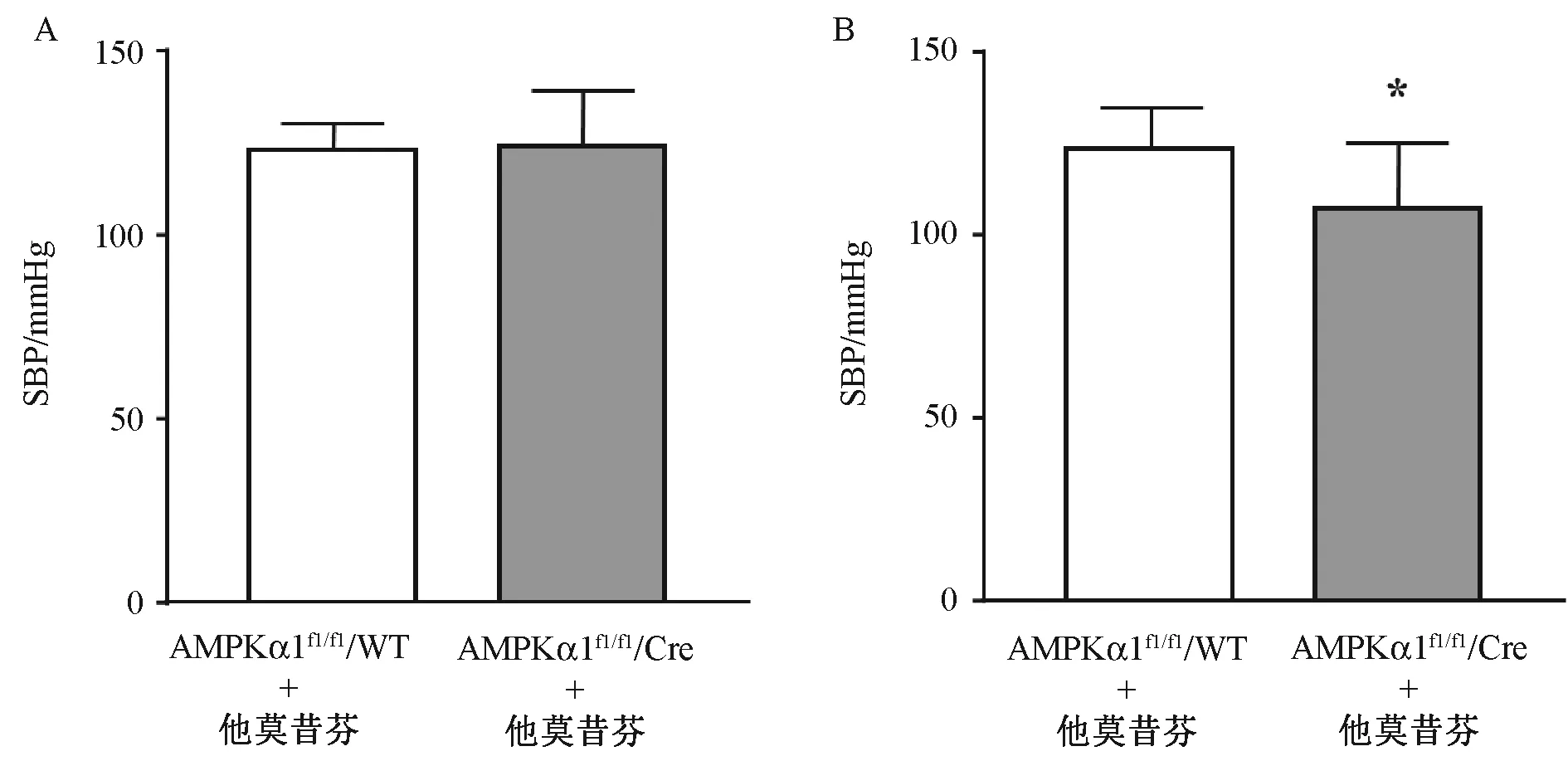
图4 检测不同基因型小鼠的基础血压差异 A:Cre野生型小鼠在不注射和注射他莫昔芬条件下的基础血压;B:Cre野生型小鼠和Cre阳性小鼠都注射他莫昔芬后的基础血压(与Cre野生型对照鼠相比,∗P<0.01)
讨 论
高血压是世界各国共同面对的重大公共卫生疾病之一。以 SBP超过 140 mmHg、DBP超过 90 mmHg为标准,则全球约有10亿人患有高血压[6]。其中西方国家高血压的发病率高达总人口的1/3,且其发病率随年龄增加而升高,在70岁左右的人群中约70%有高血压[2]。我国同样面临着高血压疾病发病率高的问题,2018年初发表的项研究证实,18岁以上人群中,约23.2%的受访者患有高血压,另有41.3%的受访者处于高血压前期[1]。高血压容易累及多种脏器,如心脏、肾脏等,导致其损伤和发生纤维化病变,进而引起心梗、血管钙化、主动脉瘤等诸多疾病[2,7]。这种损伤主要是通过促进炎症反应而造成的,巨噬细胞等炎症细胞在其中发挥了重要作用。巨噬细胞按其表型和功能,可分为促进炎症和纤维化损伤的M1型,以及发挥抗炎作用的M2型,其功能表型可以受所处微环境变化的影响而发生转变,呈现出很强的可塑性[8]。目前的研究认为,高盐、血管紧张素AngII等可以促进巨噬细胞分化为M1型、并增加在心脏、肾脏和血管的浸润,从而促进高血压的发展和靶器官的损伤[9-11]。此外,还有研究表明,巨噬细胞参与调控盐离子诱导的血液变化[3]。因此,深入研究巨噬细胞在血压调控和高血压状态下的功能和作用机制,将为高血压及相关疾病的治疗提供新的思路。
一磷酸腺苷激活依赖性蛋白激酶AMPK是调节细胞能量代谢和功能的核心激酶,其催化亚单位(α subunit)在巨噬细胞中主要表达为α1型。既往报道中,AMPK信号通路能够抑制巨噬细胞的致炎功能,使之更多的表现为抗炎表型[5]。具体机制方面,JAK/STAT信号通路是已知调节巨噬细胞表型分化的几条信号通路之一[12],其中 STAT1介导IFNγ的信号,促进巨噬细胞分化为 M1型[12],STAT3则是被广泛证实促使巨噬细胞表现为 M2型[13],而既往报道证实AMPK对STAT1和STAT3均有调控作用[14-15]。因此,AMPK可能通过多种机制,使巨噬细胞在不同微环境条件下分化为不同的表型,进而对血压调节以及高血压状态下的器官损伤产生不同的作用。
鉴于AMPK广泛存在于各种组织器官细胞中,在心血管系统中发挥着重要的保护作用,如抑制心肌和血管内皮细胞凋亡等等[16-17]。为了避免非特异性敲除AMPK带来的副作用,并清晰揭示AMPK对于巨噬细胞功能的影响,本研究采用Cre/loxP重组酶系统,通过集落刺激因子的启动子驱动表达雌激素受体-Cre融合蛋白,保证了在巨噬细胞中特异性表达Cre酶,并在他莫昔芬药物诱导下将Cre酶定位到细胞核,剪切AMPKα1基因第三外显子两端的loxP位点,从而破坏AMPKα1基因结构、实现巨噬细胞特异性的诱导敲除AMPKα1基因。基因型鉴定和RNA鉴定结果都证实了敲除鼠构建成功。在此基础上,我们证实了这种敲除能够显著降低基础收缩压,证实敲除巨噬细胞AMPKα1基因对血压有明显调节作用。鉴于既往文献报道,高盐诱导高血压条件下,巨噬细胞浸润到血管外膜,释放TNF-α,抑制交感神经α2-肾上腺素能自受体的功能,释放更多的去甲肾上腺素,从而升高血压[18];也有文献报道证实,特定条件下,巨噬细胞会释放VEGFC,从而降低血压[3]。而AMPK既可以调节巨噬细胞的表型[5],又参与调控 VEGF-eNOS等信号通路[19],因此,敲除AMPK可能影响了巨噬细胞上述两方面的功能,从而降低血压。后续的研究工作将从这些方面深入分析巨噬细胞调控血压的机制。

