微创冠状动脉杂交在冠状动脉多支病变中的临床应用
刘硕 尤斌 陈长城 李平 徐屹 许李力 李光 曲政 张竞为
冠状动脉杂交(hybrid coronary revascularization,HCR)指结合微创冠状动脉旁路移植(minimally invasive direct coronary artery bypass,MIDCAB)及冠状动脉介入治疗(percutaneous transluminal coronary intervention,PCI)的方法,在部分有选择性的冠状动脉多支病变的患者中应用的一种技术[1]。它结合了心外科左乳内动脉(left internal mammary artery,LIMA)到左前降支(left anterior descending branch,LAD)“黄金桥”远期通畅率高,及心内科药物涂层支架技术进步带来的支架内再狭窄率降低的优点,可以减少损伤,改善远期疗效,在临床上得到了一定程度的应用。北京安贞医院心脏外科微创病房从2010年开始进行微创心脏外科手术的探索,[2]现对施行的HCR的患者做一总结。
资料与方法
1.患者总体情况及杂交手术分类 2010年7月至2018年12月,北京安贞医院心外科微创病房针对符合指征的多支冠状动脉病变患者,共进行MIDCAB合并心内科PCI患者57例,其中一站式HCR手术4例,先行MIDCAB再PCI 33例,先行PCI再行MIDCAB 20例。男性43例,女性14例,平均年龄(58.1±11.8)岁,体质量(71.8±11.9)kg,所有患者均进行了冠状动脉造影检查,4例患者进行了一站式HCR手术,均为LAD合并右冠状动脉病变患者,首先进行了微创LIMA-LAD的CABG术,CABG术后不使用鱼精蛋白中和肝素,直接进行心内科PCI治疗。
分站式杂交患者中33例患者首先进行了MIDCAB术,待拔除气管插管及引流管,血常规白细胞值恢复正常后转入心内科,择期行其他冠状动脉的介入手术,肾功能不全患者可适当延长时间。20例患者首先在心内科进行了PCI治疗,其后转入我科择期进行MIDCAB术。其中8例患者为急性心肌梗塞患者,其中右冠闭塞7例,左冠系统闭塞1例,12例为前降支弥漫性狭窄、严重钙化、闭塞、支架内再狭窄或前降支根部病变考虑更佳的远期疗效而不能进行PCI治疗(表1)。
2.心外科MIDCAB手术 手术均在全身麻醉双腔气管插管下进行,术前置入食管超声探头并记录相关数据。常规粘贴体外除颤电极。根据患者心脏位置选择左胸第4或第5肋间。以左锁骨中线为中点,沿肋间隙横行切开,切口长约6~8 cm,进胸后行左肺萎陷,应用微创专用平台开胸器牵开胸壁,直视下用专用微创长柄器械游离LIMA。1 mg/kg肝素化后,经膈神经以上2 cm纵行切开心包,并分别悬吊牵引出体外。按常规普通切口旁路移植的方法,心表固定器固定,阻断带阻断后,剖开前降支,以普通CABG器械用7-0 prolene线连续缝合进行LIMALAD的吻合。吻合完成后以超声流量仪测定桥血管通畅情况,鱼精蛋白中和肝素,放置胸腔引流管一根,关胸。

表1 HCR患者57例基本情况表
3.心内科PCI操作 由心内科医生在导管室行介入治疗。经股动脉或桡动脉穿刺插入引导导管,先以与血管直径相等球囊预扩张狭窄的血管,然后置入药物涂层支架(drug-eluting stent,DES)。先期已进行CABG的患者可以进行LIMA造影显示桥血管是否通畅。术后应用阿司匹林和氯吡格雷双联抗血小板治疗。
4.关于心内外科抗血小板药物的使用问题 在“一站式”HCR手术中,患者常规置入胃管,首先按照常规CABG的方法进行手术,手术结束后,不使用鱼精蛋白中和肝素,经胃管内注入300 mg阿司匹林及300 mg波立维后进行冠状动脉介入治疗,全部手术结束返回监护室后监测保持活化部分凝血活动时间(ACT)在250 s以上,同时在术后第2天开始口服阿司匹林100 mg/d加氯吡格雷75 mg/d(或替格瑞洛90 mg,2次/d)。先行MIDCAB的患者,手术次日起开始口服阿司匹林100 mg/d,待手术后伤口引流减少拔除引流管、胸X线片或胸水B超确定无胸腔积液、血常规复查显示白细胞及中性粒细胞百分比恢复正常范围后转入心内科,再按照心内科抗血小板方案进行处理。先进行心内介入治疗的患者,在心外科手术5 d前停用波立维,皮下注射低分子肝素12 h/次,阿司匹林持续应用至手术前1 d,手术当日停用,术后第1天开始口服或经胃管注入常规阿司匹林100 mg/d及氯吡格雷75 mg/d。以上所有患者在微创旁路移植术后6 h如引流量不多,没有活动性出血,开始静脉应用肝素抗凝。
5.统计学分析 采用SPSS 22软件进行统计学处理。正态分布计量资料以均数±标准差表示,非正态分布资料采用中位数(M)及四分位数间距(P25,P75)表示。计数资料以频数或百分比表示。
结 果
57例患者共旁路移植血管60根,其中单独LIMA-LAD旁路移植57例,合并大隐静脉-对角支旁路移植2例,双乳内动脉旁路移植(LIMA-对角支,右乳内动脉-LAD)1例。外科手术时间中位数3.6(2.5,5.5)h,术后第一天引流量中位数为463(50,1 800)mL,心内科PCI放置支架79枚,其中右冠状动脉62枚,旋支17枚,药物球囊扩张1例(表2)。
表2 HCR 57例患者心内外科相关数据[±s,M(QR),n]
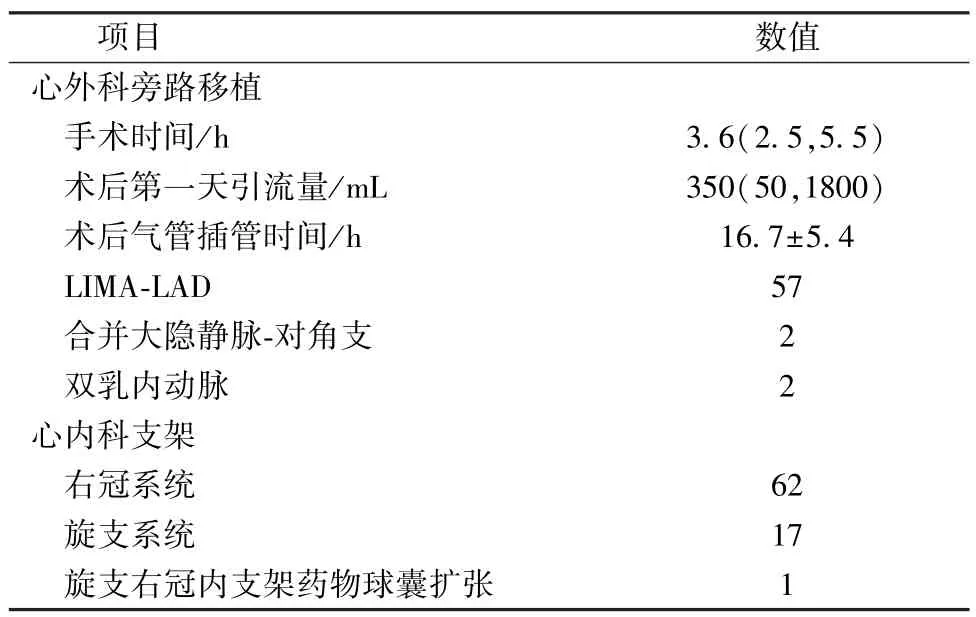
表2 HCR 57例患者心内外科相关数据[±s,M(QR),n]
项目 数值心外科旁路移植手术时间/h 3.6(2.5,5.5)术后第一天引流量/mL 350(50,1800)术后气管插管时间/h 16.7±5.4 LIMA-LAD 57合并大隐静脉-对角支 2双乳内动脉 2心内科支架右冠系统 62旋支系统 17旋支右冠内支架药物球囊扩张 1
讨 论
冠心病的治疗方式包括药物治疗、内科介入治疗和外科手术治疗三种。其中药物治疗是基础,进一步选择介入还是外科手术治疗在临床上有一部分交叉。随着技术的发展进步,心内科从冠状动脉球囊扩张(PTCA)、裸金属支架(bare-metal stent,BMS)到DES,心外科从体外循环并行CABG术、非停跳CABG术到MIDCAB,使得这两种治疗技术的最优治疗方案的组合应用以使达到更好的治疗效果成为可能。
CABG中乳内动脉-前降支吻合远期通畅率高[3],长期随访证明,左侧乳内动脉10年通畅率超过90%。同时有文献证明,新一代的药物涂层支架的远期通畅率优于大隐静脉桥[4-5],前降支重度病变同时有回旋支或右冠状动脉局限性狭窄的病例,完全可以选择杂交手术的方式,而且确实有它的优势[6]:即微创外科旁路移植的低损伤和介入治疗后的完全再血管化给患者带来的益处。以上属于选择性HCR,对于急性冠状动脉综合征的患者,在急症期对罪犯血管进行 PCI缓解病情后,二期行MIDCAB也属于HCR[7],但是HCR中CABG与PCI的血运重建区域不能存在交集。对于一些特殊病例,可以设计特殊的治疗方案达到更好的远期效果。比如年轻的无保护左主干病例,可以先进行MIDCAB术保证LAD通畅后再转到内科进行左主干狭窄和回旋支血管的处理;再比如我们进行的1例39岁右冠状动脉局限性病变PCI治疗后,再微创取双乳内动脉进行左乳内-前降支,右乳内-对角支旁路移植,以获得最好的远期疗效。另外对角支等血管也有问题的患者,如果内科不容易处理,也可以移植1支静脉桥,也应该算广义的HCR范畴里。我们就有2例患者除了乳内桥之外另外移植了1支到对角支的静脉桥解决缺血问题。对于年轻患者,考虑到患者的预命问题,在PCI治疗或CABG术上应该慎重选择,必要是可以进行核素心肌灌注显像明确心肌缺血情况再决定是否干预[8]。
关于一站式杂交手术的问题。它的优点很明显,从理论上讲是目前最理想的处理方式。首先进行MIDCAB后前降支供血,大大增加了心内科PCI术的安全性,这在严重的左主干病变和前降支根部病变的患者中尤其重要,其次PCI失败或CABG失败则随时可以应用另一种方法补救。但是这种方法也存在一些问题,由于抗血小板要求高,术中术后出血相对偏多,比如我们的处理方案是MIDCAB后即刻从胃管中注入300 mg阿司匹林和300 mg波立维进行PCI,同时在术后维持ACT在250 s以上,确实容易引起组织创面的渗血。在我们进行的4例一站式杂交手术中,有1例患者因为引流多术后二次开胸止血,最后发生了肺感染于术后1个月死亡;其次由于心外科手术创伤大,全身炎症介质动员起来,有可能增加支架再堵塞的风险[9]。在最早的Angelini等[10]杂交手术报道中,6例杂交手术病例,4例分站式杂交首先进行了微创旁路移植,然后进行了支架置入,2例一站式杂交中就有1例在术后6 h内发生了支架内血栓形成而改成了普通旁路移植手术。再次,内外科手术均对肾功能有损伤,两者叠加对肾功能不全者可能增加不良后果[10]。同时杂交手术室要求高,推广相对困难。综上除非特殊情况,我们尽量采取分站式的HCR手术方式。
关于分站式手术及先后次序问题。综合国内外经验[6,12],首先进行 MIDCAB的优势为 LIMA-LAD搭通后对PCI有保护作用,同时PCI时可以复查验证桥血管是否通畅,另外由于CABG在先,外科手术时抗血小板要求不是很高,可以减少手术出血风险,缺陷在由于是不完全血运重建,CABG术中术后有非LAD血管梗死可能,而且一旦 PCI失败,二次CABG风险提高。而先进行PCI的优势在于降低了MIDCAB的手术风险,尤其是急性心肌梗塞时,可以首先对非LAD的罪犯血管进行PCI后再进行MIDCAB手术,可以兼顾减少梗死心肌和改善远期预后的效果[13],同时如果PCI失败可以CABG补救,缺点是MIDCAB手术时停用抗血小板药物合并鱼精蛋白中和肝素增加了急性支架内血栓的风险,同时术后抗凝和抗血小板要求高,增加了术后出血风险,由于无法及时复查桥血管通畅情况,旁路移植失败无法及时发现和补救。综上所述:我们认为内科高风险和复杂病变,如重度左主干病变,LAD和回旋支开口病变,慢性闭塞性病变(CTO),HCR较PCI更安全且成功率高。年轻、凝血机制好、前降支根部病变而其他冠状动脉病变为局部病变预期PCI成功率高的可以采用一站式HCR的方式;对于急性非前降支心肌梗塞的病例可以首先进行PCI后再转入心外科行MIDCAB,一部分PCI过程中发现LAD弥漫狭窄、慢性闭塞、严重钙化或较细小而无法放置支架而转入心外科行MIDCAB的病例也属于广义的HCR范畴;其余的多数病例我们较多的选择了首先进行MIDCAB再行PCI的方式。
关于围术期抗血小板的问题。考虑到氯吡格雷有难治性大出血的风险[12],我们也采用了MIDCAB前5天停用氯吡格雷、手术日当天停用阿司匹林,旁路移植术前常规低分子肝素皮下注射的方法[14-15]。对于先行PCI和一站式杂交的患者则抗血小板强度要求高,对手术止血有更严格的要求。
目前有关HCR的指证选择资料极其有限,根据2011年公布的美国心脏病学院(ACC)和美国心脏协会(AHA)冠状动脉动脉旁路移植术指南[16],HCR推荐应用于冠状动脉病变合适的患者(Ⅱa类推荐),或用于降低高危患者手术风险(Ⅱb类推荐),因为其中远期再血管化率高于CABG。结合药物洗脱支架时代的SYNTAX研究[17-18]可以发现,冠状动脉病变的复杂程度与其获益密切相关,病变越复杂,CABG相比PCI在远期无事件生存上的优势越大,而对于简单病变的患者,PCI可以与CABG有相似的临床效果。有荟萃分析发现,早期报道的6家多支冠心病治疗的中期随访结果上,HCR比CABG组有更高的再次血运重建事件发生率(HCR vs.CABG为 8.2%vs.3.5%)[19]。美国的 Halkos等[20]发现,经过3.2年随访,接受HCR治疗的患者再次血运重建事件的发生率为12.2%,显著多于接受OPCABG治疗的患者。另一方面,POL-MIDES研究是首个比较HCR与CABG的大型前瞻性随机对照试验[21],在两组患者术前基线水平基本相同的情况下,术后1年时两组患者二次血运重建发生率差异无统计学意义。亦有单纯针对国内HCR手术病例与OPCABG病例对比的荟萃分析发现,再血管化发生率差异无统计学意义[22]。以上研究有矛盾之处,结合上文提及的SYNTAX研究结果,我们估计HCR再次血运重建事件的发生和冠状动脉病变的复杂程度相关,所以我们还是建议复杂的需要多个支架解决的冠状动脉病变还是以CABG的治疗为主。
综上所述,目前认为 HCR最理想的指征为[6,16]:①LAD近段重度病变且远端存在外科旁路移植的理想靶点;②非LAD病变均可通过PCI血运重建且病变相对简单;③不存在双联抗血小板治疗的禁忌证,此外单纯左主干远端病变、传统开胸CABG手术高风险、缺乏可用的大隐静脉、升主动脉重度钙化不适合搭静脉桥,LAD病变不适合PCI等也是其相对适应证。随着技术的发展进步,相信HCR技术会得到更加广泛的应用。

