乳鼠心脏Sca-1+干细胞定向分化的诱导研究
李呈轶,陈思宇,赵栩进,李锦卉,胡燕玲,左 琳
(山西医科大学细胞生理学教育部重点实验室,基础医学院生理学系,太原 030001;*通讯作者,E-mail:zuol1505@126.com)
心肌梗死(myocardial infarction,MI)是一类由于冠状动脉的狭窄、闭塞或痉挛引起的缺血性心肌病,其发病率和死亡率呈逐年上升趋势[1]。目前,针对心梗的传统治疗手段虽可改善心肌缺血状态,但并不能使丢失的心肌得到补充而逆转心功能的进行性下降[2,3]。已有多种干细胞被应用于心肌细胞再生领域的研究[4-7]。然而,这些干细胞的应用存在着增殖分化效率低、培养时间长、致瘤风险大、细胞易变异等问题[8]。最近的研究表明:在心脏中存在一类具有增殖分化潜能的干细胞,其具有相对良好的心肌细胞分化潜能[9-13]。其中有报道称:Sca-1+干细胞在体内外均可以被诱导分化为心肌细胞[14-17]。但心肌细胞定向诱导分化的效率低仍然是各类干细胞应用中普遍存在的问题。
抗坏血酸(ascorbic acid,AA)即维生素C(vitamin C,Vc),是一种水溶性维生素,具有抗氧化、清除自由基等生物学作用。Takahashi等[18]对具有诱导胚胎干细胞分化为心肌细胞的880种化合物进行了筛选,发现抗坏血酸可以显著提高其效率。目前,抗坏血酸体外诱导胚胎干细胞的实验已取得一定的研究进展[19-21]。Shim等[22]的研究表明,间充质干细胞在含地塞米松和抗坏血酸的心肌分化介质中可分化出表达心肌肌钙蛋白I(cardiac troponin I,cTnI)、原肌球蛋白(tropomyosin,Tm)等标志物的心肌样细胞。同时有研究报道:地塞米松(dexamethasone,DXMS)与抗坏血酸合用可增强干细胞的诱导分化效能[23,24]。Zafiriou等[25]在研究中观察到EPO诱导干细胞分化可以增加Nkx2.5、肌球蛋白重链(myosin heavy chain,MHC)、心肌肌钙蛋白T(cardiac troponin T,cTnT)等标志物的表达,并且改变EPO剂量可以提高心肌干细胞分化为心肌样细胞的效率。
综上所述,本研究以抗坏血酸、地塞米松和EPO为诱导剂,观察其对心脏Sca-1+干细胞的诱导分化作用,为其向临床的应用提供必要的理论基础。
1 材料与方法
1.1 一般材料
1.1.1 实验动物 C57BL/6J新生小鼠(出生0-3 d,雌雄不限)购自北京军事医学科学院动物中心。动物实验操作过程符合山西医科大学动物伦理学标准,并且获得伦理委员会批准。
1.1.2 仪器与试剂 Ⅱ型胶原酶(Worthington,USA),胰蛋白酶、Triton X-100和胰岛素-转铁蛋白-硒(Insulin-Transferrin-Selenium,ITS)(Sigma,USA),胎牛血清(Fetal Bovine Serum,FBS)(ScienCell,USA),DMEM/F12培养基(HyClone,USA),青链霉素、胰蛋白酶-EDTA消化液、封闭用正常山羊血清和抗荧光衰减封片剂(含DAPI)(Solarbio,China),促红细胞生成素(erythropoietin,EPO)(沈阳三生制药,China),抗Nkx2.5抗体和抗Troponin Ⅰ抗体(SantaCruz,USA),FITC标记山羊抗兔IgG和PE标记山羊抗兔IgG(中杉金桥,China),抗坏血酸和地塞米松(Selleckchem,China),DMSO(Absin,China),4%多聚甲醛(BOSTER,China),IX51荧光显微镜(Olympus,Japan),TD5A-WS台式离心机(湖南湘仪,China)。
1.2 实验方法
1.2.1 C57乳鼠心脏Sca-1+干细胞分离 取出生3 d以内的新生乳鼠,18%酒精浸泡乳鼠头部以下3 s,断头,胸骨处做T形切口,轻轻挤出心脏后剪取,放入冰浴下盛有ADS buffer的培养皿中,修剪除去多余组织和血丝,将心脏放入另一冰ADS皿,二次清洁后放入一洁净培养皿中,刀片切碎至糊状,滴加少许酶液,将心脏与酶液的混合物转移至锥形瓶。一并转移后,加入适量酶液,锡箔纸封口,37.5 ℃条件下水浴15 min后取出,静置片刻,吸取上清于终止液(DMEM/F12,10% FBS)。重复上述酶解反应5次,至所有组织消化完全。用70 μm和30 μm滤器依次过滤上述酶液与中止液的混合液。滤液收集后,1 300 r/min离心7 min,弃上清;加入冰的PBE buffer液重悬,1 300 r/min离心7 min,弃上清,滴加PBE buffer液重悬细胞团块。①阴性分选:向上述细胞悬液加入一抗20 μl,4 ℃孵育10 min,重悬细胞悬液后加入二抗40 μl,4 ℃孵育15 min。加入5 ml PBE buffer,1 300 r/min离心7 min,弃上清,加入9 ml buffer重悬细胞团块。分选前用buffer润湿柱子,9 ml buffer均分三次重悬过柱。收集滤液,1 300 r/min离心7 min,弃上清。②阳性分选:滴加PBE buffer液重悬上述细胞团块,向悬液加入一抗20 μl,4 ℃孵育10 min,加5 ml buffer,1 300 r/min离心7 min,弃上清。重悬团块后加入二抗40 μl,4 ℃孵育15 min。加5 ml buffer,1 300 r/min离心7 min,弃上清,加入9 ml buffer重悬细胞团块,均分3次重悬过柱,弃去滤液。柱子加满PBE buffer,将buffer快速推至15 ml离心管中,1 300 r/min离心7 min,弃上清,所得细胞团块即为心脏Sca-1+干细胞。
干细胞培养液重悬细胞团块,细胞计数板计数,种植于6孔板,37 ℃,5%CO2条件孵箱中培养细胞。
1.2.2 原代培养 分离后的干细胞种植后于第3天更换培养液(不用PBS清洗,只更换培养液),之后隔天换液(PBS清洗后更换培养液),分别于细胞种植后第3天,1周,2周观察细胞形态,并拍照记录,以用于和传代培养之后诱导分化的细胞形态进行对比。
1.2.3 传代培养 取1.2.1分离后的细胞培养24 h后,显微镜下观察6孔板内细胞是否贴壁(细胞从小而圆的透亮状态转为梭形,则为贴壁),若贴壁率达70%,即可传代。弃去孔内培养液,PBS清洗细胞两次。6孔板中每孔加入500 μl含EDTA的胰酶,镜下观察细胞悬浮情况(待大多数细胞悬起即可,剩余的贴壁细胞可用中止液轻轻吹打,注意酶解时间不要太长,以免损伤细胞,一般不超过2 min)。按与胰酶1 ∶1的比例加入中止液,充分混合后移入15 ml离心管,1 000 r/min离心5 min。弃上清,干细胞培养液重悬细胞,细胞计数板计数,每孔2 ml细胞悬液种植于6孔板。
1.2.4 体外诱导分化 经传代扩增的第3代或第4代细胞,以每孔2 000个细胞的密度接种于96孔板,37 ℃、5% CO2条件下培养细胞。显微镜下观察到细胞贴壁后,弃去原培养液,PBS清洗细胞两次,按分组加入相应的诱导分化液,进行诱导分化。期间利用光镜观察细胞形态改变,将各组中第1天细胞数量适中、长势最优的孔作为最优孔,在1 d,1周、2周、3周时拍照记录。实验分组如下:①空白对照组:诱导分化培养基(1%双抗,2% FBS,1% ITS,DMEM/F12);②DMSO对照组:含1%DMSO的诱导分化培养基;③Vc诱导组:分别设置含Vc浓度为10-3,10-4,10-5mol/L的诱导分化培养基三组;④DXMS诱导组:分别设置含DXMS浓度为10-7,10-8,10-9mol/L的诱导分化培养基三组;⑤EPO诱导组:分别设置含EPO浓度为0.2%,1%的诱导分化培养基两组;⑥联合诱导组:含10-4mol/L Vc及10-9mol/L DXMS的诱导分化培养基。
1.2.5 诱导分化后免疫荧光鉴定 PBS清洗上述96孔板后,用4%多聚甲醛室温下固定15 min。弃去固定剂,以1 ∶100的比例将1% Triton X稀释于封闭液后,每孔滴加60 μl,在室温下孵育1 h,弃去。在相应孔中分别滴加60 μl抗Nkx2.5抗体(稀释比例为1 ∶200)和抗Troponin Ⅰ抗体(稀释比例为1 ∶400),4 ℃湿盒过夜孵育。以1 ∶100的比例将FITC标记山羊抗兔IgG稀释于PBS,以1 ∶200的比例将PE标记山羊抗兔IgG稀释于PBS,分别滴加于相应孔中,每孔滴加50 μl,置于湿盒中,室温条件避光孵育1 h。以PBS清洗3次,每次5 min。DAPI染色后加入PBS,荧光倒置相差显微镜下观察染色结果。

2 结果
2.1 同期培养的干细胞和诱导分化的干细胞对比
在本研究中,同期进行的干细胞培养(使用干细胞培养基)和诱导分化展现出了不同的细胞形态。分离出的心脏Sca-1+干细胞在培养48 h开始贴壁,第3天时较多细胞开始贴壁生长,呈长梭形;细胞培养1周可形成细胞连接,以长梭形细胞为主,细胞形态较一致;第2周,细胞数量明显增加,聚集成团块(见图1)。

A.培养3 d B.培养1周 C.培养2周图1 Sca-1+干细胞离体培养光镜下形态Figure 1 The phenotype of Sca-1+stem cells after culture in vitro for different time under light microscopy
2.2 Sca-1+干细胞体外诱导分化细胞形态观察
经光镜观察发现:10-3mol/L Vc诱导组干细胞大量死亡,提示:该浓度Vc对细胞可能产生较大毒性;10-4mol/L Vc组细胞长势良好,10-5mol/L Vc组细胞生长状态稍差。10-7,10-8,10-9mol/L DXMS三组均生长状态良好,其中以10-9mol/L DXMS诱导组最好。此外,联合诱导组细胞长势良好,0.2%、1% EPO组稍差。以上结果提示使用分化诱导剂可一定程度上促进细胞生长。DMSO组长势一般,与空白对照组基本相同,由于未出现大面积细胞死亡,证明该浓度DMSO对细胞未产生毒性,即不同浓度Vc、DXMS诱导分化组不受所含1% DMSO的干扰。
选取细胞长势良好的不同诱导分化组别,挑选其中最优一孔持续观察,镜下见,第1天:10-4mol/L Vc组细胞形态以多角形为主,分散生长,有部分圆形细胞相间生长(见图2A);10-9mol/L DXMS组细胞形态以长条形、多角形为主,分散生长(见图3A);联合诱导组,细胞形态以圆形为主,细胞直径较小(见图4A);0.2% EPO组细胞形态以多角形为主,分散生长,细胞间无连接(见图5A)。第1周:10-4mol/L Vc组细胞均匀分布,多角形细胞和梭形细胞相间生长,形态可辨清,细胞间连接良好(见图2B);10-9mol/L DXMS组多角形细胞为主,少量长条形细胞夹杂其中,形态可辨清,连接良好(见图3B);联合诱导组细胞多呈多角形生长,均匀分布,折光性良好,连接良好,形态可辨清(见图4B);0.2% EPO组细胞片状分布,形状不规则,连接明显(见图5B)。第2周:10-4mol/L Vc组细胞呈棒状、多角形生长,细胞排列不规则,无趋向性(见图2C);10-9mol/L DXMS组细胞呈圆片状、长条形、多角形生长,同形态细胞有相对聚集生长的趋向(见图3C);联合诱导组细胞有长条形、梭形等形态,重叠生长,细胞间不留间隙(见图4C);0.2% EPO组细胞呈条棒状生长,均匀分布,连接紧密,几乎不留间隙(见图5C)。第3周:10-4mol/L Vc组细胞有呈环绕性生长趋向,细胞形态多呈不规则长条形(见图2D);10-9mol/L DXMS组细胞呈圆片、多角形、梭形生长,胞体明显增大(见图3D);联合诱导组边缘视野细胞聚集明显,重叠生长,已不能辨清细胞形态,中间视野细胞生长相对稀疏,多角形细胞为主,细胞连接明显(见图4D);0.2% EPO组细胞胞体明显增大,以圆片、多角形为主,重叠生长(见图5D)。

A-D.分别为诱导分化培养1 d,1周,2周,3周时的光镜下形态图2 Vc(10-4mol/L)诱导组的Sca-1+干细胞生长状态Figure 2 Growth status of Sca-1+stem cells in Vc(10-4 mol/L) group under light microscopy

A-D.分别为诱导分化培养1 d,1周,2周,3周时的光镜下形态图3 DXMS(10-9mol/L)诱导组的Sca-1+干细胞生长状态Figure 3 Growth status of Sca-1+stem cells in DXMS(10-9mol/L) group under light microscopy

A-D.分别为含10-4mol/L Vc及10-9mol/L DXMS的诱导分化培养1 d,1周,2周,3周时的光镜下形态图4 联合诱导下的Sca-1+干细胞生长状态Figure 4 Growth status of Sca-1+stem cells under combined induction under light microscopy
2.3 免疫荧光染色
诱导3周后,各组进行免疫荧光染色,检测心肌细胞特异性标记物cTnI、Nkx2.5的表达。各组中均可见红色荧光标记的cTnI及绿色荧光标记的Nkx2.5,细胞核由DAPI标记为蓝色荧光(见图6)。
与空白对照组相比,联合诱导组cTnI表达水平明显上调(P<0.05)。其余各组与空白对照组比较差异均无统计学意义(P>0.05,见图7、表1)。
Nkx2.5在各诱导组的阳性率均极低,以联合诱导组为例,仅为(0.05±0.02)%,其余各组更甚,未出现高表达情况。

a-f.cTnI染色结果(cTnI红色,DAPI蓝色);g.联合诱导组Nkx2.5染色结果(Nkx2.5绿色,DAPI蓝色)图6 不同诱导剂对干细胞向心肌细胞分化的诱导效果Figure 6 Induction effects of different inducers on differentiation of stem cells into cardiac myocytes

与空白对照组比较,*P<0.05图7 不同诱导剂作用下干细胞分化为心肌细胞的阳性率Figure 7 Positive rate of cTnI in differentiated cardiac myocytes after treated with different inducers
表1 不同诱导剂下实验组阳性率(cTnI)比较
Table 1 Comparison of positive rate of cTnI in differentiated cardiac myocytes after treated with different inducers
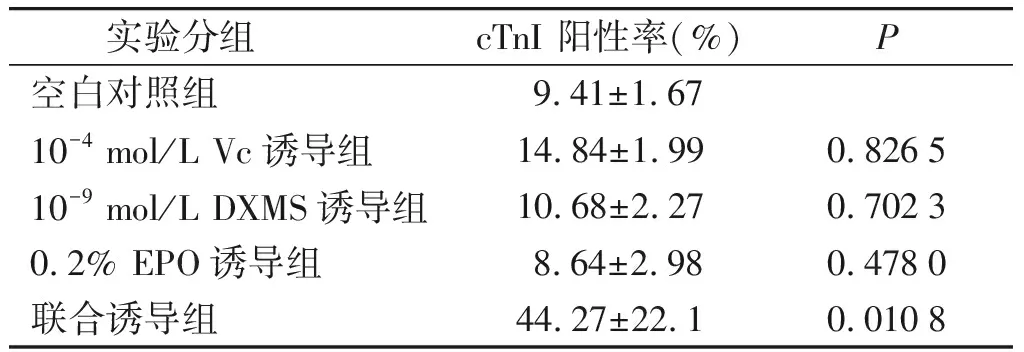
实验分组cTnI 阳性率(%)P空白对照组 9.41±1.6710-4 mol/L Vc诱导组14.84±1.990.826510-9 mol/L DXMS诱导组10.68±2.270.70230.2% EPO诱导组 8.64±2.980.4780联合诱导组44.27±22.10.0108
P值为与空白对照组比较
3 讨论
干细胞移植治疗心梗为患者带来了曙光,但不可否认的是,目前这一手段还存在诸多问题,特别是心肌细胞的定向诱导。虽然抗坏血酸诱导干细胞向心肌细胞分化的报道并不少见,但在本研究中对于C57乳鼠心脏Sca-1+干细胞以抗坏血酸为核心的诱导剂的体外诱导分化,并没有实现心肌细胞的高效诱导。这表明,在各类干细胞尤其是心脏原位干细胞向心肌细胞方向的诱导分化领域尚缺乏稳定高效的方法,这与Yeghiazarians等[26]的观点是一致的。造成这种结果可能的原因是多元的,包括:干细胞分化成熟过程具有复杂性,仅依靠某一诱导因子或多个因子的简单联合,很难实现高效地向心肌细胞这类具有复杂结构和特殊生理功能的细胞的成熟分化;不同类型的干细胞本身具有不同的分化特性,如向其特定的方向分化等等。
倒置显微镜下观察诱导分化与干细胞培养的主要区别在于,干细胞培养全程细胞形态均较一致,多呈长梭形,而诱导分化过程中细胞可见梭形、多角形、近圆形等多种形态,且细胞生长速度加快。虽然无法以此说明细胞发生分化,但至少提示我们在更换诱导分化培养基及加入诱导剂之后,细胞的生长状态发生了变化。从免疫荧光的结果来看,各诱导组均有cTnI表达,但阳性率低且少见强阳性细胞,各组Nkx2.5的表达量均极低。除联合诱导组外其余各组与空白对照组相比均无显著差异,联合诱导组cTnI阳性率与空白对照组相比具有显著差异,其阳性率为(44.27±22.91)%,但是其重复性低,表现为数据标准差较大。因此,本次实验所采用的诱导方案并不是Sca-1+干细胞体外心肌细胞方向诱导分化的适宜方案。
结合本实验研究结果及进一步查阅的资料,下一步工作方向有二:第一,循原诱导方案,探究诱导分化过程中出现的多形性细胞其身份,如是否为成纤维细胞、血管内皮细胞或其他细胞;第二,更换诱导剂及诱导方案,继续探究可以实现Sca-1+干细胞体外高效诱导心肌细胞方向分化的方法。可值得借鉴的是,五氮胞苷同样是一个被广泛报道的具有诱导干细胞向心肌细胞方向分化能力的化学物质[27-29]。同时,缺氧预适应等方法有助于提升诱导效果也有报道[30]。这些诱导方案都是接下来需要探讨的内容。
干细胞移植在心梗治疗中具有很好的前景,要真正实现对心肌梗死组织结构和功能的再生性修复,最重要的还是要找到适宜的体外培养体系和高效的诱导条件,这也是未来工作中需要深入研究的问题。

