颈动脉硬化斑块内新生血管的超声造影评价及其与脑梗死患者病情严重程度及预后的关系
王 洁,于 蕾,郭淮莲
卒中是中老年人致残和死亡的重要原因之一,急性缺血性脑卒中(急性脑梗死)是最常见的卒中类型,占我国脑卒中的69.6%~70.8%[1]。越来越多的证据表明,易损斑块引起的急性脑梗死显著高于稳定斑块[2,3]。高密度的斑块内新生血管(Intraplaque neovascularization,IPN)是易损斑块的重要特征。IPN缺乏基底膜,血液容易渗漏促进斑块内炎症反应,导致斑块破裂。颈动脉超声造影(Contrast-enhanced ultrasound,CEUS)通过观察斑块内的微气泡可以清楚地识别IPN,因此常用于评估斑块的稳定性[4,5]。美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)和改良Rankin量表(modified Rankin Scale,mRS)常用于评价急性脑梗死患者病情严重程度和预后。本文旨在利用CEUS评价急性脑梗死患者颈动脉斑块内血管新生情况,并探讨其与患者病情严重程度(NIHSS评分)及预后(发病后90 d mRS评分)的相关性。
1 材料和方法
1.1 研究对象 选取北京大学人民医院神经内科2017年5月-2018年10月收治的急性缺血性脑梗死患者共108例,其中男87例,女21例,年龄22~86岁,平均(61.98±12.94)岁。入选标准:(1)入组患者符合急性缺血性脑卒中诊断标准[6];(2)年龄>18岁,病程<14 d;(3)未行溶栓治疗。排除标准:(1)脑出血、心源性脑梗死或低灌注性脑梗死;(2)既往脑卒中遗留明显后遗症;(3)合并严重心肺功能疾病、恶性肿瘤或其他严重躯体疾病;(4)孕妇及哺乳期妇女、18岁以下未成年人;(5)患者不能配合检查或不同意检查。
1.2 方法
1.2.1 颈动脉彩超 采用东芝Aplio 500超声诊断仪,探头频率4~9 MHz。患者取仰卧位,检查双侧颈总动脉和颈内动脉,测定颈动脉内中膜厚度(IMT),局限性IMT≥1.50 mm定义为斑块,记录被检者有无斑块。
1.2.2 颈动脉超声造影 对存在颈动脉粥样硬化斑块的患者行颈动脉CEUS,检查前签署超声造影知情同意书。抽取5 ml的生理盐水与声诺维(SonoVue)干粉剂混合,轻轻震荡溶解,制成微气泡混悬液备用。选取肘前静脉建立静脉通道,快速推注造影剂后用5 ml的生理盐水冲洗。选择低机械指数的超声脉冲序列,检查过程中保持探头稳定,观察2 min并存储动态图像。两侧颈动脉均检查,每侧颈动脉选择1个斑块进行评估,如有多发斑块则选取最大的低回声斑块。由有多年超声造影经验的医师在不了解病史的情况下根据CEUS检查结果将斑块进行分级[5]:0 级,斑块内无增强;Ⅰ级,斑块内稀疏点状增强;Ⅱ级,斑块内线状增强及多个点状增强;Ⅲ级,斑块内片状增强或密集的点线状增强。
1.2.3 研究对象分组 根据有无颈动脉粥样硬化斑块将108例患者分为无斑块组和斑块组,斑块组患者行颈动脉超声造影,斑块分级为0级或Ⅰ级的患者为稳定斑块组;Ⅱ级或Ⅲ级的患者为易损斑块组。
1.2.4 NIHSS评分及发病后90 d mRS评分 急性缺血性脑卒中患者入院后由经过专门培训的神经科医师采用NIHSS评分评估其病情严重程度。发病后90 d对入组患者进行随访,采用mRS评分评价患者的预后。NIHSS评分和mRS评分在卒中试验中已被证实具有可靠性和有效性[7,8]。
2 结 果
2.1 各组一般临床资料比较 无斑块组、稳定斑块组和易损斑块组间年龄存在显著差异(P<0.05);3组间性别、身高、体重、吸烟史、饮酒史、高血压病史、糖尿病史、他汀用药史、脑血管意外史、颅内动脉狭窄史均无统计学差异(P>0.05);3组间总胆固醇(TC)、血甘油三酯(TG)、血低密度脂蛋白胆固醇(LDL)、血高密度脂蛋白胆固醇(HDL)、血尿酸(UA)、空腹血糖(FPG)、糖化血红蛋白(HbA1C)、血清C-反应蛋白(CRP)、血清同型半胱氨酸(HCY)水平均无统计学差异(P>0.05)(见表1)。
2.2 斑块组患者两侧颈动脉斑块的造影分级比较 108例患者中,有78例患者存在颈动脉粥样硬化斑块,这些患者两侧颈动脉均检出斑块。将脑梗死病灶侧的颈动脉称为病灶侧颈动脉;病灶对侧的颈动脉称为对侧颈动脉。每位患者均行两侧颈动脉CEUS检查,对每侧的斑块进行分级。病灶侧和对侧的斑块分级无统计学差异(均P>0.05)(见表2)。
2.3 3组NIHSS评分及发病后90 d mRS评分比较 各组间年龄存在统计学差异,采用协方差分析对年龄因素进行校正,结果显示各组研究对象的NIHSS评分及mRS评分具有统计学差异(均P<0.05)(见表3)。

表1 各组一般临床资料比较
差异具有统计学意义*P<0.05
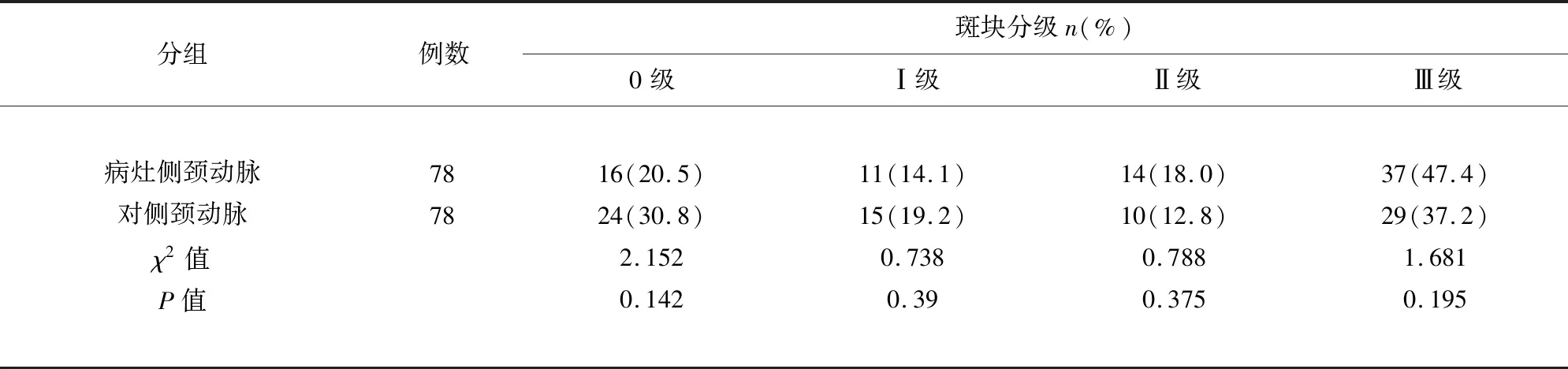
表2 斑块组患者两侧颈动脉斑块分级比较

表3 各组NIHSS评分及mRS评分比较
#表示采用协方差分析对年龄因素进行校正
2.4 3组NIHSS评分及发病后90 d mRS评分组间两两比较 易损斑块组患者的NIHSS评分比无斑块组高2.059(95%CI0.98~3.14),比稳定斑块组高2.359(95%CI0.92~3.80),差异均有统计学意义(均P<0.05);无斑块组患者NIHSS评分与稳定斑块组比较差异无统计学意义(P>0.05)(见图1A)。易损斑块组患者发病后90 d mRS评分比无斑块组高0.669(95%CI0.28~1.06),比稳定斑块组高0.897(95%CI0.38~1.42),差异均有统计学意义(均P<0.05);无斑块组患者发病后90 d mRS评分与稳定斑块组比较差异无统计学意义(P>0.05)(见图1B)。
2.5 NIHSS评分、发病后90 d mRS评分与斑块分级的相关性 急性脑梗死患者颈动脉粥样硬化斑块内的新生血管分级与NIHSS评分、发病后90 d mRS评分均呈正相关(r=0.441、0.404,均P<0.01)。
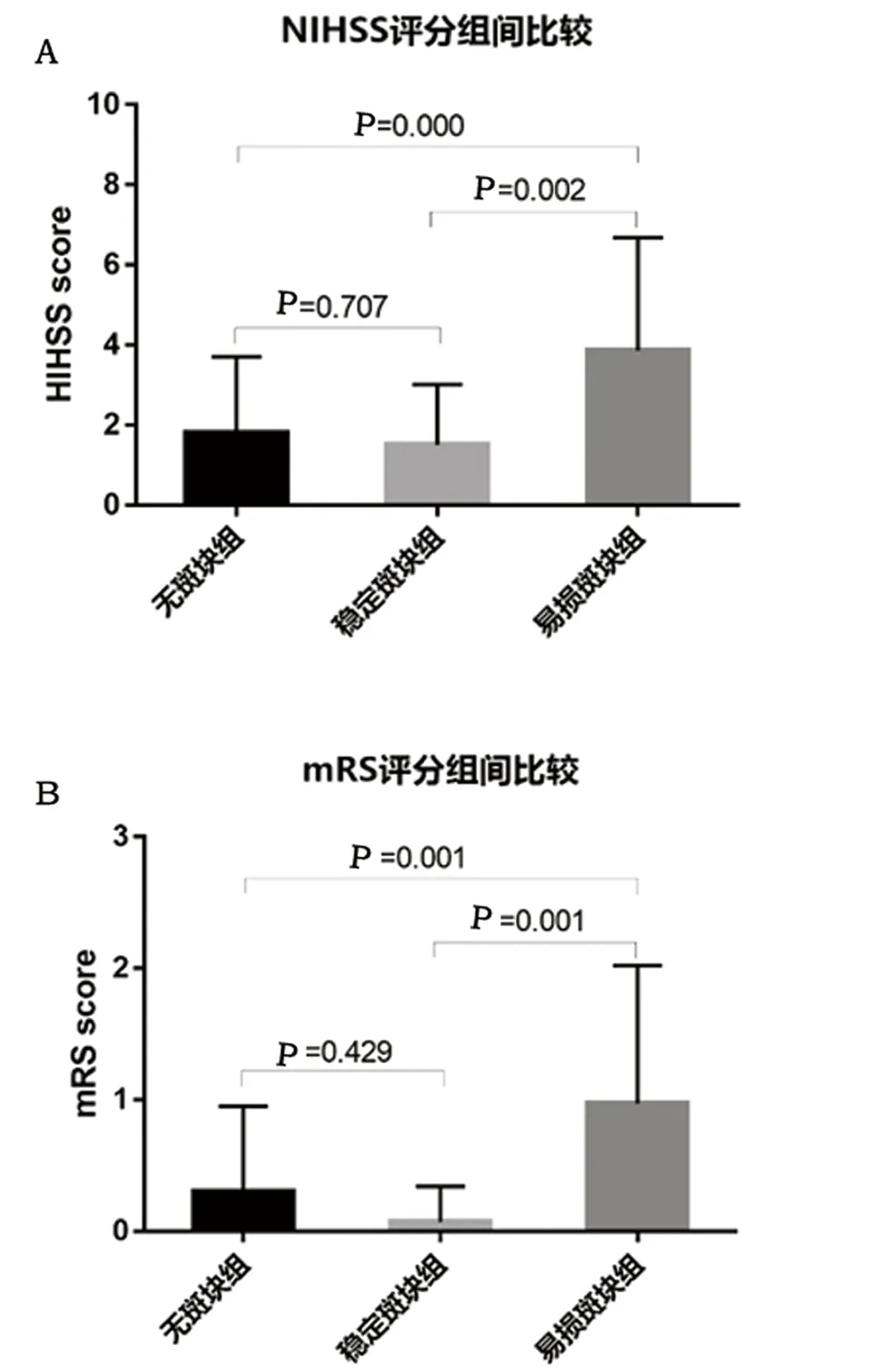
A.NIHSS评分组间比较;B.发病后90 d mRS评分组间比较
图1 3组患者NIHSS评分及发病后90 d mRS评分组间比较
3 讨 论
颈动脉粥样硬化性狭窄是缺血性脑卒中公认的危险因素,可导致高达10%~20%的卒中或短暂性脑缺血发作[9]。除了颈动脉狭窄,动脉粥样硬化斑块的稳定性也是缺血性脑卒中的独立危险因素。由于斑块内炎症、缺血等改变,血管内皮细胞迁移至斑块内部形成新生血管,新生血管易于破裂,导致斑块内出血。组织病理学证明,新生血管形成、斑块内出血等是易损斑块的主要特点[10,11]。易损斑块破溃形成局部血栓,栓子脱落堵塞远端血管是脑梗死主要的发病机制。
CEUS具有经济有效、安全等优点,目前常用于评估动脉粥样硬化。它不仅可以准确地测量动脉的狭窄程度[4],还用于观察斑块的厚度、形状、IPN以及有无破溃[5,12]。目前使用半定量的分级量表评估IPN[13],该方法评价斑块内新生血管程度与组织病理学检查所示的新生血管密度呈正相关[14]。
Fleiner等人研究颈动脉粥样硬化患者,发现动脉壁新生血管均匀地出现在颈动脉、髂动脉、肾动脉和冠状动脉中,证明动脉粥样硬化是一种全身性的血管疾病[15]。本研究中斑块组患者病灶侧和对侧颈动脉斑块造影分级无显著差异(P>0.05),说明急性脑梗死患者颈动脉斑块的新生血管程度与是否位于梗死病灶侧无关。CEUS通过检查颈动脉斑块,可以对动脉粥样硬化患者的全身血管病变情况进行评估,这样有助于预测患者发生急性心脑血管事件的风险。
研究表明,既往发生过心脑血管事件的患者颈动脉斑块内的血管新生程度显著高于无症状患者[15,16]。但对脑梗死患者来说,病情严重程度及预后是否与颈动脉斑块内血管新生程度有关,目前尚无人报导。本研究中,易损斑块组患者NIHSS评分、发病后90 d mRS评分均显著高于无斑块组和稳定斑块组;而无斑块组患者NIHSS评分、发病后90 d mRS评分与稳定斑块组无明显差异。说明动脉粥样硬化患者中有一部分人的斑块处于稳定状态,其病情严重程度及预后与无斑块患者相似,他们的临床症状要比易损斑块患者更轻,预后也会更好。
Spearman相关性分析表明,急性脑梗死患者颈动脉斑块内的新生血管分级与NIHSS评分、发病后90 d mRS评分均呈正相关(P=0.441、0.404,P<0.05),说明急性脑梗死患者颈动脉IPN分级越高,斑块越不稳定,其病情可能更重、预后更差。因此,利用颈动脉CEUS检查,有助于对急性脑梗死患者进行危险分层,区分稳定斑块和易损斑块,对易损斑块的患者可以采取更为积极的治疗措施,从而改善预后。
斑块分级越高的脑梗死患者病情越重、预后越差,其发病机制目前尚不明确。宋则周等人[17]利用CEUS评估颈动脉斑块的增强程度,发现斑块分级越高,脑梗死病灶体积越大。因此,猜测斑块分级与脑梗死病灶的体积有关,斑块分级越高,梗死灶越大,患者的病情可能愈重。对其发病机制的进一步阐明尚需更多的研究来探索。
综上所述,造影分级Ⅱ、Ⅲ级的斑块为易损斑块,破溃的风险显著升高,发生急性脑梗死的可能性也越大,导致的临床症状也可能越重。通过超声造影评估患者动脉粥样硬化斑块内的血管新生程度,一定程度上可以反映患者全身的血管状况,预测发病风险和病情严重程度。因此对于脑梗死高危人群,筛查易损斑块,采取积极的预防措施,以及在梗死后采取更积极的治疗措施是十分重要的。

