3D打印材料与脱细胞气管基质的生物相容性研究
李剑锋,仲毅,潘子寅,王志豪,潘枢,史宏灿
(1.扬州大学临床医学院 胸外科,江苏 扬州 225001;2.扬州大学转化医学中心,江苏 扬州 225001)
先天性气管软化塌陷狭窄或闭锁,后天因外伤、肿瘤、大面积烧伤等原因引起的气管损伤均会引起严重的呼吸困难甚至窒息。切除病变气管并行端-端侧吻合被普遍认为是最有效的治疗手段[1-2]。然而当切除的病变气管长度超过成人的1/2或婴幼儿的1/3 时,由于张力等原因无法行端-端侧吻合,而需行气管替代治疗[3]。人类主气管是由15~20 个C 形软骨环通过平滑肌、血管等结缔组织构成,在内表面被覆有纤毛上皮[4]。气管软骨维持着气管的管腔形态,防止气管塌陷;而气管内表面呼吸上皮中的纤毛对气管的清洁有着重要作用;气管软骨周围的结缔组织则保证了气管的曲伸以及收缩、扩张等机械运动[5]。目前临床上还无法完全重建如此复杂的多层结构,以及完全恢复其功能。然而,随着气管重建研究的深入,组织工程气管的出现为气管重建带来了曙光[6]。
组织工程将种子细胞、支架材料和细胞因子有效结合,从而修复相关组织缺损,进行器官重建[7]。目前构建组织工程气管基质材料主要有两个来源:天然材料、合成材料[8]。而随着研究的深入,目前天然材料主要来源多为同种异体气管,本研究通过去污剂-联合酶法(detergent-enzymatic method,DEM)获取长段无免疫原性脱细胞兔组织工程气管,动物实验证实不影响血管生成性能,也不诱发体内炎性反应。 聚己内酯(polycaprolactone,PCL)是一种生物可吸收性聚合物,因其分子链上的酯基使其具备良好的生物相容性,能够在体内以合适的速度自然降解并代谢出体外[9]。PCL 熔点低(60℃)、热塑性良好,因而易加工成型,加之其良好的生物力学性能,获得美国食品药品管理局(Food and Drug Administration,FDA)的批准,广泛应用于生物医学以及组织工程[10-11]。本研究通过实验筛选出200 μm 孔径PCL 支架最利于细胞黏附增殖,并利用水解、胺化、纳米材料修饰的方法,提高3D 打印聚己内脂(PCL)气管支架的表面亲细胞性,增强对细胞的黏附性能。本研究旨在通过对比两种组织工程气管基质材料力学性能及生物相容性差别,为构建更为有效的合理的组织工程气管提供依据。
1 材料与方法
1.1 实验动物及主要试剂、仪器
2 个月龄健康新西兰兔3 只,雌雄不限,体重200~300 g;6 个月龄成年健康新西兰兔25 只,雌雄不限,体重2.0~2.5 kg;均由扬州大学实验动物中心提供。动物实验获扬州大学医学院伦理委员会批准。
脱氧胆酸钠、DNA-I 酶、戊巴比妥(Sigma 公司,美国);盐酸赛拉嗪注射液(吉林省华牧动物保健品有限公司);细胞计数(cell counting kit-8,CCK-8)试剂盒(Biosharp 公司,韩国);苏木精-伊红(hematoxylin-eosin, HE)染液(南京凯基生物科技发展有限公司);低分子肝素钠(深圳天道医药有限公司);杜尔贝科改良伊格尔培养基(Dulbecco's modified eagle medium, DMEM)、0.25%胰蛋白酶(HyClone 公司,美国);F12(Clark 公司,美国);Giemsa 染料(北京索莱宝科技有限公司);青霉素、链霉素、两性霉素B(上海生工生物工程有限公司);即用型免疫组化试剂盒、二氨基联苯胺(diaminobenzidine, DAB) 显色试剂盒(福州迈新生物技术开发有限公司);抗兔分化抗原68(cluster of differentiation 68,CD68)单克隆抗体(上海艾博抗贸易有限公司)。
正置显微镜(Olympus 公司,日本);万能力学测试机3367(Insteon 公司,美国);LeicaCM-1990 冷冻切片机(Leica 公司,德国);正置免疫荧光显微镜、TS100 倒置显微镜(Nikon 公司,日本);酶标仪(BioTAK 公司,美国);S-4800 场发射扫描电镜(Hitachi 公司,日本);CO2培养箱、台式离心机(Hereaus 公司,德国);恒温震荡培养箱(太仓市实验设备厂);压力蒸汽灭菌(嘉兴中新医疗器械公司)。
1.2 BMSCs分离、培养及传代
2 个月龄新西兰兔,按盐酸赛拉嗪0.2 ml/kg肌肉注射,麻醉成功后用18 号骨髓穿刺针于胫骨平台处进行穿刺,用经肝素冲过的注射器抽取骨髓约2 ml。按本研究既往的实验方法[12],即全骨髓贴壁筛选法进行BMSCs 的分离、培养及传代。取生长状态良好的第4 代BMSCs 用于后续实验。
1.3 气管支架制备及相关检测
取10 只6 个月龄成年新西兰兔,空气栓塞法处死,在外科标准无菌操作下获取气管。随机分为两组,每组5 只。A1组仅剥离气管外表面疏松结缔组织。B1组在剥离气管外表面疏松结缔组织基础上,参照本研究既往DEM 法[13]对气管进行脱细胞处理,简述如下:①置于4℃蒸馏水渗透溶解48 h;②在4% 脱氧胆酸钠蒸馏水溶液浸泡37℃孵育4 h;③将气管在室温下置2 000 KU/L Dnase-I 的生理盐水中浸泡3 h;④将②③步骤重复7 次,最后将气管置于1% 抗生素、抗真菌的PBS 缓冲液中4℃保存备用。
选用聚己内酯(PCL)为材料,采用打印喷头在旋转轴上打印的方式,设置打印温度为90℃,打印喷头沿旋转轴来回移动,打印速度为5 mm/s,先在旋转轴上打印出底层气管支架;然后旋转轴与打印底层时旋转方向相反,打印成形第二层气管支架,继而与上一层形成多孔结构。以此重复打印6 层。气管支架的孔径可通过旋转轴的转速和打印头的行走速度调节,以此制备孔径为200 μm的PCL 气管支架。将支架置于浓度为10%的纳米二氧化硅溶液中浸泡过夜,第二天取出后室温放置,5 d 缩合反应完全,得PCL 纳米二氧化硅修饰材料。使用游标卡尺对3组气管支架进行长度、直径、厚度等形态学数据进行测量。万能力学仪行压缩实验:给予固定样本0.1 N 为位移原点,室温下以10 mm/min 的速率,控制行程为50%管腔直径开始压缩实验[14],记录样本最大应力(N)。
1.4 细胞-气管支架复合物的制备及相关观测
1.4.1 细胞-气管支架复合物制备及细胞活性观察将A1组、B1组及C1组支架在无菌环境中修剪成0.5 cm×0.5 cm 大小的片状组织,然后贴于96 孔板底中央,气管外壁朝上;吸走周围PBS 液,置于超净台中干燥2 h,向组织片中滴加含10%FBS的DMEM/F12 培养基直至覆盖组织片,滴加过程避免组织片漂浮。将96 孔培养板移至细胞培养箱,37℃、5%二氧化碳(CO2)、饱和湿度下孵育24 h 后,吸去培养基。取生长状态良好的第4 代BMSCs,达80% 融合时消化计数,然后将含有2.5×104个细胞的细胞悬液接种至两组气管组织片的外壁上,置于37℃、5%CO2、饱和湿度培养箱培养。48 h 后取出行Giemsa 染色,倒置显微镜下观察,根据细胞生长形态及状况判断材料毒性。
1.4.2 扫描电镜观察 3组细胞-气管支架复合物组织片培养24 h 后取出,2.5% 戊二醛溶液固定24 h;PBS 漂洗,梯度乙醇脱水,加入乙酸乙酯∶乙醇(1∶1)及纯戊酯各30 min,干燥后喷金,扫描电镜观察支架外表面的细胞状态。
1.4.3 CCK-8 检测 在避光条件下,以1∶10 的体积浓度配制CCK-8:培养基溶液。吸净24 孔板内待测孔中的培养基,加入500 μl CCK-8 检测液覆盖支架表面,置培养箱中反应2 h;取200 μl 上清加入96 孔板中,用酶标仪测定450 nm 波长处的吸光值,减去空白对照的吸光值后得到间接反映活细胞数量的光学密度450(optical densitity 450,OD450)值。
1.5 同种异体动物体内实验
1.5.1 气管支架手术埋植 取6 个月龄成年新西兰兔15 只,随机分为3组,每组5 只。动物实验获扬州大学医学伦理委员会批准。以盐酸赛拉嗪注射液0.2 ml/kg 肌肉注射麻醉,颈背部备皮切开,游离皮下浅筋膜,分离脊柱一侧,形成皮囊。每只兔子分别植入3组气管支架一枚,随后常规缝合。术后第一周每天予以青霉素5 万u/kg 一天一次肌肉注射,在术后30 d 将实验动物处死,获取埋植物,拍照后将样本在室温下于pH7.4 的10%中性福尔马林溶液固定24 h,蒸馏水冲洗,梯度酒精脱水,石蜡包埋,并制成4 μm 切片备用。
1.5.2 血液免疫球蛋白动态分析 术后3、7、11、15、19、23、27 d,于耳缘静脉处采血留取标本,采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法评估受体血清免疫球蛋白IgM 和IgG 含量的动态变化。
1.5.3 HE 染色观察 将制备好的切片依次行脱蜡、水化、染色、梯度脱水、透明、中性树脂封片、干燥后正置光学显微镜下观察并拍照。
1.5.4 免疫组化检查 将制备好的切片依次行脱蜡及水化、抗原修复(酶修复法)、滴加过氧化酶阻断溶剂(A),室温下孵育10 min 后滴加非免疫动物血清(B),室温下孵育10 min 后滴加用PBS稀释的一抗(CD68 1∶200 稀释),4℃孵育过夜;滴加生物素标记的二抗(C),室温下孵育10 min后滴加链霉素抗生物素-过氧化物酶溶液(D),室温下孵育10 min 后滴加新鲜配制的DAB 液显色;苏木素复染、盐酸酒精分化、中性树脂封片,干燥后显微镜下观察并拍照。
1.6 统计学方法
采用SPSS 19.0 统计软件进行分析。计量资料以均数±标准差(±s)表示,计量资料组间比较采用t检验;多组间比较采用单因素方差分析;P<0.05 为差异有统计学意义。
2 结果
2.1 气管支架形态学观测及生物力学性能检测
兔原生气管(Native)、 脱细胞气管(Decellularized)、3D 打印气管(材料为PCL)宏观对比见图1,各组测量的长度、管腔直径、及管壁厚度见表1,3组气管支架形态学相比差异无统计学意义(P>0.05)。
表1 3组气管支架形态学测量(±s,mm)
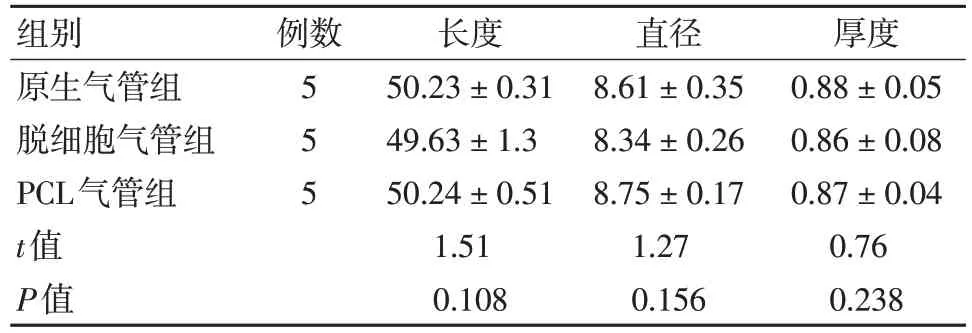
表1 3组气管支架形态学测量(±s,mm)
组别原生气管组脱细胞气管组PCL气管组t值P值例数5 5 5长度50.23±0.31 49.63±1.3 50.24±0.51 1.51 0.108直径8.61±0.35 8.34±0.26 8.75±0.17 1.27 0.156厚度0.88±0.05 0.86±0.08 0.87±0.04 0.76 0.238

图1 3组气管宏观对比图
压缩实验结果见表2,结果提示C1组力学性能优于B1组,具有更好的侧向抗压维持管腔形状能力。
表2 3组气管支架生物力学性能对比(±s)
注:1)与原生气管组比较,P <0.05;2)与脱细胞气管组比较,P <0.05。
组别原生气管组脱细胞气管组PCL气管组F值P值例数5 5 5管腔形变50%时最大应力/N 2.261±0.165 1.414±0.2841)5.004±0.0011)2)298.82 0.000弹性模量/mPa 0.598±0.129 0.334±0.0581)1.744±0.1641)2)132.29 0.000
2.2 细胞-气管支架复合物相关观测
2.2.1 细胞活性观察 培养48 h 后Giemsa 染色示,3组材料周围的细胞均贴壁生长良好,A1与B1两组材料周围的细胞在形态无明显差别,B1组材料周围局部密度较其他两组更高,PCL 组可见少量悬浮细胞,见图2。
2.2.2 扫描电镜观察 培养24 h 后经SEM 观察到细胞在3组支架材料外壁上贴附良好,A1、B1组外侧的网状纤维上可见细胞呈扁平的圆形、椭圆形分布,BMSCs 在C1组材料外壁上呈簇状生长,局部为串珠样分布,如图3。
2.2.3 CCK-8 检测 CCK-8 试剂中含有WST-8:化学名:2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐,它在电子载体1-甲氧基-5-甲基吩嗪-硫酸二甲酯(1-Methoxy PMS)的作用下被细胞线粒体中的脱氢酶还原为具有高度水溶性的黄色甲臜产物(formazan)。生成的甲臜物的数量与活细胞的数量成正比。用酶联免疫检测仪在450 nm 波长处测定其光吸收值,可间接反映活细胞数量。统计分析各组不同时段的OD 值,见表3。B1组的细胞增殖数量要高于其他两组,差异有统计学意义(P<0.05)。

图2 3组细胞-气管支架复合物培养48 h 后Giemsa 染色观察(倒置显微镜×40)
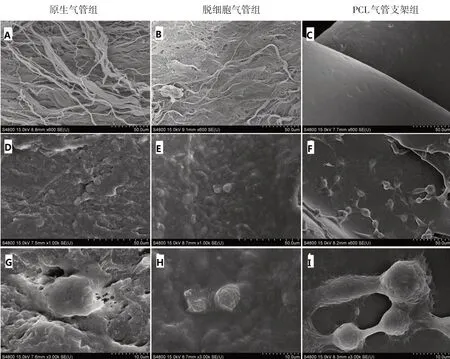
图3 种细胞前后3组细胞-气管支架材料扫描电镜观察
2.3 同种异体动物体内实验
2.3.1 大体观察 所有实验动物术后30 d 内表现健康,体重有所增加;伤口均愈合良好。30 d 时B2组气管支架周围包绕炎性结缔组织,并与受植床粘连,不易剥离;囊状的新鲜气管内有大量脓液积聚,破坏了正常气管的解剖结构;C2组被炎性肉芽组织包裹,易剥离。见图4。
2.3.2 血液免疫球蛋白动态分析 术后3组IgM及IgG 表达均逐渐增加,分别于1 d 和15 d 达峰值,后逐渐下降,符合体液免疫应答抗体产生的规律。术后各时间点C2组IgM 和IgG 含量均显著高于B2组,差异有统计学意义(P<0.05)。见图5。
2.3.3 HE 染色观察 术后30 d A2组炎性细胞浸润较多,以单核细胞、淋巴细胞浸润为主,腺体结构缺失,软骨组织不同程度被破坏;C2组以嗜酸性粒细胞浸润为主,呈异物肉芽肿性炎症反应,结构保持良好,而B2组较其他两组炎症细胞浸润最少,软骨细胞形态无异常,未见钙化、排斥等不良反应。见图6。
表3 3组材料上种植干细胞不同时间点CCK-8 检测(±s,×104个/ml)

表3 3组材料上种植干细胞不同时间点CCK-8 检测(±s,×104个/ml)
注:1)与原生气管比较,P <0.05;2)与脱细胞气管比较,P <0.05。
组别A1(原生气管)B1(脱细胞气管)C1(3D打印气管)F值P值例数5 5 5 1 d 0.080±0.002 0.104±0.0111)0.091±0.0052)11.04 0.017 3 d 0.134±0.006 0.216±0.0211)0.131±0.0202)24.32 0.001 5 d 0.421±0.014 0.495±0.0111)0.444±0.0112)28.84 0.001 7 d 0.417±0.015 0.455±0.028 0.438±0.012 2.9 0.132
2.3.4 免疫组化 术后30 d A2组基质断裂,软骨凹陷内细胞核消失,可见黏膜及黏膜下层内有大量CD68 表达阳性巨噬细胞,细胞膜呈棕色;C2组结构保持完整,管腔内侧同样可见CD68 表达阳性巨噬细胞浸润;B2组巨噬细胞浸润明显少于上述两组。见图7。
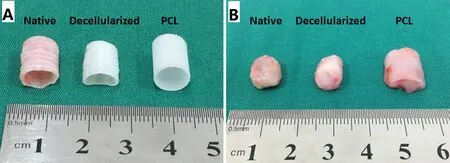
图4 埋植前后对比图(30 d)

图5 术后免疫球蛋白动态监测结果
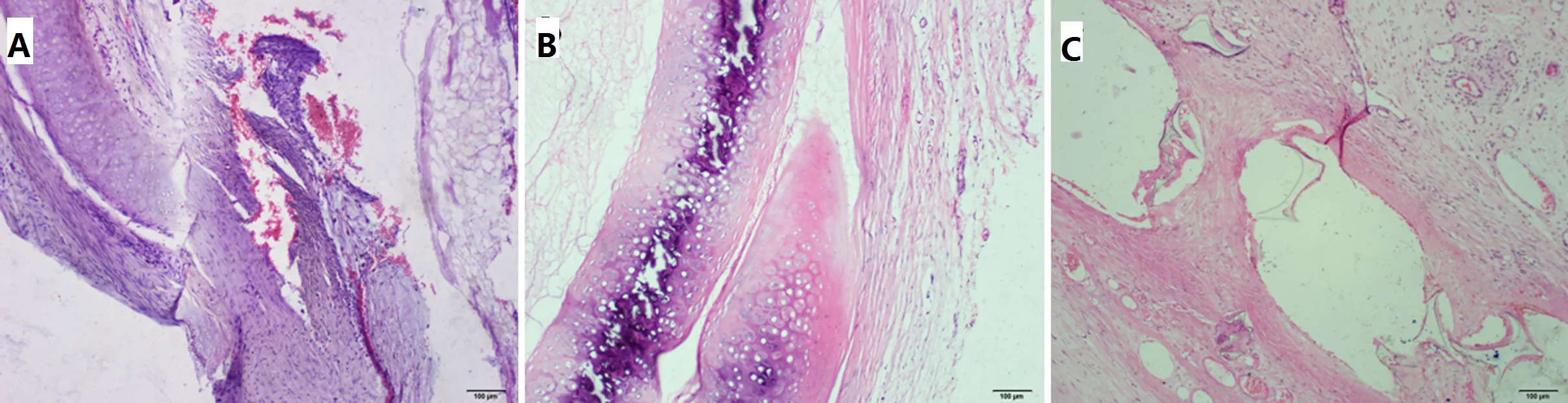
图6 术后30 d HE 染色(A、B、C×100)

图7 术后30 d 免疫组化CD68 抗原染色(A、B、C×100)
3 讨论
细胞外基质是组织工程的重要组成部分,是种子细胞生存的土壤,直接影响种子细胞黏附、增殖、分化,最终促进组织再生和重塑[15-16]。目前不管是以脱细胞基质为基础[17],还是以生物合成支架为基础[18]的方法都被广泛用于组织工程气管研究。脱细胞基质材料含有天然的细胞外基质成分,不会释放有毒的可降解产物或引起炎性反应[19]。但同样脱细胞体外处理周期时间较长、处理环节多,消耗较多人力、物力以及污染风险较大,缺乏供体来源等都一定程度限制其发展[20]。而通过3D 打印技术制备的PCL 气管支架具有:①精度高;②速度快,周期短;③个体化;④种子细胞与支架材料同步化[21-22]等优点。如何利用这两种基质材料的优点构建更加合理有效的人工气管成为目前组织工程气管的研究热点。
气道的重建首先有合适的外形和强度来维持其管腔的形态[23],若无法维持管腔形态术后早期即可能出现管腔塌陷、狭窄等情况。通过力学性能检测发现PCL 气管支架较脱细胞气管支架有明显优势。而脱细胞支架力学性能的下降考虑与在脱细胞过程中气管中的可溶性胶原等的丧失有关[24]。
要成为可应用于临床的组织工程气管支架材料,必须能支持种子细胞黏附、增殖、分化。本实验将BMSCs 接种至两种气管支架外壁上进行体外培养,并观察细胞的黏附、生长情况。SEM 结果显示,BMSCs 在两种气管支架外壁上均贴附良好,细胞呈扁平的圆形、椭圆形,排列紧密,成簇分布,甚至可以看到PCL 基质材料表面附着有更多的细胞。因此,推测脱细胞基质与修饰后的PCL 气管基质材料均可以提供一个良好的细胞黏附界面,并且可以提供细胞增殖生长的环境。PCL材料表面附着有更多的细胞考虑与材料适宜的孔径结构以及修饰后原本疏水材料表面可供黏附的附着点增加有关[25]。而Giemsa 染色及CCK-8 检测均提示,脱细胞气管组细胞毒性最小,所能提供的环境最有利于细胞增殖。所以,PCL 气管支架虽更有利于细胞黏附,但其生长增殖的环境不及脱细胞气管支架。
生物材料的性能要求一方面必须满足功能性,另一方面必须满足与生物长期或短期接触所需要的与生物体的相容性[26]。本研究中术后监测血清中IgG、IgM 的变化,标本取出后行HE 染色及免疫组化巨噬细胞特异性抗原CD68 检测。根据免疫球蛋白的监测情况,IgM 首先出现峰值,IgG 则在2 周以后达到最高峰,这与这两种球蛋白自身特点相符,2 周时PCL 气管组IgG 与IgM 均明显高于另两组,到4 周时3组结果基本一样,说明在炎症反应的急性期PCL 气管组对于机体的刺激较其他两组高。HE 染色可见原生气管组内有大量的单核巨噬细胞、淋巴细胞、浆细胞等浸润,呈现非特异性慢性炎症,PCL 支架则以嗜酸性粒细胞浸润为主,呈现异物肉芽肿性炎症。两者截然不同的炎症反应结果,考虑与材质的本身表面的抗原有关系,PCL 支架表面无抗原,无法形成抗原递呈反应,最终结果会形成纤维包裹和异物肉芽肿,另外可出现嗜酸性粒细胞浸润现象,这可能是异物刺激引起自身免疫反应的结果[27]。
综上所述,本实验通过对脱细胞气管支架及PCL 气管材料的体外、体内生物学性能检测,证实PCL 气管支架具有良好的生物力学性能,脱细胞气管具有低免疫原性、适宜细胞增殖及良好的生物相容性,两种支架材料的相对优势可为构建多层结构杂化式组织工程气管提供依据。

