基于MAVS介导信号通路的补肾方抗炎抗HBV作用及机制研究*
张景豪 郑 超 朱晓骏 张 鑫 周振华 李 曼 高月求 孙学华
上海中医药大学附属曙光医院,上海市中医临床重点实验室 (上海, 201203)
慢性乙型肝炎(CHB)是世界范围内的公共健康问题,全球约20亿人曾感染HBV,其中约有2.4亿慢性HBV感染者[1]。我国是HBV感染的高发区,我国肝硬化和HCC患者中,由HBV感染引起的比例分别为60%和80%[2]。当前,抗HBV药物主要是干扰素和核苷(酸)类似物,但存在着病毒变异耐药、e抗原(HBeAg)血清学转换率低、停药后易复发、疗程长等问题。补肾方是我院治疗CHB的有效验方,主要通对免疫的多环节调控作用发挥其抗炎和诱生干扰素效应。前期体外研究证实,补肾方能够抑制HepG2.2.15细胞上清液中HBsAg、HBeAg的分泌,显著上调线粒体抗病毒蛋白(MAVS)的表达,并能明显够活化IRF-3,诱导IFN-β的表达,从而发挥抗病毒作用[3]。我们以ConA诱导的HBV转基因小鼠肝损伤模型,观察补肾方对MAVS介导信号通路影响,探讨其抗炎、抗病毒作用机制。
1 材料与方法
1.1 实验动物 SPF级HBV转基因小鼠(BALB/c基因背景)购于中国人民解放军第458医院全军肝病中心,由原核显微注射1.3copyHBV全基因组制备,4~6周龄,雄性,动物生产许可证号:SCXK(军)2012-0018。SPF级BALB/c小鼠购于上海西普尔-必凯试验动物有限公司,4~6周龄,雄性,动物生产许可证号:SCXK(沪)2013-0016;饲养于上海中医药大学实验动物中心清洁级动物房,自由饮水,进食标准颗粒饲料。室温22~26°C,相对湿度40%~60%,适应性饲养1周后使用。
1.2 药物及试剂 补肾方由生地、枸杞子、菟丝子、淫羊藿、黄芩、虎杖、苦参各15g,肉苁蓉10g组成(三九医药股份有限公司,批号1505001),水煎取汁,浓度为1.15 g/mL,保存备用。ConA(VI型C2010)购于Sigma公司;丙氨酸转移酶(ALT)试剂盒(批号201506)、天冬氨酸转移酶(AST)试剂盒(批号201512)购于上海将来实业股份有限公司;干扰素β试剂盒(上海欣博盛生物科技公司,货号EMC016)、HBsAg试剂盒、HBV DNA试剂盒(上海科华生物公司,201408151);兔单克隆抗TBK-1抗体(货号ab227182)、兔单克隆抗TRADD抗体(货号ab110644)、兔单克隆抗STING抗体(货号ab92605)、兔单克隆抗TAK-1抗体(货号ab227182)、兔单克隆抗pTAK-1(t183)抗体(货号ab109526)、兔单克隆抗体FADD(货号ab124812)、兔单克隆抗体pFADD(pSer194)(货号SAB4503868)、兔单克隆抗体pFADD(pSer191)(货号SAB4504752)、兔单克隆抗GAPDH抗体(货号ab9484)、小鼠单克隆抗乙型肝炎病毒HBsAg抗体(货号ab859),小鼠单克隆抗乙型肝炎病毒HBcAg抗体(货号ab8638)均购于艾博抗(上海)贸易有限公司;Trizol试剂(批号28202,Invitrogen公司)、免疫组化二抗试剂盒(货号LF-SAB5008,上海优宁维生物科技公司)、Western blot实验所需蛋白裂解液、制胶、电泳等试剂均为碧云天生物技术研究所产品。
1.3 仪器及设备 自动脱水机(LEI CA ASP300)、石蜡包埋机(LEICA EG1160)、轮转切片机(RM305)、烤片机(HI1220)购自德国Leica公司;垂直蛋白电泳仪、蛋白电转移购自美国Bio-Rad公司;PCR仪购自德国Eppendorf公司。
1.4 动物分组及造模 将24只HBV转基因小鼠随机分为正常组、模型组、补肾方组,另设野生(WT)组,每组8只。模型组、补肾方组小鼠按照3μg/g体重经尾静脉注射ConA[4],每周1次,连续4周,正常组及WT组小鼠予经尾静脉注射等刻量生理盐水。造模后补肾方组小鼠每天给予0.3ml补肾方灌胃,按照人用量体表面积换算法补肾方水煎剂给药剂量为2.25g/kg,正常组、模型组、WT组小鼠予以等量生理盐水灌胃,每天1次,连续4周。
1.5 标本采集与处理 各组小鼠造模处理结束后,摘眼球取血,室温静置30min,离心分离血清后置于-20°C备用;取肝右叶小块肝组织,10%多聚甲醛固定,脱水石蜡包埋后备用,其余肝组织置于-80°C备用。
1.6 观察指标与方法
1.6.1 肝功能ALT、AST检测 按照试剂盒具体实验步骤,采用酶联免疫法(ELISA)检测小鼠血清ALT、AST水平。
1.6.2 血清HBsAg、DNA检测 ELISA法检测血清HBsAg水平,RT-PCR检测血清DNA水平。
1.6.3 血清IFN-β检测 按照试剂盒具体实验步骤,采用ELISA法检测。
1.6.4 肝组织HE染色与免疫组化 HE染色观察肝组织病理情况,免疫组化ABC法检测肝组织内HBcAg表达。
1.6.5 肝组织MAVS介导信号通路关键蛋白表达 肝组织低温电动快速匀浆(100mg加1ml裂解液)提取总蛋白,BCA法测定蛋白浓度,制样,灌胶后每孔上样30μg,体积10μl,电泳后经半干法电转至PVDF膜,5%脱脂牛奶室温封闭2h,一抗(1∶1000)4°C孵育过夜,洗膜后二抗(1∶5000)室温孵育1h,洗膜后ECL化学发光法显影。
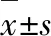
2 结果
2.1 补肾方对实验小鼠肝功能的影响 与正常组比较,模型组小鼠血清ALT及AST水平明显升高(P<0.001);与模型组相比,补肾方组小鼠血清ALT及AST水平有明显下降(P<0.01);补肾方组与正常组小鼠ALT及AST水平比较差异无统计学意义(P>0.05)。见图1。
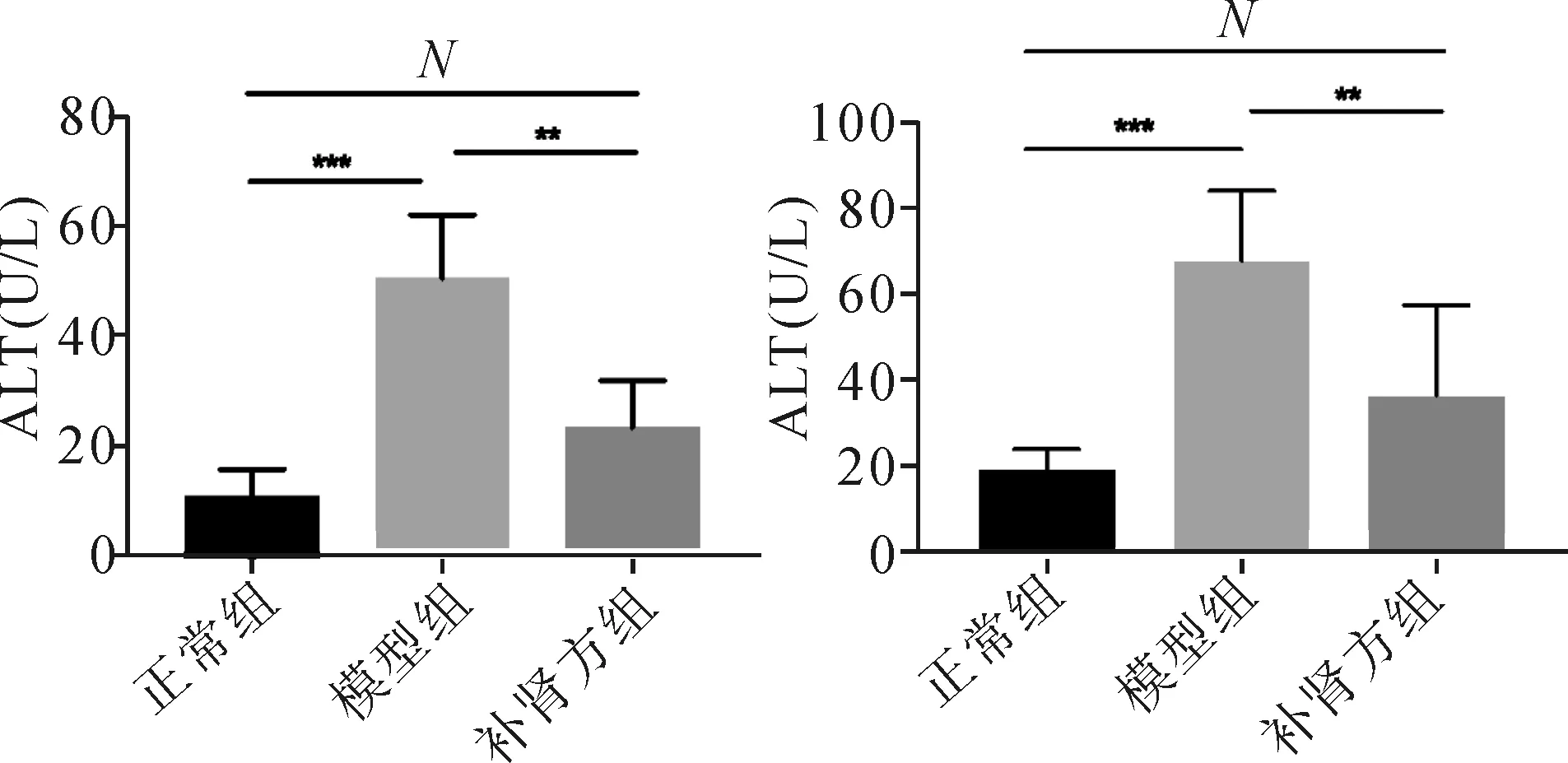
图1 补肾方对ConA诱导的HBV转基因小鼠血清肝功能的影响*P<0.05,**P<0.01,***P<0.001,NP>0.05
2.2 补肾方对实验小鼠血清IFN-β的影响 与正常组相比,模型组小鼠血清IFN-β呈一定程度上升,但差异无统计学意义;经补肾方处理后,小鼠血清IFN-β水平显著上升(P<0.01)。见图2。
2.3 补肾方对实验小鼠血清HBsAg和HBV DNA影响 与正常组及模型组比较,补肾方组小鼠血清HBsAg水平均明显下降(P<0.05);模型组与正常组小鼠血清HBsAg水平无统计学差异。与正常组比较,模型组及补肾方组小鼠血清HBV DNA水平无统计学差异(P>0.05)。见图3。
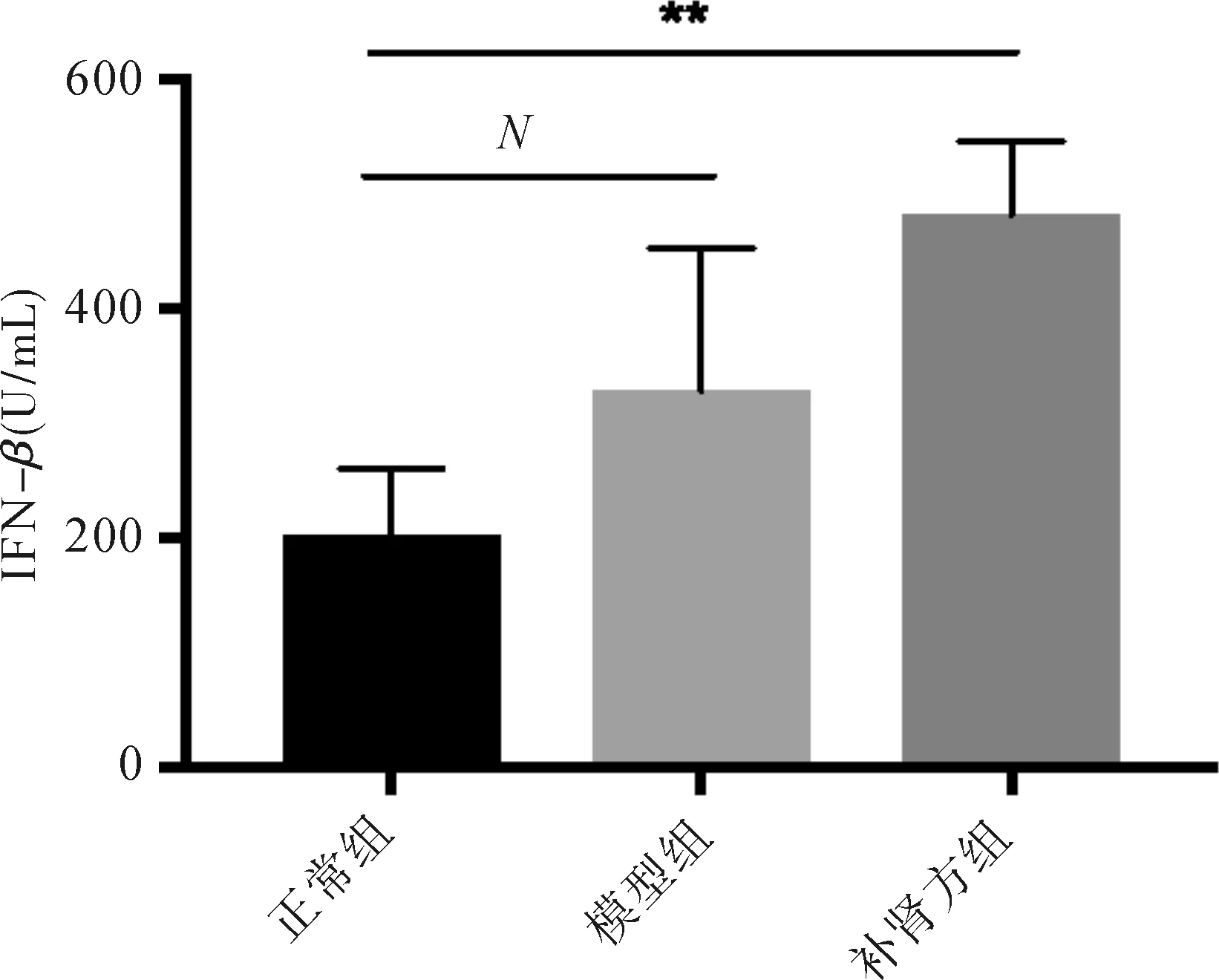
图2 补肾方对ConA诱导的HBV转基因小鼠血清IFN-β的影响

图3 补肾方对HBV转基因小鼠血清HBsAg及HBV DNA的影响
2.4 补肾方对实验小鼠肝组织病理变化影响 HE染色显示,正常组小鼠肝组织肝小叶结构完整清晰,肝细胞索排列整齐,肝细胞未见明显变性、坏死,肝血窦正常,无炎性细胞浸润。模型组肝小叶结构破坏,肝细胞索排列紊乱,可见散在程度不等、大小不一的肝组织坏死区,并有大量炎性细胞浸润,部分视野下可见肝细胞脂肪变性。与模型组比较,补肾方组肝细胞变性坏死明显减少,中央静脉及汇管区少量炎性细胞浸润,未见肝细胞脂肪变性。见插页图4。
2.5 补肾方对实验小鼠肝组织HBcAg表达影响 肝组织免疫组化染色结果显示,与正常组及模型组相比,补肾方组小鼠肝组织内HBcAg阳性表达明显下降(P<0.001)。见图5。
2.6 补肾方对实验小鼠肝内MAVS介导信号通路关键蛋白表达的影响 Western blot结果显示,与对照组相比,补肾方组小鼠肝组织内TBK-1、STING、pTAK-1(t183)表达均上调,TRADD表达下调(P<0.05),对FADD、pFADD(pSer194)、pFADD(pSer191)表达无影响(P>0.05)。见图6。
3 讨论
MAVS是RIG-I样信号通路(RLRs)的下游和NF-κB、IRF-3/7信号通路的上游唯一的接头蛋白,在先天免疫信号通路中起着关键作用。MAVS活化后,可以诱导产生多泛素化TRAF6,并形成了一个包括TAK1激酶和衔接蛋白TAB2在内的复合物。TAK1能激活IKKα/β/γ复合物,使复合物中的IKK-γ通过泛素-蛋白酶体途径降解[5],降解后复合物中的IKKβ具有激酶活性,磷酸化IκB,使IκB暴露其泛素化位点,通过蛋白酶体途径降解,进而活化炎症因子NF-κB[6];同时,MAVS也可以活化TRAF2,活化的TRAF2与TRADD复合体(TRADD/FADD/RIP1)相互作用后,使RIP1具有E3泛素连接酶功能并发生K63连接泛素化,进而招募下游IKKα和IKKβ至NEMO,激活NF-κB通路[7~10]。MAVS也可募集TRAF3并激活TBK1复合体,包括TBK1或多种与IKK相关衔接蛋白,例如TANK、nap1和NEMO。STING可通过与TRAF3相互作用将TBK1和IKKε招募至NEMO从而形成TBK1复合体。TBK1复合体能够诱导IRF3和IRF7转录因子二聚化和磷酸化,并使其转位到细胞核内,结合干扰素刺激反应元件ISRE(IFN-stimulated response elements),最终导致I型干扰素表达和一系列干扰素诱导基因产生[5]。
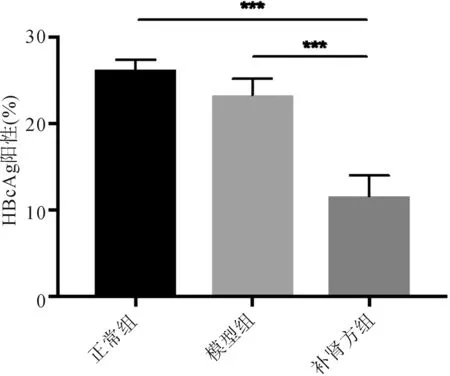
图5 补肾方对HBV转基因小鼠肝内HBcAg的影响(IHC,×100) ***P<0.001
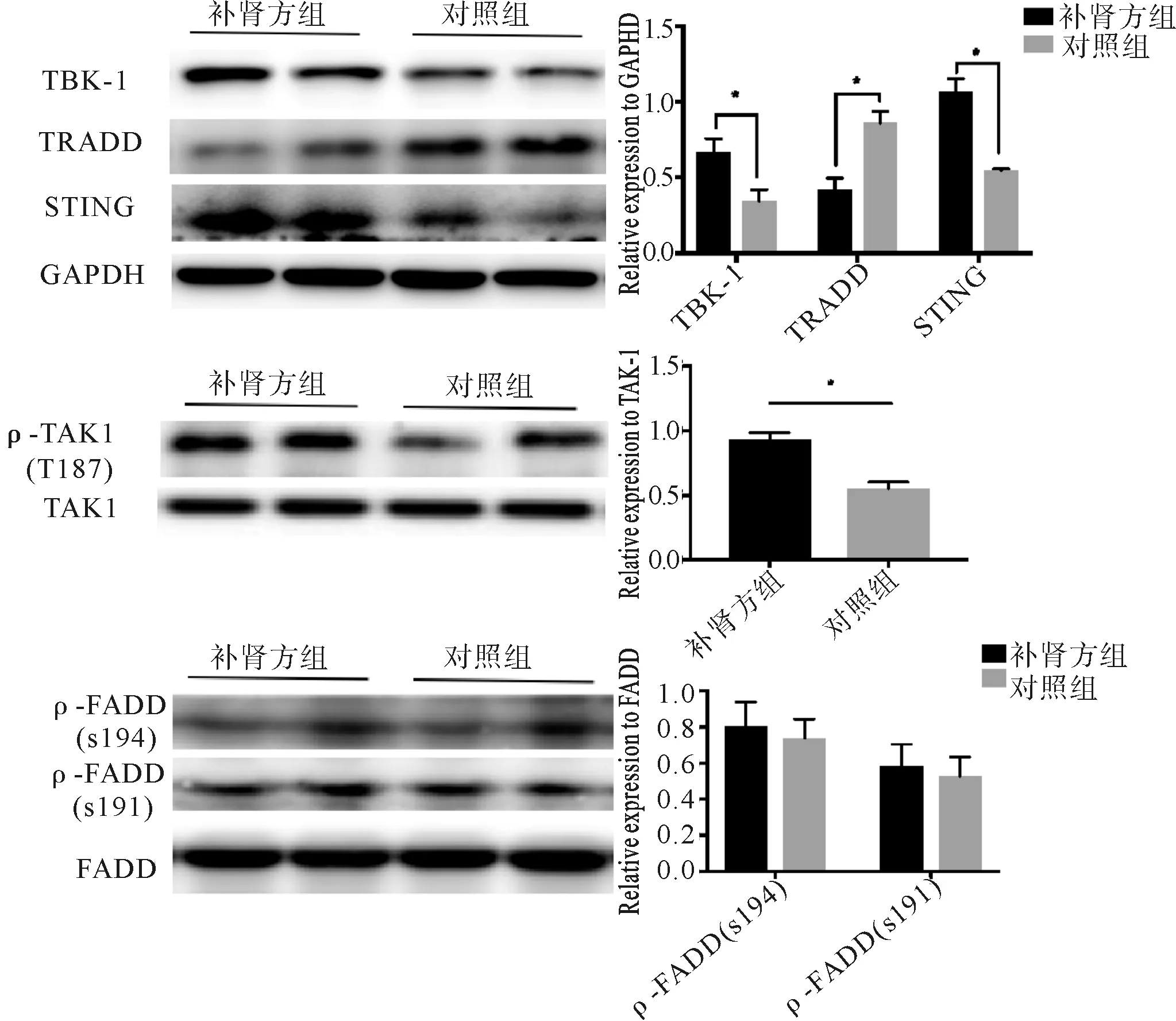
图6 补肾方对实验小鼠MAVS介导信号通路关键蛋白的影响 *P<0.001
古代医籍未见慢性乙型肝炎的记载,但根据其临床症状和体征,可将其归属于“黄疸”、“胁痛”、“肝着”、“肝瘟”、“湿阻”、“疫疠”等疾病范畴。本课题组在长期临床研究发现“肝肾亏虚,湿热未尽”是慢性乙型肝炎持续进展的关键病机,根据“肝肾同源”理论,形成“补肾为主、清化为辅”的补肾方治疗慢性乙型肝炎。全方由巴戟天、菟丝子、甜苁蓉、何首乌、生地、枸杞、虎杖、黄芩、丹参、青皮等药物组成,方中的巴戟天、菟丝子温而不热,健脾开胃,既益元阳,又填阴水;肉苁蓉、何首乌厚重下降,直入肾脉,温而能润,无燥热之害,能温养精血而通阳气;枸杞子滋补肝肾之阴;生地黄养血补阴,有填精补肾之效,且补而不腻;虎杖、黄芩清热解毒利湿;丹参活血化瘀,青皮起理气兼引经药之作用。所选补肾药温而不燥,补而不峻,在补肾之同时又可充实肝体,改善肝脾之功能,使“命门火旺,蒸糟粕而化精微”,而达平衡阴阳的作用[11,12]。
本研究结果显示,补肾方可改善ConA诱导HBV转基因小鼠肝组织炎症变性坏死,抑制小鼠血清HBsAg及肝组织内HBcAg的表达,并提高小鼠血清IFN-β水平,上调TBK-1、STING的表达,下调TRADD的表达,提示其作用机制与MAVS介导的信号通路有关。但由于中药复方成分复杂,作用环节及靶点广泛,补肾方中抗炎及抗HBV作用有效成分及作用机制仍需进一步探讨研究。

