白花香莲解毒颗粒治疗HBeAg阳性慢性HBV免疫耐受期患者的临床研究*
邱 华 毛德文 胡振斌 龙富立 王明刚 张荣臻 黄 鹏
广西中医药大学第一附属医院肝病科 (广西 南宁, 530023)
我国现有9300万慢性HBV感染者,其中约有5000万处于免疫耐受期。而目前国内、外慢性乙型肝炎(CHB)防治指南普遍认为,慢性HBV感染者免疫耐受期由于疾病进展缓慢,且使用核苷(酸)类似物及干扰素的抗病毒作用有限,属于定期随访的对象,临床上对这些感染者一般不做特殊处理[1]。而最近多项研究表明,由于HBV DNA持续高载量及慢性炎症,该类人群不仅是HBV的重要传染源,同时又是CHB、肝硬化、肝衰竭及原发性肝癌等疾病的高危罹患者[2~4]。因此探寻有效的防治手段是临床亟待解决的难题。前期白花香莲解毒颗粒在治疗CHB患者方面已获得满意临床疗效。本研究采用白花香莲解毒颗粒对HBeAg阳性慢性HBV感染的免疫耐受期患者进行48周干预,以评估其临床疗效及安全性。
1 资料与方法
1.1 一般资料 选择2017年1月至2018年12月在广西中医药大学第一附属医院就诊的HBeAg(+)属免疫耐受期的慢性HBV感染者共160例,按照1∶1比例随机分为治疗组和对照组各80例。治疗组患者平均年龄为(36.53±5.21)岁,男70例、女10例,血清HBV DNA均值为(6.21±1.16)lg IU/ml,乙型肝炎e抗原(HBeAg)滴度为(985.43±463.27)S/Co,谷丙转氨酶(ALT)为(30.21±7.13)U/L,Fibro scan肝硬度评分(LSM)为(7.32±1.89)。对照组患者平均年龄为(35.37±4.87)岁,男66例、女14例,血清HBV DNA(6.17±1.09)lg IU/ml,HBeAg滴度为(973.62±442.39)S/Co,ALT为(31.15±7.38)U/L,LSM为(7.23±1.76)。两组受试者的基线水平比较,差异无统计学意义(P>0.05)。本研究获得广西中医药大学第一附属医院伦理委员会批准,所有受试者均签署知情同意书。
1.2 纳入标准 ①诊断符合2015年WHO制定的的慢性HBV感染者免疫耐受期的诊断标准[5];②年龄≥30岁,≤65岁;③HBeAg阳性;④HBV DNA≥2×105IU/ml,≤9×107IU/ml;⑤ALT水平≤40 U/L;⑥肝硬度评分≤12.4。
1.3 排除标准①入选前使用过抗HBV的核苷(酸)类似物、干扰素、胸腺肽等药物者;②入选前30天内参加过其他药物试验者;③合并感染甲、丙、丁、戊型肝炎病毒或HIV者;④合并有代谢性或自身免疫性肝病、酒精性肝病者;⑤原发性肝癌、肝硬化者;⑥入选前6个月内出现血清ALT或AST≥2倍正常值者;⑦合并有心、脑、肾等其他系统严重疾病者;⑧妊娠期或哺乳期妇女。
1.4 治疗方法 采用随机、安慰剂对照的临床研究方法,160例受试者,根据纳入先后顺序,按数字随机化原则分为治疗组和对照组,各80例。治疗组患者口服白花香莲解毒颗粒(由白花蛇舌草30g、三叶香茶菜20g、黄花倒水莲15g、排钱草15g组成),1剂/d,分两次服。对照组患者口服。中药安慰剂(由淀粉、苦味剂、焦糖色素、柠檬黄色素、日落黄色素、麦芽糊精等组成)。与治疗组患者用药外观及重量相同,口感相似,1包/次,2次/d。疗程均为48wk。以上药物均由培力(南宁)药业有限公司(GMP认证)按浓缩中药配方颗粒国家中医药标准制备,同一生产批号。由广西中医药大学第一附属医院临床药理基地编制随机编号。
1.5 观察指标 ①血清HBV DNA定量:采用中山大学达安基因股份有限公司的PCR法检测试剂盒,最低检测值为100IU/ml。②血清乙肝两对半定量:采用雅培公司的化学发光免疫法检测试剂盒。③肝功能ALT、AST:采用日本奥林巴斯公司的全自动生化仪进行检测。④LSM:采用法国Echosens公司的Fibro Scan系统进行检测。评分≤7.3相当于组织病理学分期的F0~F1;评分7.3~9.7相当于F2;评分9.7~12.4相当于F2~F3;评分12.4~17.5相当于F3~F4;评分>17.5相当于F4。⑤安全性指标:常规检测血常规、尿常规、大便常规、肾功能、心电图,随时观察不良反应事件的发生。⑥统一检测的时间节点为0wk、12wk、24wk、48wk。
1.6 症状积分判定方法 症状积分标准参照按《中药新药临床研究指导原则(试行)》,按临床症状轻重程度分为4级:无症状为0分,轻度为1分,中度为2分,重度为3分。主要观察乏力、肝区疼痛、纳差等慢性HBV感染者免疫耐受期最主要的3大症状。

2 结果
2.1 两组受试者治疗不同时间点HBV DNA水平检测情况 见表1。
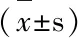
表1 两组受试者不同时间点HBV DNA水平比较
与本组0wk比较,△P<0.05;与对照组相同时间点比较,#P<0.05
2.2 两组受试者治疗48wk后HBV DNA下降程度及阴转情况 见表2。

表2 两组受试者治疗48wk时HBV DNA下降及阴转情况比较 [n(%)]
与对照组比较,#P<0.05
2.3 两组受试者治疗24wk、48wk HBeAg检测情况 见表3。
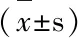
表3 两组受试者治疗24、48wk HBeAg水平比较
与本组0wk比较,△P<0.05;与对照组相同时间点比较,#P<0.05
2.4 两组受试者治疗前、后LSM值检测情况 见表4。

表4 两组受试者治疗0wk、48wk LSM情况比较 [n(%)]
与本组0wk比较,△P<0.05;与对照组48wk时比较,#P<0.05
2.5 两组受试者治疗12wk、24wk、48wk症状积分情况 见表5。

表5 两组受试者治疗12、24、48周时症状积分比较分)
与本组0wk比较,△P<0.05;与对照组相同时间点比较,#P<0.05
2.6 安全性情况 治疗48周期间,两组受试者的血常规、尿常规、大便常规、肾功能及心电图均未见明显异常改变,与入组时比较无统计学差异(P>0.05),未发生任何与本研究相关的严重不良反应事件。
3 讨论
《慢性乙型肝炎防治指南(2015版)》将从婴幼儿期感染HBV的自然史分为免疫耐受期、免疫清除期、非活动或低(非)复制期和再活动期4个期,这是一个动态的转归过程,并非所有感染者都会经历上述4期,各期也不是连续不变的。在婴幼儿时期感染HBV后,由于机体的免疫系统尚未建立完善,以致免疫系统对HBV不能识别,绝大多数感染者会表现免疫耐受状态,即ALT正常或轻度升高、HBeAg阳性、HBV DNA持续高载量且肝组织没有或仅有轻微的损伤,可维持几年至几十年不等[6]。
而近年人们日益意识到慢性HBV感染免疫耐受期是一个必须高度重视的研究领域:①感染人群庞大,据统计目前我国约有5000万的慢性HBV感染者处于免疫耐受期,虽然持续处于活跃的病毒复制状态,但不能获得免疫清除期患者一样有效的抗病毒治疗及健康管理,因此他们就成为了主要的HBV高危传染源和病毒库。②病情隐蔽性强。虽然肝脏病理检测是评估肝纤维化和炎症程度的“金标准”,但因肝穿刺是一种有创性诊断手段,因此临床上仍主要以ALT水平为主要评估指标,存在较大的“漏诊”。研究表明,ALT联合FibroScan系统有助于提高诊断的准确性。此外,对于30岁以上的长期慢性HBV感染者来说其进展为肝硬化的风险较大[7]。③肝细胞癌高发。高载量的HBV DNA是独立于ALT水平、HBV基因型及HBeAg状态外肝细胞癌发生的危险因素,其可能与病毒活跃复制,病毒DNA有较高机会整合到染色体和诱导基因组不稳定相关。因此着眼于长远,抑制HBV DNA水平对免疫耐受期的HBV感染者仍然是非常有意义及必要的。④生活质量下降。人体免疫系统、肝脏等在长期高水平的HBV DNA、HBeAg、HBsAg影响下,临床上很多免疫耐受期的HBV慢性感染者会逐渐出现不同程度的乏力、纳差、胁痛等症状,严重影响生活质量。因此,探寻慢性HBV感染者免疫耐受期有效的治疗方法,成为了肝病领域亟待解决的难题。

本研究结果提示,白花香莲解毒颗粒能显著改善免疫耐受期受试者的不适症状,抑制HBV DNA复制及HBeAg分泌,并降低肝纤维化的评分,使受试者在多个层面受益,安全性良好,其机制有待进一步深入研究。

