CaMKⅡγ基因沉默对破骨细胞分化中NFATc1、TRAP、c-Src基因表达的影响
刘梦楠 王 会 戚孟春 董 伟 李 任 孙 红
破骨细胞在分化成熟过程中受一系列细胞因子调控[1-3],许多骨过度吸收性疾病都与其活性改变及生成数目异常有关[4]。因此,如何抑制由破骨细胞参与的骨吸收过程是治疗这些疾病的有效途径。CaMKII是钙调蛋白依赖性激酶CaMKs的重要成员,是Ca2+/Calmodulin的重要靶位点[5],有α,β,δ,γ四个不同的异构体[6-7],其中CaMKIIδ和γ高度表达于破骨细胞分化中,且作用较为关键[8]。前期研究发现CaMKIIδ RNAi显著抑制破骨细胞生成[9-10],然而CaMKIIγ如何在破骨细胞分化中发挥作用,国内外尚无报道。Ca2+/钙调蛋白/NFATc1信号传导途径是调节破骨细胞分化和骨吸收的重要信号传导途径[11-12]。在外界刺激下,细胞内Ca2+与CaMKs结合,调控下游NFATc1、TRAP、c-Src等相关基因表达,从而影响破骨细胞分化成熟及骨质吸收[11-13]。故本研究通过RNAi技术,检测CaMKIIγ对细胞分化中NFATc1、TRAP、c-Src基因表达的影响,进而探讨其在破骨细胞分化成熟过程中的作用,为骨吸收性疾病的治疗提供实验依据。
1 方法
1.1 分组
运用慢病毒构建CaMKIIγ重组干扰载体,委托上海吉凯基因公司完成。RAW264.7细胞分为A、B、C三组,A组为对照组,未用病毒转染;B组用阴性载体病毒转染;C组用重组干扰载体进行转染。
RAW264.7细胞以5×103/孔的密度接种到30 mm直径的培养皿中培养;转染12 h后,用含50 ng/mL RANKL的DMEM培养基诱导细胞向破骨细胞分化;隔天换液,于诱导5天后收获细胞,进行相关检测。
1.2 实时荧光定量PCR检测NFATc1、TRAP、c-Src基因mRNA水平
用Trizol法提取三组细胞总RNA,逆转录合成cDNA。采用实时荧光定量PCR将三组逆转录的cDNA和待测基因引物[5]按TaRaKa扩增试剂盒进行扩增,以管家基因β-actin(肌动蛋白)作为内参。反应条件为:首先95℃ 30 s;然后95℃ 15 s,55℃ 20 s,72℃ 20 s,共45个循环;检测NFATc1、TRAP、c-Src及β-actin的mRNA表达情况;实验重复3次,取平均值表示mRNA相对表达水平。
1.3 蛋白印迹法检测NFATc1、TRAP、c-Src蛋白水平
将蛋白酶抑制剂与RIPA裂解液在冰上预冷配制,提取各组总蛋白,检测蛋白浓度,上样配制;蛋白100℃煮沸变性5 min,制取凝胶,电泳电转以后抗体孵育;TBST盒内轻摇洗涤3次,每次10 min,ECL显色试剂盒显影;用Amersham Imager600凝胶成像系统采集图像,以β-actin条带灰度值作为参照,测量计算待测基因条带灰度值;每组重复3次。
1.4 免疫荧光化学检测NFATc1、TRAP、c-SRc蛋白表达及破骨细胞生成
用4%多聚甲醛溶液固定各组细胞,PBS洗涤3次,每次15 s。山羊血清封闭20 min,孵育抗体,使用异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)标记和碘化丙锭(Propylene iodide,PI)标记。激光共聚焦显微镜下600倍观察,实验重复三次。
1.5 统计学处理
应用SPSS 17.0软件进行统计学分析,多组定量数据采用单因素方差分析,多组内两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 实时荧光定量PCR检测NFATc1、TRAP、c-Src基因mRNA水平分析
经Rotor-Gene 3000荧光定量PCR仪检测,A组、B组和C组中NFATc1、TRAP、c-Src与管家基因β-actin的mRNA均有表达。C组NFATc1、TRAP、c-Src mRNA的相对表达量分别为0.52±0.04(P<0.001)、0.59±0.02(P<0.001)和0.52±0.02(P<0.001),较A组分别下降了49.86%、43.65%和53.57%;B组与A组间则无统计学差异(P>0.05)(图1)。上述结果表明,CaMKIIγ RAN干扰可显著抑制破骨细胞分化成熟中NFATc1、TRAP、c-Src基因的mRNA水平。
2.2 蛋白印迹法检测NFATc1、TRAP、c-Src蛋白水平
A组与B组蛋白条带相似,染色较强;而C组蛋白条带染色明显弱于A、B组。定量分析表明,C组NFATc1、TRAP、c-Src蛋白条带相对光密度值显著低于A组,较A组分别下降54.22%(P<0.001)、46.75%(P<0.001)和45.86%(P<0.001);而A组与B组之间无统计学差异(P>0.05)(图2)。上述结果说明,CaMKIIγ RNA干扰抑制了破骨细胞分化中NFATc1、TRAP、c-Src蛋白的表达。
2.3 免疫荧光化学检测NFATc1、TRAP、c-Src蛋白表达及破骨细胞生成
C组多核破骨细胞(胞核≥3个)生成较少,体积较小;且NFATc1、TRAP、c-Src蛋白表达较弱,荧光较浅,胞核内均未见表达。而A组、B组多核破骨细胞生成较多,体积较大;蛋白表达较强,荧光较亮;其中NFATc1在胞浆胞核内均有表达,而TRAP、c-Src主要分布在胞浆(图3-5)。上述结果提示,CaMKIIγ RNA干扰显著抑制了破骨细胞生成,并降低其内NFATc1、TRAP、c-Src蛋白水平,抑制NFATc1蛋白活性。

图1 实时荧光定量PCR检测NFATc1、TRAP、c-Src基因mRNA水平(n=3)Figure 1 The levels of NFATc1,TRAP and c-Src mRNA in osteoclasts by Real-time PCR(n=3)Note:A.The expression of NFATc1 mRNA;B.The expression of TRAP mRNA;C.The expression of c-Src mRNA in osteoclasts.* P<0.05,when compared with the A group.
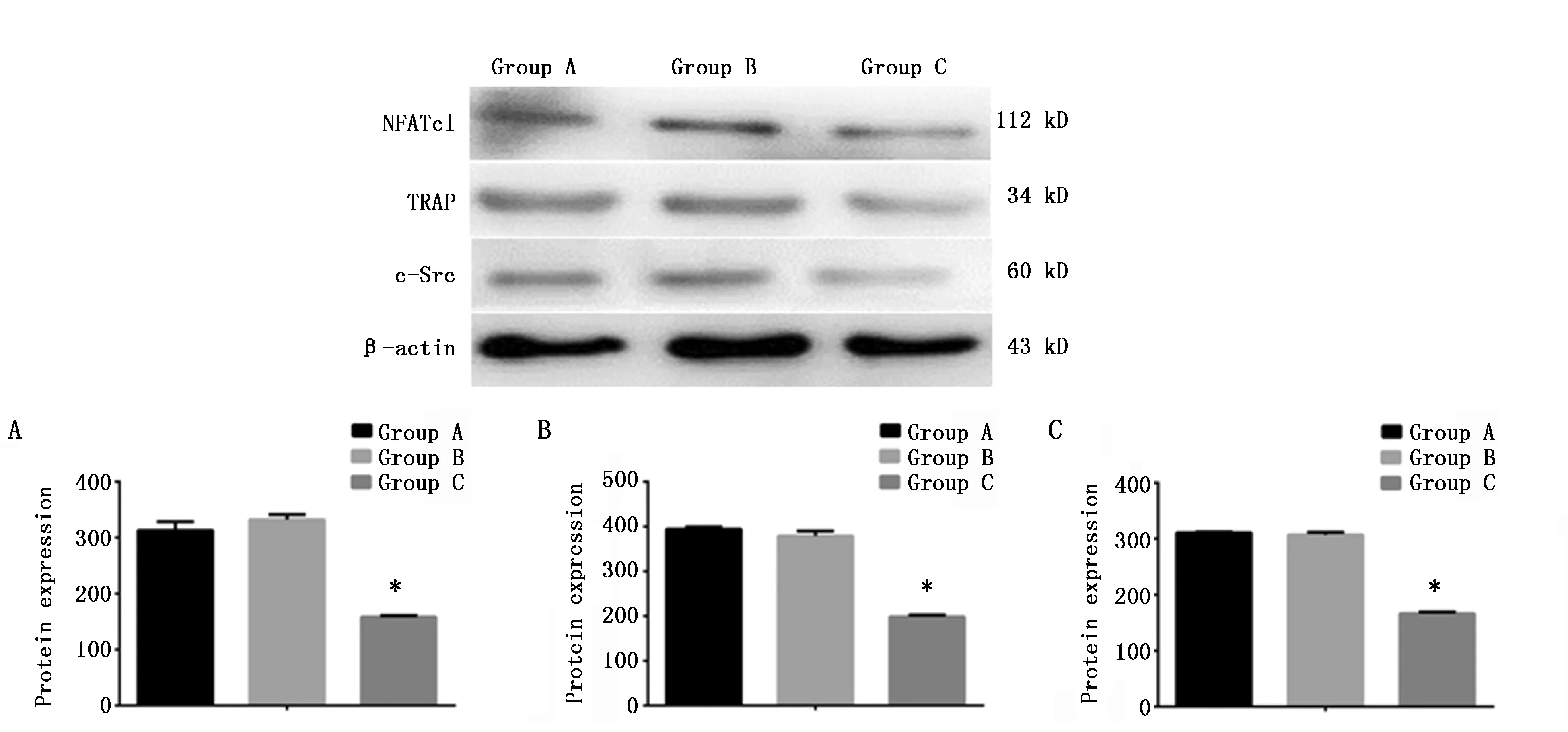
图2 蛋白质印记法检测三组细胞NFATc1、TRAP、c-Src蛋白表达(n=3)Figure 2 The expression of NFATc1,TRAP and c-Src protein in osteoclasts by Western blot(n=3)Note:A.The expression of NFATc1 protein;B.The expression of TRAP protein;C.The expression of c-Src protein in in osteoclasts.* P<0.05,when compared with the A group.
3 讨论
骨质疏松、牙周炎、种植体周围炎等骨吸收性疾病都与破骨细胞分化和活性异常增高有关。在CaMKs中,CaMKII和CaMKIV与破骨细胞生成有关;有研究已经证明了CaMKIV的作用[9],但CaMKII对破骨细胞生成过程中的调控作用尚未明确证实,且CaMKII中CaMKIIγ的作用机制,目前国内外也少有报道。
破骨细胞前体在RANKL等因子的刺激下,细胞内发生Ca2+离子震荡,Ca2+与Calmodulin结合,从而分别激活CaMKs和钙调磷酸酶(Calcineurin)两个信号分子;二者又以不同方式调控下游的NFATc1基因表达和蛋白活性,继而影响破骨细胞分化及骨吸收。CaMKII是Calmodulin下游传递Ca2+信号的重要分子,参与破骨细胞分化调控,其结构域包含可变结构域,自我抑制结构域,相关结构域和催化结构域[14]。可变域和相关域之间的差异产生CaMKIIα,β,δ,γ四种不同的亚型[15]。国外学者证实,在破骨细胞分化的不同阶段,四种亚型的表达水平存在统计学差异,表明它们可能在细胞分化中发挥不同作用[3,8,16]。我们前期发现,在α、β、δ、γ四个异构体中,CaMKIIδ和γ在破骨细胞分化中表达较高[8-10],证明其作用较为关键;CaMKIIδ基因沉默可显著抑制破骨细胞生成及骨吸收功能,并下调NFATc1、TRAP、c-Src基因表达[17],进一步证明了CaMKIIδ在破骨细胞分化中的关键作用。然而,CaMKIIγ是否与CaMKIIδ发挥着相似的作用目前尚不清楚。为此,本研究应用RNA干扰技术探索CaMKIIγ基因沉默对破骨细胞分化的影响;结果发现,CaMKIIγ RNA干扰显著下调了NFATc1、TRAP、c-Src基因表达,使其mRNA水平分别下降了49.86%、43.65%和53.57%,蛋白水平分别下降54.22%、46.75%和45.86%。同时,免疫荧光细胞化学检测显示,RNA干扰也显著抑制了破骨细胞生成,使之数目变少,体积变小。上述结果说明,CaMKIIγ与CaMKIIδ相同,都在破骨细胞分化中发挥重要调控作用。
NFATc1是Ca2+信号下游调控破骨细胞分化和骨吸收的主要调节因子(Master regulator),参与许多破骨细胞特异性基因表达的调控,在破骨细胞融合、黏附、迁移、酸化及骨有机基质降解中发挥关键作用[11-12,18-19]。NFATc1表达异常会引发破骨细胞生成及功能严重障碍,发生骨硬化症[18-19]。本研究中CaMKIIγ基因沉默后,NFATc1基因表达显著减少,同时破骨细胞的生成也受到明显抑制,从而说明CaMKIIγ对破骨细胞分化的调控是通过影响NFATc1基因表达来实现的。另外,NFATc1在上游信号作用下需要在胞浆内脱磷酸而活化,进而异位进入胞核参与破骨细胞特异基因的表达调控[11-12,18-19]。本研究中RNA干扰组胞核内未观察到活化的NFATc1,而另外两组胞核内则有高水平的NFATc1存在,说明CaMKIIγ不仅通过影响NFATc1基因表达,还通过影响其蛋白活性来发挥对破骨细胞分化调控作用。
c-Src属于非受体酪氨酸激酶家族成员,可以通过使信号蛋白磷酸化或是作为适配体连接其它信号蛋白来发挥作用[20]。c-Src基因敲除的破骨细胞细胞骨架异常,无法形成正常伪足,细胞移动及皱褶缘形成也出现异常,阻碍了其骨吸收活性,导致骨硬化症[21-22]。研究还发现,RANKL与破骨细胞表面受体RANK结合后,募集胞内适配分子肿瘤坏死因子受体相关因子6(TNF receptor-associated factor 6,TRAP6),TRAP6可与胞内c-Src形成信号复合物,并增强c-Src激酶活性,继之激活Akt/PKB途径,从而诱导破骨细胞生成与分化[23]。本研究中CaMKIIγ RNA干扰显著抑制了c-Src基因表达,说明c-Src可能参与了CaMKIIγ对破骨细胞分化的调控,Ca2+信号通路通过c-Src与Akt/PKB信号发生了交叉。
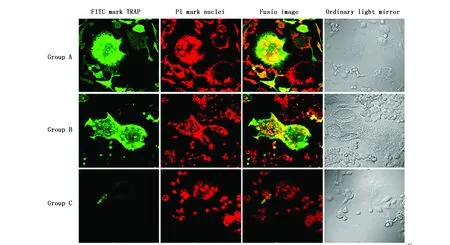
图3 免疫荧光细胞化学检测NFATc1在破骨细胞中的表达(LSCM,×600)Figure 3 Detection of NFATc1 expression in osteoclasts by immunofluorescent cytochemistry(LSCM,×600)Note:The NFATc1 gene is labeled with FITC and the nucleus is labeled with PI.Group A and group B have more multinucleated osteoclasts,stronger protein expression and brighter fluorescence.Group C multinucleated osteoclasts are less produced and smaller in size.

图4 免疫荧光细胞化学检测TRAP在破骨细胞中的表达(LSCM,×600)Figure 4 Detection of TRAP expression in osteoclasts by immunoflurescence cytochemistry(LSCM,×600)Note:The TRAP gene is labeled with FITC and the nucleus is labeled with PI.Group A and group B have more multinucleated osteoclasts,stronger protein expression and brighter fluorescence.Group C multinucleated osteoclasts are less produced and smaller in size.
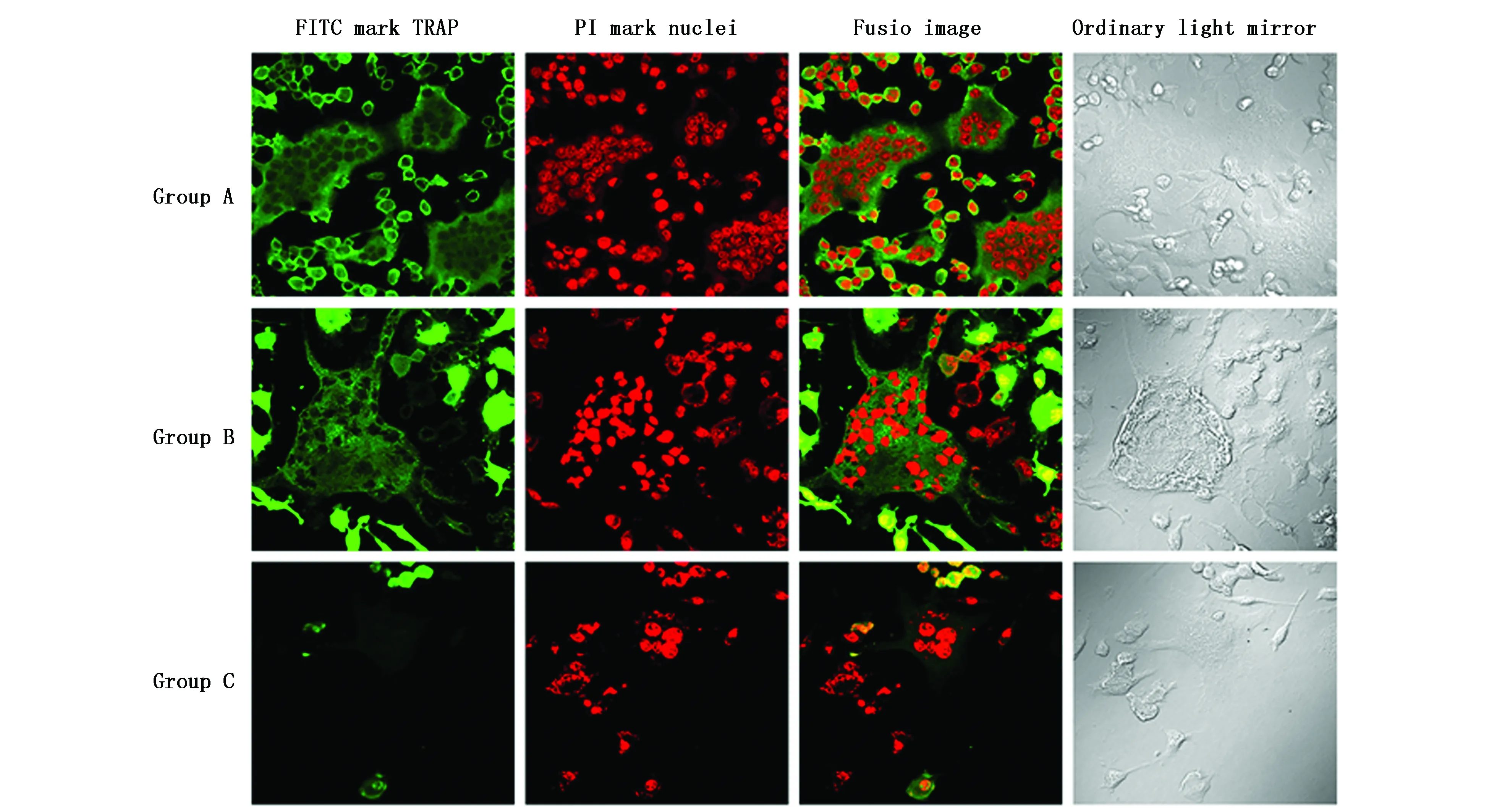
图5 免疫荧光细胞化学检测c-Src在破骨细胞中的表达(LSCM,×600)Figure 5 Detection of c-Src expression in osteoclasts by immunoflurescence cytochemistry(LSCM,×600)Note:The c-Src gene is labeled with FITC and the nucleus is labeled with PI.Group A and group B have more multinucleated osteoclasts,stronger protein expression and brighter fluorescence.Group C multinucleated osteoclasts are less produced and smaller in size.
TRAP是破骨细胞标志蛋白之一,在分化阶段及成熟破骨细胞中均高表达,并在骨吸收中发挥重要作用。该基因由Acp5基因编码,Acp5基因缺陷小鼠表现为中度骨硬化症[24]。TRAP主要存在于破骨细胞的溶酶体中,参与骨基质的降解;也被释放进入骨吸收陷窝,使骨桥蛋白去磷酸化,促进破骨细胞迁移[25-26]。本研究中CaMKIIγ RNA干扰显著抑制了TRAP基因表达,说明CaMKIIγ对破骨细胞的调控与TRAP密切相关。
综上所述,本实验采用RNA干扰技术对CaMKIIγ进行基因沉默,显著下调了NFATc1、TRAP、c-Src基因表达,并抑制了破骨细胞生成;提示CaMKIIγ对破骨细胞分化发挥着关键调控作用,而NFATc1、TRAP、c-Src参与了CaMKIIγ对破骨细胞分化的调控。

