盆腔肿瘤IMRT下骨髓剂量-体积参数与急性血液学毒性相关性研究进展
陈宏博 余增荣 丁小凡 综述 肖 林 审校
盆腔恶性肿瘤如直肠癌、宫颈癌、子宫内膜癌等为我国十大常见恶性肿瘤[1]。放射治疗在盆腔肿瘤综合治疗中占据着重要的地位。成年人中盆腔骨髓约占全身骨髓的40%[2],为主要造血器官。放射线对盆腔骨髓造血干细胞及骨髓间充质干细胞、骨髓内在的脉管系统与微环境等损伤所造成的血液学毒性使很大一部分患者并不能很好执行标准放化疗模式[3-4];另一方面,同期化疗的加入进一步增加了骨髓抑制风险,也降低了盆腔外骨髓的代偿反应,进而降低放化疗耐受性、增加继发性感染及死亡风险[5-7]。白细胞或中性粒细胞下降虽可以用粒细胞集落刺激因子(Granulocyte colony-stimulating factor,G-CSF)等对症支持,但G-CSF的应用有可能通过ROS-p38-p16通路促进造血干细胞的老化进而加重射线诱发的长期骨髓损害[8]。盆腔骨髓受照射体积及剂量越大,则发生血液学毒性的风险也越高[9]。因此,有效减轻盆腔肿瘤放化疗期间血液学毒性(Hematologic toxicity,HT)的方法就是找到与发生急性HT相关的盆腔受照射骨髓剂量-体积参数,进而指导放疗计划优化、充分保护骨髓。适形调强放射治疗(Intensity-modulated radiation therapy,IMRT)技术可最大限度保证凹形靶区剂量覆盖的同时很好保护邻近正常器官,目前已广泛应用于宫颈癌、子宫内膜癌、直肠癌等[10-13]。越来越多的研究显示,盆腔恶性肿瘤如宫颈癌/子宫内膜癌及直肠癌等IMRT治疗模式下盆腔受照射骨髓(骼)的部分剂量-体积参数与放化疗期间的HT存在显著相关。
1 宫颈癌/子宫内膜癌患者盆腔骨髓(骼)的剂量-体积参数与急性HT关系
研究显示宫颈癌患者盆腔骨髓(骼)的部分剂量-体积参数与放化疗期间急性HT相关。Mell等[14]将整个骨盆分为三个部分:(1)髂骨(Ilium):从髂骨翼至股骨头上端的整个髂骨部分;(2)下盆腔(Lower pelvis,LP):包括耻骨(Pubes)、坐骨(Ischia)、髋臼(Acetabula)及近端股骨(股骨头上界至坐骨结节部分);(3)腰骶椎(Lumbosacral spine,LSS):包含治疗计划靶区的腰椎椎体最上端至整个骶骨(具体示意图见图1)。将相应骨骼外轮廓作为其所含骨髓代替品。通过分析37例接受同期放化疗的宫颈癌患者发现:盆腔骨髓V10≥90%的患者发生≥2级白细胞及中性粒细胞下降几率显著高于V10<90%的患者(73.7%vs. 11.1%,P<0.01;31.6%vs. 5.6%,P=0.09);V30及V40与HT无相关性;腰骶椎及下骨盆的骨髓比髂骨骨髓有更强的相关性。Klopp等[15]分析了83例接受术后IMRT辅助放化疗(50.4 Gy/28 F)的妇科肿瘤(40例宫颈癌,同期DDP40 mg/m2;43例子宫内膜癌,单独放疗)患者:将治疗计划靶区上、下界范围内所有骨骼及双侧的股骨头(不包括任何股骨)定义盆腔骨(图2),亦将相应整个骨骼外轮廓作为其所含骨髓代替品,结果显示,对于宫颈癌患者而言,盆腔骨髓(骼)V40>37%的患者发生≥2级HT的几率显著高于V40≤37%的患者(75%vs. 40%,P=0.025);盆腔骨髓(骼)平均剂量>34.1 Gy的患者发生≥2
级HT的几率显著高于平均剂量≤34.2 Gy的患者(74%vs. 43%,P=0.049);盆腔骨髓(骼)V10、V20、V30与HT无相关性。Albuquerque等[16]采用类似Klopp[15]所用方法定义盆腔骨髓(骼),通过分析40例接受IMRT+同期化疗的宫颈癌患者资料发现:全盆腔骨骼V20与发生≥2级HT相关(r=0.8,P<0.0001),若V20>80%,则发生≥2级HT的风险增加(OR=4.5,95%CI:1.08~18.69),而患者的年龄、体重指数及有无输血史与≥2级HT无关。Rose等[9]通过44例接受了辅助IMRT放疗+同期化疗的宫颈癌患者资料,分析了全盆腔骨髓(骼)剂量-体积参数与发生≥3级HT的关系,结果发现,全盆腔骨髓(骼)V10≥95%的患者发生≥3级白细胞减少风险显著高于V10<95%的患者(68.8%vs. 24.6%,P<0.001);全盆腔骨髓(骼)V20>76%的患者发生≥3级白细胞减少风险显著高于V20≤76%的患者(57.7%vs. 21.8%,P=0.001)。
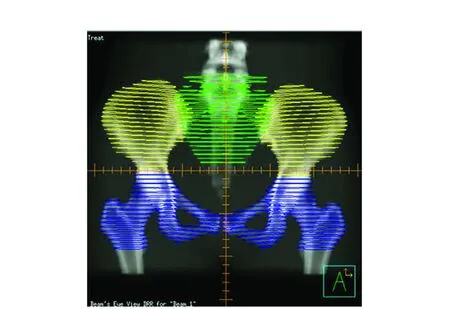
图1 盆腔骨髓(骼)构成冠状位示意图Figure 1 Coronal schematic of pelvic bone marrow(bone)constitutesNote:yellow ilium;green lumbosacral spine;blue-lower pelvis.

图2 盆腔骨髓勾画的横截面示意图Figure 2 Pelvic bone marrow(bone)outline Note:red for bone marrow.
唐滟等[17]回顾性分析126例同期放化疗的宫颈癌患者,盆腔骨髓勾画包括髋骨、L5椎体、整个骶骨、髋臼、近端股骨上端,结果发现:全盆腔骨髓的V40<41%、V50<9%的患者治疗期间发生3~4级HT的风险显著降低,治疗前血肌酐<65 μmol/L亦可减少发生≥3级HT的风险。高丽环等[18]收集了300例宫颈癌患者(174人接受同期放化疗,126人接受单纯放疗),骨盆勾画包括腰骶骨、髂骨、坐骨、耻骨,多因素分析显示患者的年龄(OR=4.02)、性别(OR=3.75)、肿瘤部位(OR=6.32)、病理类型(OR=4.20)、全骨盆骨髓的V10(OR=1.58)、V20(OR=1.63)、V30(OR=1.96)、V40(OR=1.84)是发生≥2级急性HT的独立影响因素,全骨盆骨髓的V10≥90%、V20≥75%、V30≥59.2%、V40≥37%的患者发生≥2级HT更高的风险。
2 直肠癌患者盆腔骨髓(骼)的剂量-体积参数与急性HT关系
研究显示术前同期放化疗直肠癌患者中盆腔骨髓(骼)的部分剂量-体积参数与发生≥2级HT相关。Wan等[19]回顾性分析了93例接受术前IMRT(50 Gy/25 F)+同期卡培他滨(825 mg/m2,bid,d1-5×5周)治疗的LARCs资料,盆腔骨髓(骼)的定义参照Mell等[14]方法,结果发现:腰骶椎骨髓(骼)V40≥60%的患者发生2级HT风险显著高于V40<60%的患者(38.3%vs. 13%,P=0.005),女性发生2级HT风险显著高于男性(46.9%vs. 14.8%,P=0.001)。Wang等[20]前瞻性收集35例行术前IMRT放疗(50 Gy/25 F)+同期卡培他滨(825 mg/m2,bid,d1-5×5周)+奥沙利铂(50 mg/m2,qw)治疗的LARCs,所有患者放疗计划均行盆腔MRI与CT融合,应用MRI的T1加权图像鉴别盆腔活性骨髓(MR信号为等或稍高于周围肌肉信号)(图3),盆腔骨骼的上、下界范围分别为治疗计划靶区上或下界外2.5 cm。结果发现盆腔骨髓V5(≤96%vs. >96%)与白细胞、中性粒细胞及PLT下降显著相关。Yang等[21]通过回顾性分析了120例接受了新辅助放疗(行三维适形放射治疗67例,IMRT治疗53例,中位放疗剂量50.4 Gy)+5-FU为主同期化疗的LARCs资料,其将盆腔骨骼分为三个部分,并将相应骨骼代替其所含骨髓:(1)骶骨骨髓:L5-S1结合部-尾骨;(2)髋骨骨髓:包括双侧髂骨、坐骨及耻骨;(3)近端股骨骨髓:包括双侧股骨头及近端股骨。结果发现仅髋骨骨髓V45与骶骨骨髓V45与白细胞及中性粒细胞的抑制程度相关。Newman等[22]回顾性分析了35例接受术前同期放化疗+手术+术后化疗的晚期直肠癌患者,采用Mell等[14]方法定义盆腔骨髓,多因素Logistic回归分析发现骨盆骨髓平均剂量≥36.6 Gy和下骨盆骨髓平均剂量≥32.6 Gy,与术后化疗期间患者引起3级HT的风险增高密切相关。

图3 CT/MRI融合图像后盆腔活性骨髓的勾画Figure 3 Delineation of pelvic active bone marrow after CT/MRI fusion imageNote:red for active bone marrow.
3 其它盆腔肿瘤患者的骨髓(骼)的剂量-体积参数与急性HT关系
多个研究亦显示其它盆腔肿瘤如肛管癌、前列腺癌等患者的骨髓(骼)的部分剂量-体积参数与放化疗期间急性HT相关。Franco等[23]收集了50例接受IMRT及同期化疗的肛管患者,盆腔骨髓(骼)的定义参照Mell等[14]方法,研究发现腰骶椎骨髓(骼)V40≥41%的患者≥3级HT的发生率高于V40<41%的患者(55.3%vs. 32.4%;P<0.01)。Lee等[24]收集了56名肛管癌患者接受了调强放疗(n=49)或三维适形治疗(n=7)的同期放化疗,采用Mell等[14]方法定义盆腔骨髓(骼),研究发现下盆腔骨髓(骼)V40与3级HT相关,下盆腔骨髓(骼)V40≥23%的患者以及V40<23%的患者相比较,发生≥3级白细胞几率减少(29%vs. 4%,P=0.02),发生≥3级中性粒细胞几率减少(33%vs. 8%,P=0.04),发生≥3级血小板几率减少(32%vs. 7%,P=0.04)。Sini等[25]前瞻性收集了121例前列腺癌患者行辅助或挽救性放疗(IMRT治疗19例,VMAT治疗57例,Tomo治疗45例),盆腔骨髓(骼)的定义参照Mell等[14]方法,结果显示:治疗前淋巴细胞的基线<1830/μL、全盆腔骨髓(骼)V40>599cc与急性3级淋巴细胞减少的高风险相关,而有吸烟史及髂骨骨髓(骼)V40>95cc则可作为预测发生晚期2级淋巴细胞减少的危险因素。
4 盆腔功能性骨髓的概念及其临床价值
目前针对盆腔功能性骨髓的研究病例数相对偏少、对盆腔骨髓(骼)有效范围及骨髓的定义差异明显、即使针对盆腔骨髓(骼)同一剂量/体积参数结果亦迥异及缺乏前瞻性多中心Ⅲ期临床试验验证,迄今仍缺乏公认、可广泛应用于临床的盆腔骨髓剂量-体积参数存在,无论是宫颈癌还是直肠癌患者。多个研究显示:靠近中轴骨髓(骼)所受照射的剂量-体积参数与放化疗期间的HT关系更紧密[14,19],这也许提示靠近体中轴的骨髓造血能力最旺盛。
18F-FDG-PET功能影像技术通过其所在骨骼的糖代谢能力强弱可反映出相应骨髓的造血能力与局部病变、活性骨髓的解剖分布等[26-28]。来自美国明尼苏达州大学的Yagi等[29]回顾性分析了32例同期放化疗前、后均行全身18F-PET/CT扫描患者(头颈恶性肿瘤14例、盆腔恶性肿瘤直肠癌与宫颈癌18例)的资料,对不同骨骼解剖部位的治疗前、后FDG吸收值(SUV值)进行比较与分析,结果发现:盆腔不同解剖部位骨骼的造血能力异质性明显,骶骨及腰椎区域的骨髓与白细胞及中性粒细胞抑制存在显著相关性,尤其是骶骨骨髓。
18氟脱氧胸苷(18F-fluorothymidine,FLT)为一胸腺嘧啶类似物,通过胸腺嘧啶激酶磷酸化后停留在细胞内。胸腺嘧啶激酶为DNA合成的一关键酶,在细胞周期的S期活性显著增加。因此,组织内FLT的吸收可作为细胞增殖与DNA复制的标志[30]。多个研究显示氟脱氧胸苷-正电子发生扫描(18F-fluorothymidine-positron emission tomography,FLT-PET)可准确鉴别出具有造血活性的功能性骨髓(Functional bone marrow,FBM)分布,进而指导IMRT的设计[31-33]。来自美国爱荷华大学附属医院的McGuire[33]分析了18例接受全身FLT-PET检查并与CT图像融合的肿瘤患者资料(头颈肿瘤12例,宫颈癌6例),据此对盆腔各活性骨髓的分布进行了准确定位(图4)。该研究将骨性盆腔的范围定义为:上界平L5椎体上缘,下界平坐骨结节水平,在此范围内的所有骨骼均定义为骨性盆腔。依据CT图像的骨性标志将此骨性盆腔分为17个亚区(图5)。
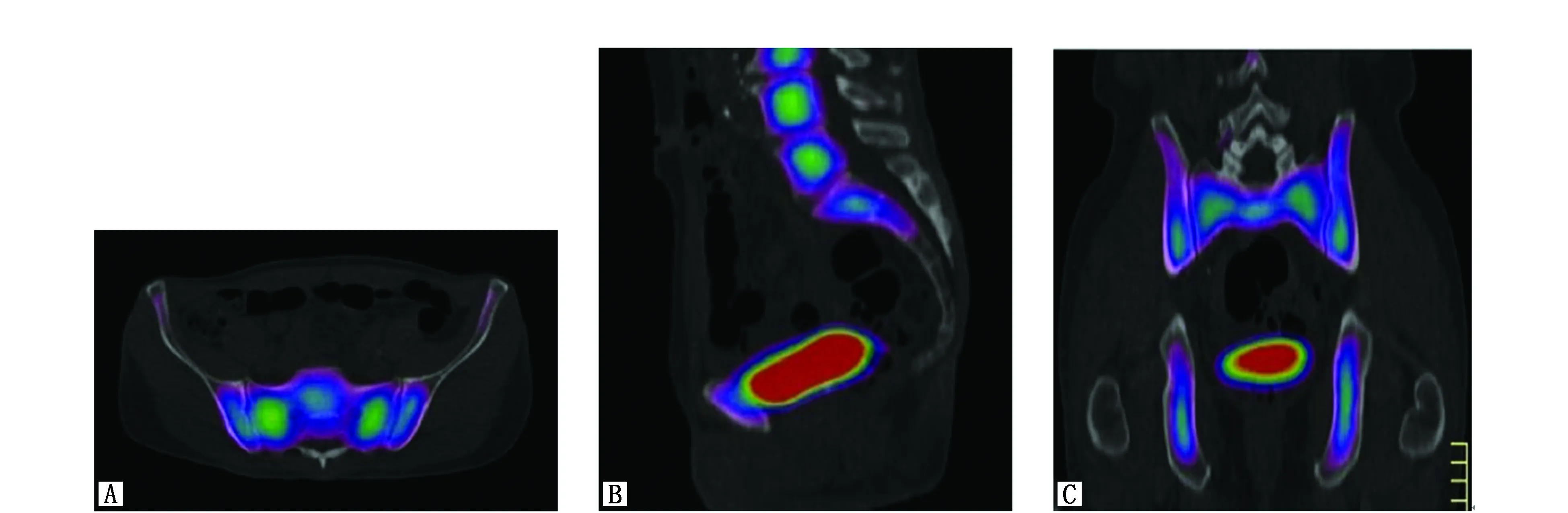
图4 FLT-PCT/CT图像显示活性骨髓区域Figure 4 FLT PET and CT images show the location of functional bone marrow Note:A.axial;B.sagittal;C.coronal.
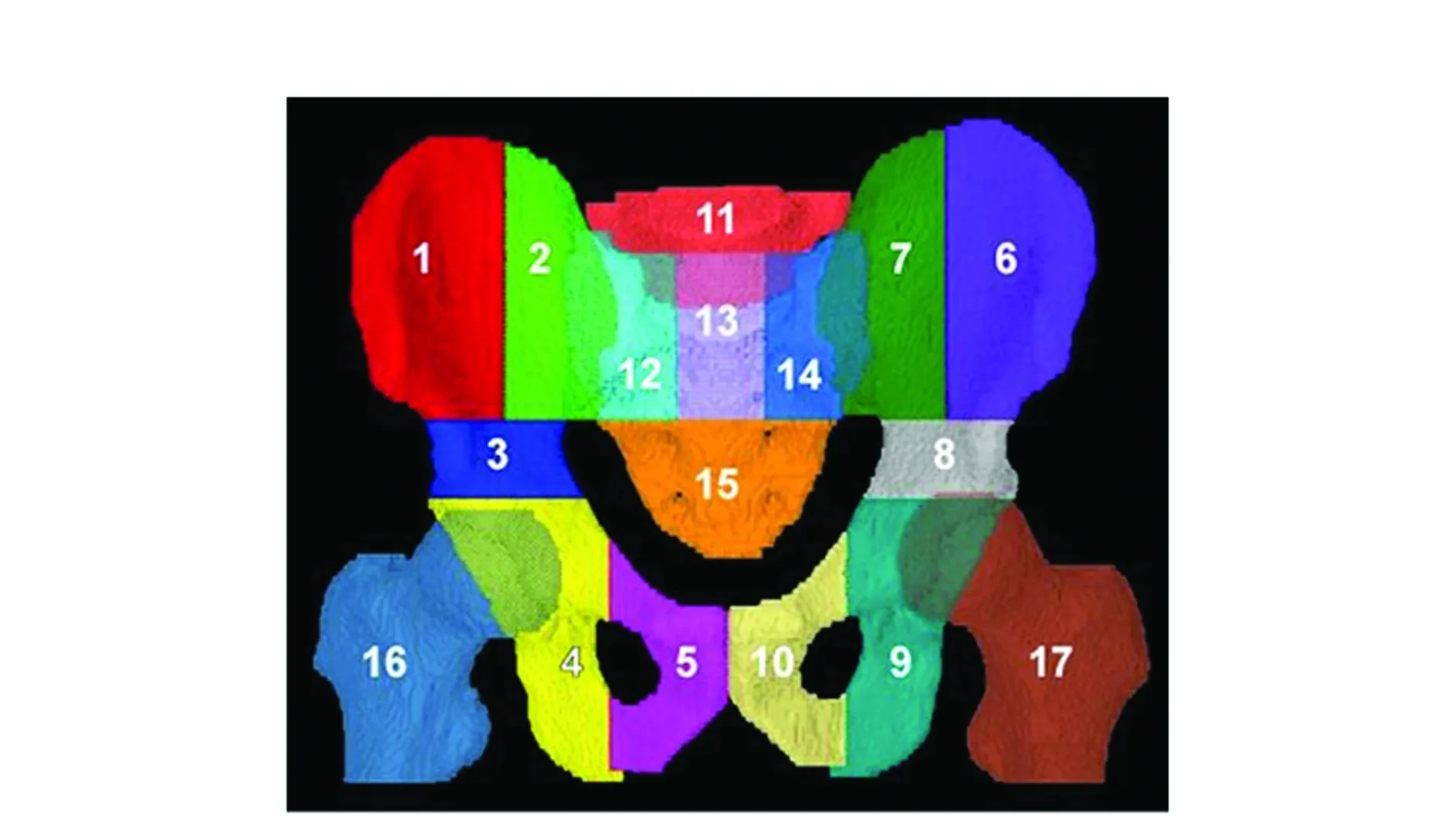
图5 基于骨性标志的盆腔骨骼分区Figure 5 Pelvic bone partition based on bone markers
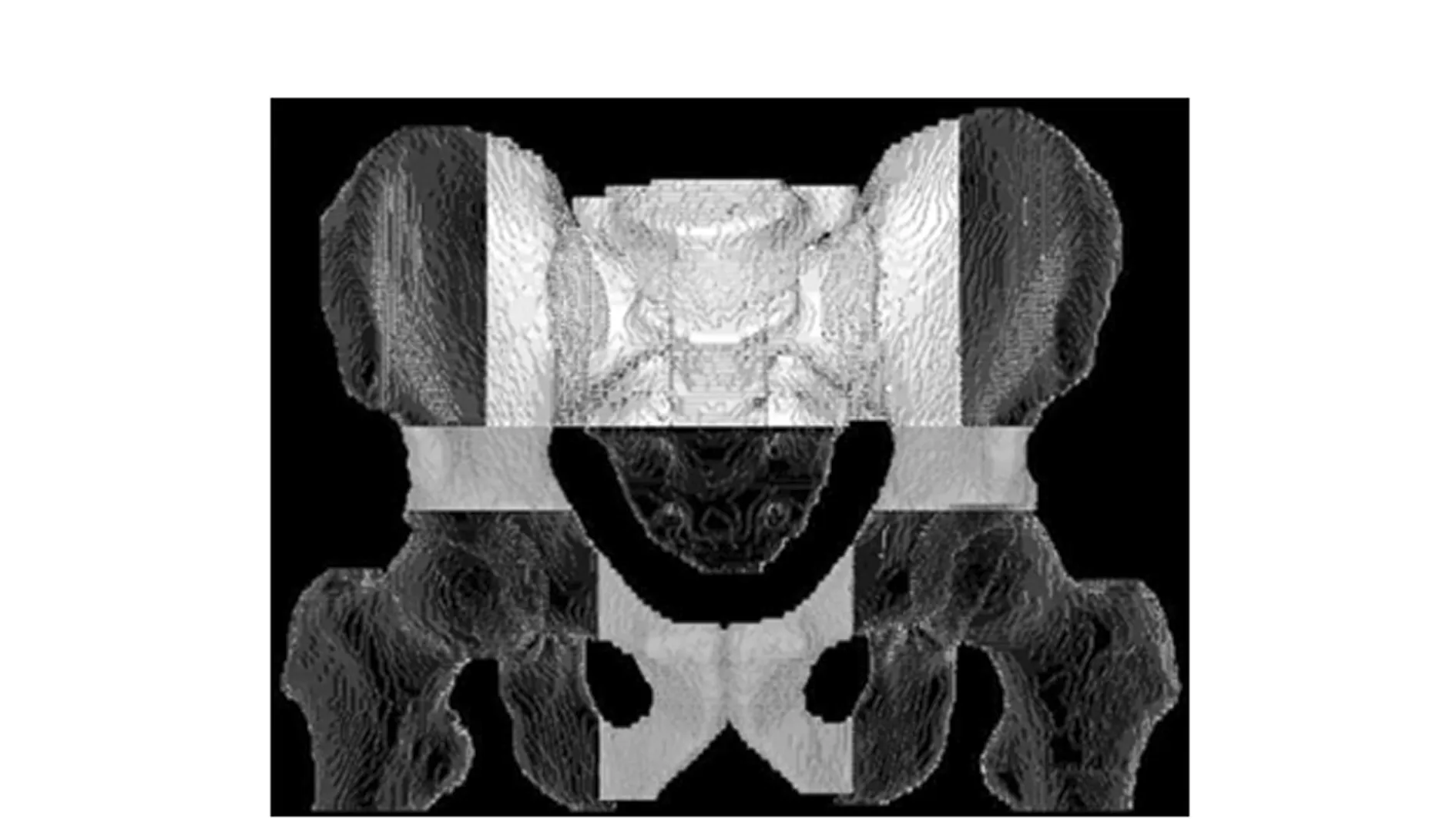
图6 FLT-PET显示盆腔功能性骨髓主要分布区域Figure 6 FLT-PET showed the main distribution area of pelvic functional bone marrow
再依据各亚区对FLT平均吸收值(SUV)的高低差异将上述17个亚区分为四组:第一组:SUV 3.3~3.7,包括11区(3.71)、12区(3.65)、14区(3.57)、2区(3.52)、7区(3.49)、13区(3.28)共6个区,代表造血活性最强区;第二组:SUV 2.6~2.9,包括3区(2.93)、8区(2.92)、5区(2.69)、10区(2.64)共4个区,代表造血活性第2强区;第三组:SUV 2.2~2.3,包括9区(2.26)、1区(2.24)、4区(2.23)、6区(2.16)共4个区;第四组:SUV 1.2~1.7,包括16区(1.69)、17区(1.68)、15区(1.23)共3个区。
盆腔FLT的主要吸收区局限于盆腔中央区的骨骼(即功能性骨髓),但不包括骶髂关节以下的骶尾骨(示意图见图6)。将平均SUV≤2.3的区域视为功能性骨髓贫瘠区。前期的剂量学研究显示IMRT技术可充分保护功能性骨髓而不影响靶区剂量覆盖及其他危及器官如膀胱、小肠等的保护[32]。迄今缺乏盆腔功能性骨髓的剂量-体积参数与盆腔恶性肿瘤放化疗期间急性HT关系的相关性研究报道。
5 小结与展望
大量研究显示盆腔受照射骨髓(骼)的剂量-体积关系与放化疗期间的急性HT存在相关,但鉴于所选择病例、治疗模式、放疗技术及剂量等差异,迄今仍缺乏可以准确预测盆腔恶性肿瘤放化疗期间发生急性HT的盆腔骨髓(骼)剂量-体积参数。减少盆腔肿瘤放化疗期间血液学毒性,有效的方法在于在制定放疗计划中对盆腔骨髓进行合理的剂量限制,尤其是保护造血功能活跃的功能性骨髓。功能影像技术能反映功能性骨髓的分布,藉此指导功能性骨髓的勾画与保护、优化放疗计划。目前,仍缺乏功能性骨髓的剂量-体积参数与放化疗期间发生HT相关性的报道。因此,准确找到IMRT治疗模式下两者之间的潜在关系是今后研究的方向。

